H9N2亚型禽流感病毒NP蛋白原核表达及多克隆抗体制备
杨 景,张新宇,梁志鹏,程 晴,王聪颖,池仕红,袁 生,郭锦玥,黄淑坚,温 峰
(佛山科学技术学院生命科学与工程学院,佛山 528225)
H9N2亚型禽流感病毒(Avian influenza virus,AIV)是近年来对家禽危害最大、传播范围最广的一种低致病性禽流感病毒(Low pathogenic avian influenza virus,LPAIV)[1]。中国最早于1992年由陈伯伦等[2]在鸡群分中离出H9N2亚型AIV,随后该亚型AIV在中国各个省份广泛传播,给养禽业造成严重的危害[3-4]。虽然H9N2亚型AIV在人上所引起的症状较轻[5-6],也未曾在人群中有效传播,但它可以为H7N9、H5N6等高致病性禽流感病毒(Highly pathogenic avian influenza virus,HPAIV)提供内部基因[7-9],可见其对公共卫生安全也造成了不容忽视的潜在危害。因此,对于H9N2亚型AIV疫情的监测和防控工作至关重要。
本研究前期在华南地区分离到1株新型H9N2亚型AIV变异株,其基因组是由G1、Y280和F98系病毒三源重组产生的[10]。值得注意的是,几乎所有人类感染的H9N2亚型AIV均来自G1和Y280系[11-12]。流感病毒的核蛋白(nucleo protein,NP)在AIV感染宿主细胞过程中发挥着重要的作用。NP可以结合聚合酶蛋白复合体形成病毒核糖核蛋白(viral ribonucleoprotein,vRNP)复合物进入宿主细胞,并在细胞核中进行转录[13]。NP蛋白在不同亚型AIV间的保守度超过90%[14],且H9N2常为其他亚型AIV提供内部基因(包括NP在内)[15],NP蛋白的单克隆抗体常被应用于AIV血清学及分子生物学检测[16-17],因此NP蛋白适合作为AIV通用检测方法的靶蛋白。本研究针对近期分离到的新型H9N2亚型AIV的NP蛋白进行了原核表达及多克隆抗体制备,以期为建立AIV通用血清学检测方法提供参考。
1 材料与方法
1.1 材料
pMD18T-BS/19-NP由佛山科学技术学院预防兽医学实验室构建并保存;原核表达载体pET-32a(+)、大肠杆菌Top10感受态细胞均由佛山科学技术学院预防兽医学实验室保存;大肠杆菌BL21(DE3)和E.coliRosetta(DE3)感受态细胞均购自南京诺唯赞科技股份有限公司;高保真PCR酶、胶回收试剂盒和质粒提取试剂盒均购自Thermo Fisher Scientific公司;BamH Ⅰ、SalⅠ及T4连接酶均购自NEB公司;IPTG、His标签抗体、HRP标记山羊抗小鼠IgG(H+L)、SDS-PAGE蛋白上样缓冲液、蛋白分子质量标准、考马斯亮蓝快速染色液、BCA蛋白浓度测定试剂盒、弗式佐剂均购自上海碧云天生物技术有限公司;NP蛋白单克隆抗体购自北京义翘神州科技股份有限公司;SDS-PAGE凝胶配制试剂盒、PMSF、ECL显色液均购自上海百赛生物技术有限公司。80日龄健康雌性新西兰大白兔购自广东省医学实验动物中心(许可证号:SCXK(粤)2019―0035)。动物试验经佛山科学技术学院(许可证号:SYXK(粤)2020―0235)实验动物伦理委员会批准。
1.2 引物设计与合成
根据BS/19NP基因序列,利用Primer Premier 5.0软件设计引物,上、下游引物分别添加BamH Ⅰ和SalⅠ酶切位点(下划线处)。引物序列为:H9N2-NP-F:5′-CGCGGATCCATGGCGTCTCA-AGGCAC-3′;H9N2-NP-R:5′-CCGGTCGACTT-TCTTTAATTGTCATACTCC-3′。引物由生工生物工程(上海)股份有限公司合成。
1.3 NP蛋白原核表达载体构建
以pMD18T-BS/19-NP为模板扩增H9N2亚型AIV的NP基因。PCR反应体系25 μL:高保真PCR酶12.5 μL,上、下游引物(10 μmol/L)各1.25 μL,模板质粒(0.1 ng/μL)1 μL,ddH2O 9 μL。PCR反应条件:98 ℃预变性30 s;98 ℃变性10 s,53 ℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳鉴定并回收,将其克隆至pMD18-T载体,重组质粒命名为pMD18T-H9N2-NP。将带有酶切位点的pMD18T-H9N2-NP质粒与原核表达载体pET-32a(+)分别用BamH Ⅰ和SalⅠ双酶切。按照T4 DNA连接酶说明书在16 ℃连接12 h。连接产物转化大肠杆菌Top10感受态细胞,培养后提取重组质粒,命名为pET-32a-H9N2-NP,经酶切鉴定后送生工生物工程(上海)股份有限公司测序。
1.4 NP蛋白诱导表达
将重组质粒pET-32a-H9N2-NP同时转化大肠杆菌BL21(DE3)和Rosetta(DE3)感受态细胞,取含pET-32a-H9N2-NP及pET-32a(+)空载体质粒的大肠杆菌BL21(DE3)和Rosetta(DE3)菌液,按1∶100(V/V)分别接种至含Amp的LB培养基,37 ℃、220 r/min振荡培养约3 h(至菌液D600 nm值为0.6),取1 mL菌液作为未诱导对照,其余菌液加入终浓度为1 mmol/L的IPTG后,37 ℃、220 r/min振荡培养诱导4 h。4 ℃、8 000 r/min离心5 min,收集菌体沉淀进行12% SDS-PAGE分析。
1.5 NP蛋白Western blotting鉴定
菌体蛋白经12% SDS-PAGE分离后转印到PVDF膜上,采用5%脱脂奶粉在摇床室温封闭2 h后,用PBST冲洗3次;分别采用His标签抗体和NP蛋白抗体作为一抗,4 ℃孵育过夜,用PBST冲洗3次;以HRP标记的山羊抗小鼠IgG(1∶1 000)为二抗,在摇床室温孵育2 h,用PBST冲洗3次;采用ECL显色液进行化学发光显色,鉴定目的蛋白。
1.6 表达条件的优化及可溶性分析
为提高NP蛋白的表达量,对诱导剂IPTG浓度(0.2、0.4、0.6、0.8、1.0、1.2、1.4和1.6 mmol/L)、诱导时间(1、2、3、4、5、6、7、8 h)进行优化,同时作未诱导对照,并比较16、25与37 ℃时蛋白在破碎上清和沉淀中的表达差异。各条件下的样品经12% SDS-PAGE分离及考马斯亮蓝染色后进行分析。
1.7 蛋白纯化、复性及浓缩
在优化的条件大量诱导表达重组蛋白,收集菌体沉淀,超声破碎后,将包涵体蛋白用8 mol/L尿素变性,在变性条件下采用镍柱亲和层析的方法进行蛋白纯化;将纯化后的蛋白装入透析袋中,在6、4、2、0 mol/L尿素浓度下进行复性;将蛋白包埋在PEG20000中浓缩至目标体积,采用BCA蛋白浓度测定试剂盒测定蛋白浓度,―80 ℃保存备用。
1.8 兔多克隆抗体的制备及评价
以1 mg/只的剂量将纯化的重组NP蛋白经皮下多点注射免疫新西兰大白兔。首免采用等体积弗氏完全佐剂乳化蛋白;首免14、28 d后采用弗式不完全佐剂乳化蛋白,进行二免和三免;三免7 d后进行心脏采血分离血清。分别以纯化后的NP蛋白和H9N2亚型AIV病毒液作为抗原,以制备的兔多克隆抗体作为一抗,按1.4方法进行Western blotting分析。将H9N2亚型AIV接种96孔板MDCK细胞,感染24 h后每孔加入100 μL的甲醇、丙酮混合液(1∶1)固定细胞。将自制兔抗NP血清用PBS从1∶100(V/V)开始进行2倍倍比稀释,作为一抗,同时将免疫前的兔血清稀释100倍作为阴性对照,进行间接免疫荧光(indirect immunofluorescence assay,IFA)试验。将纯化的重组NP蛋白稀释至2 μg/mL作为包被抗原,通过间接ELISA测定所制备的NP蛋白多克隆抗体效价。
2 结 果
2.1 H9N2 NP基因扩增及原核表达质粒构建
PCR扩增H9N2NP基因使其带上酶切位点,经1.0%琼脂糖凝胶电泳鉴定,结果显示,PCR产物大小约1 500 bp(图1A),与预期大小相符。将PCR产物克隆至pMD18-T载体,与pET-32a(+)同时酶切后构建pET-32a-H9N2-NP重组质粒,菌液PCR扩增出约1 500 bp的片段,双酶切后得到1 500和5 900 bp两条带,均分别与预期大小一致(图1B)。测序结果显示,克隆至pET-32a(+)载体的H9N2NP基因序列与原始毒株序列一致,表明原核表达质粒构建成功。
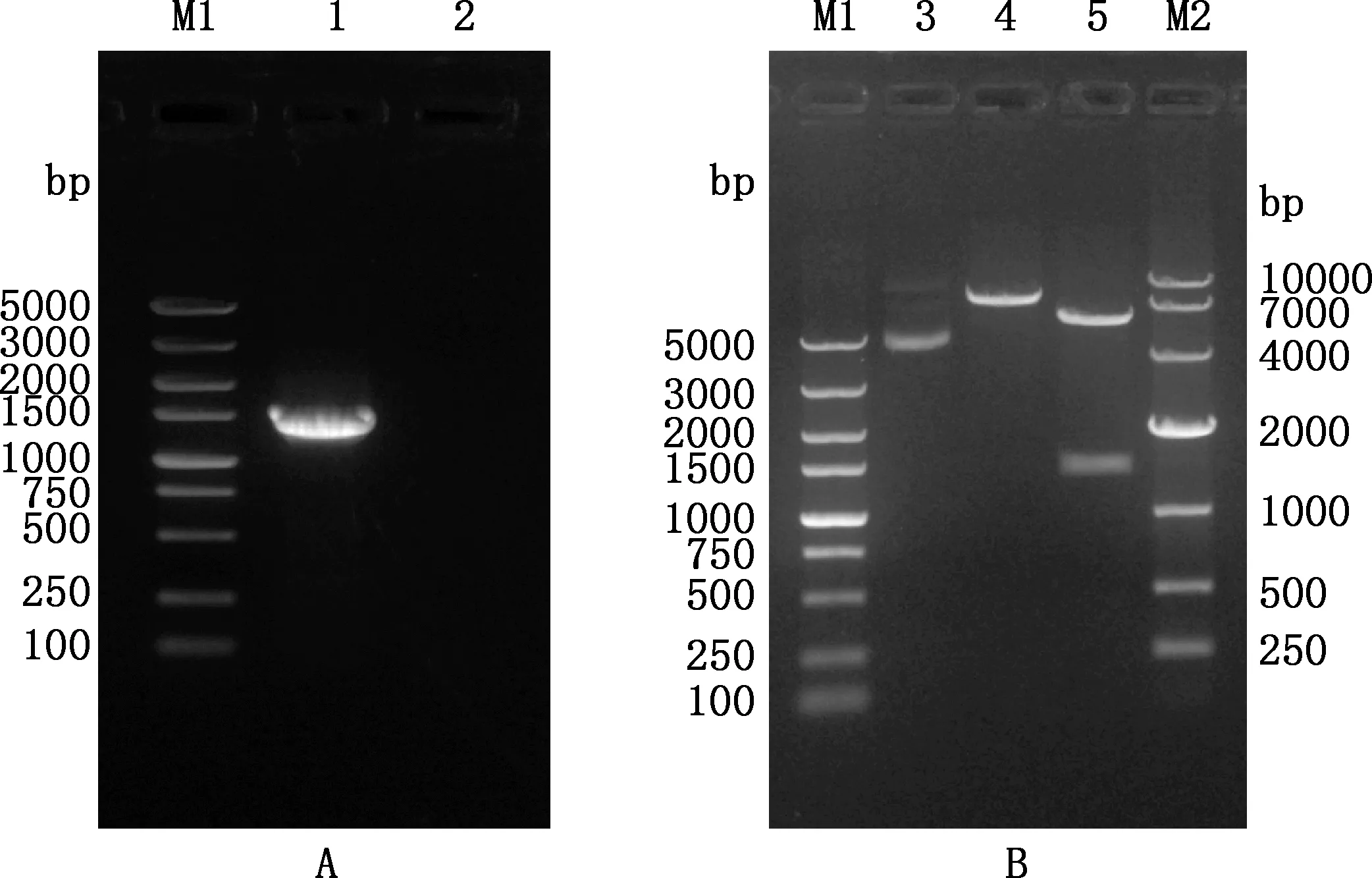
M1,DL5000 DNA Marker;1,H9N2 NP基因PCR扩增产物;2,阴性对照;3,重组质粒pET-32a-H9N2-NP;4,重组质粒pET-32a-H9N2-NP经BamH Ⅰ单酶切鉴定;5,重组质粒pET-32a-H9N2-NP经BamH Ⅰ和Sal Ⅰ双酶切鉴定;M2,DL10000 DNA Marker M1,DL5000 DNA Marker;1,PCR amplification products of of H9N2 NP gene;2,Negtive control;3,The recombinant plasmid pET-32a-H9N2-NP;4,The recombinant plasmid pET-32a-H9N2-NP identified by BamH Ⅰ digestion;5,The recombinant plasmid pET-32a-H9N2-NP identified by BamH Ⅰ and Sal Ⅰ digestion;M2,DL10000 DNA Marker图1 H9N2 NP基因扩增(A)及重组质粒酶切鉴定(B)Fig.1 PCR amplification of H9N2 NP gene (A) and enzymatic digestion identification of the recombinant plasmids (B)
2.2 NP蛋白表达的SDS-PAGE和Western blotting鉴定
将pET-32a-H9N2-NP分别转化大肠杆菌BL21(DE3)和Rosetta(DE3)感受态细胞,诱导表达后菌样进行12% SDS-PAGE,考马斯亮蓝染色后显示,诱导后的重组菌pET-32a-NP/Rosetta(DE3)在70 ku附近有一条十分明显的条带,与预期大小一致,而诱导后的重组菌pET-32a-NP/BL21(DE3)在相同位置也有一条很细的条带,远低于在大肠杆菌Rosetta(DE3)中的表达量(图2A)。Western blotting结果表明,该蛋白能与His标签抗体和NP蛋白抗体结合(图2B、2C)。对重组NP蛋白的表达条件进行优化,最终确定在1 mmol/L IPTG、37 ℃条件下诱导7 h为最佳诱导条件,且目的蛋白主要以包涵体形式表达(图3~5)。
2.3 亲和层析纯化与鉴定
为确保His标签能够彻底暴露,将包涵体蛋白超声破碎后在变性条件下溶解,然后采用镍柱进行亲和层析纯化,蛋白纯化效果见图6,纯化后的蛋白较纯化前杂蛋白明显减少。
2.4 浓缩后蛋白浓度测定及Western blotting鉴定
纯化后的蛋白在6、4、2、0 mol/L尿素下进行复性,然后包埋在PEG20000中进行浓缩,采用BCA蛋白浓度测定试剂盒测得蛋白浓度为0.2 mg/mL。Western blotting结果表明,复性浓缩后的蛋白能与His标签抗体(图7A)和NP蛋白抗体(图7B)结合。
2.5 多克隆抗体验证及抗体效价测定
分别以纯化后的NP蛋白和H9N2亚型AIV病毒液作为抗原,以制备的兔多克隆抗体作为一抗,进行Western blotting检测,所制备的兔多克隆抗体在稀释104倍后仍能与NP蛋白和H9N2亚型AIV有效结合(图8)。将H9N2亚型AIV接种96孔板MDCK细胞,感染24 h进行IFA试验,以制备的兔多克隆抗体倍比稀释后作为一抗,以免疫前兔血清作为阴性对照,阳性血清在稀释1 600倍后还能观察到绿色荧光(图9)。间接ELISA测得所制备的兔多克隆抗体效价高达1∶409 600(图10),表明NP蛋白具有良好的免疫原性。

① A,SDS-PAGE分析;B,Western blotting分析(一抗为His标签抗体);C,Western blotting分析(一抗为NP抗体)。② M1,蛋白质分子质量标准;1,pET-32a(+)/Rosetta(DE3)诱导后;2,pET-32a(+)/BL21(DE3)诱导后;3,pET-32a-NP/Rosetta(DE3)诱导前;4,pET-32a-NP/Rosetta(DE3)诱导后;5,pET-32a-NP/BL21(DE3)诱导前;6,pET-32a-NP/BL21(DE3)诱导后;M2,彩色预染蛋白质分子质量标准;7,pET-32a-NP/BL21(DE3)诱导后;8,pET-32a-NP/Rosetta(DE3)诱导前;9,pET-32a-NP/Rosetta(DE3)诱导后 ① A,SDS-PAGE analysis;B,Western blotting analysis (the primary antibody is His tag antibody);C,Western blotting analysis (the primary antibody is NP antibody).② M1,Protein Marker;1,pET-32a(+) after induction in E. coli Rosetta(DE3);2,pET-32a(+) after induction in E. coli BL21(DE3);3,pET-32a-NP without induction in E. coli Rosetta(DE3);4,pET-32a-NP after induction in E. coli Rosetta(DE3);5,pET-32a-NP without induction in E. coli BL21(DE3);6,pET-32a-NP after induction in E. coli BL21(DE3);M2,Prestained Protein Marker;7,pET-32a-NP after induction in E. coli BL21(DE3);8,pET-32a-NP without induction in E. coli Rosetta(DE3);9,pET-32a-NP after induction in E. coli Rosetta(DE3)图2 pET-32a-NP/BL21(DE3)、pET-32a-NP/Rosetta(DE3)重组蛋白SDS-PAGE及Western blotting分析Fig.2 SDS-PAGE and Western blotting analysis of the recombinant pET-32a-NP protein in E. coli BL21(DE3)and Rosetta (DE3)
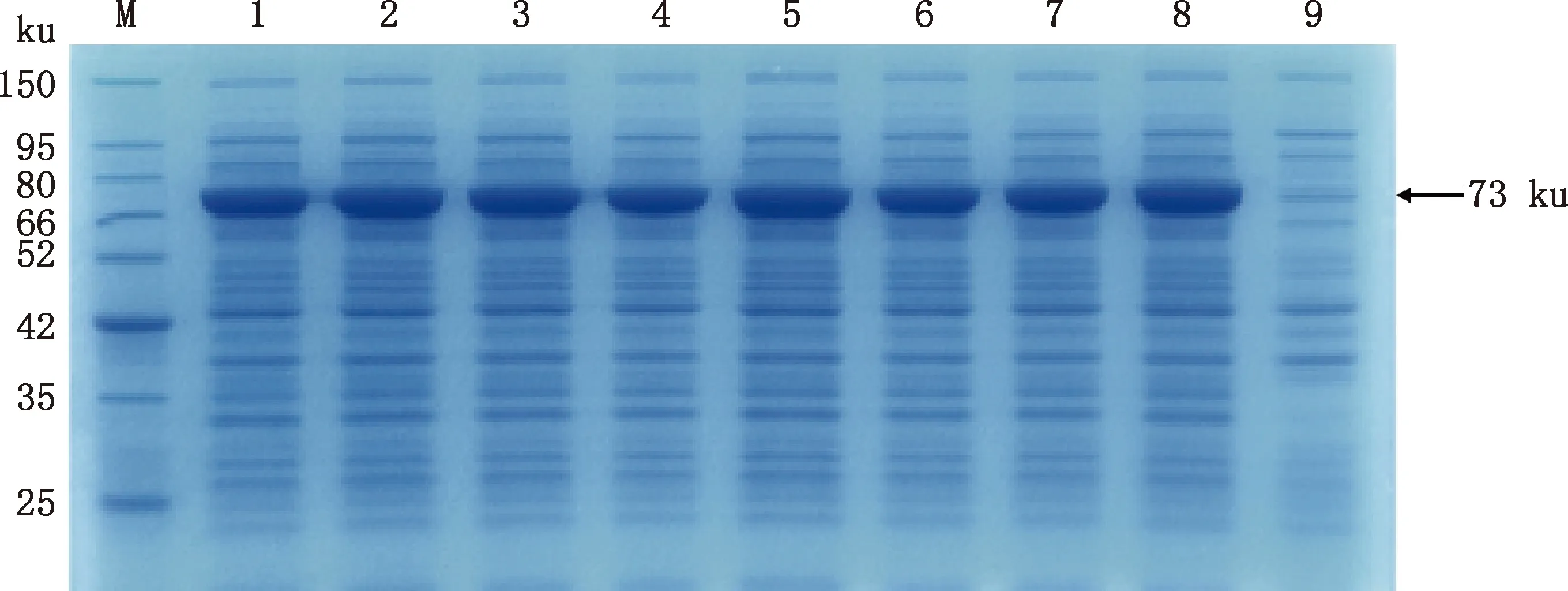
M,蛋白质分子质量标准;1~8,IPTG浓度分别为0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mmol/L;9,空载体对照 M,Protein Marker;1-8,Concentrations of IPTG were 0.2,0.4,0.6,0.8,1.0,1.2,1.4 and 1.6 mmol/L,respectively;9,Blank vector control图3 不同浓度IPTG诱导NP蛋白表达Fig.3 NP protein expression induced by different concentrations of IPTG
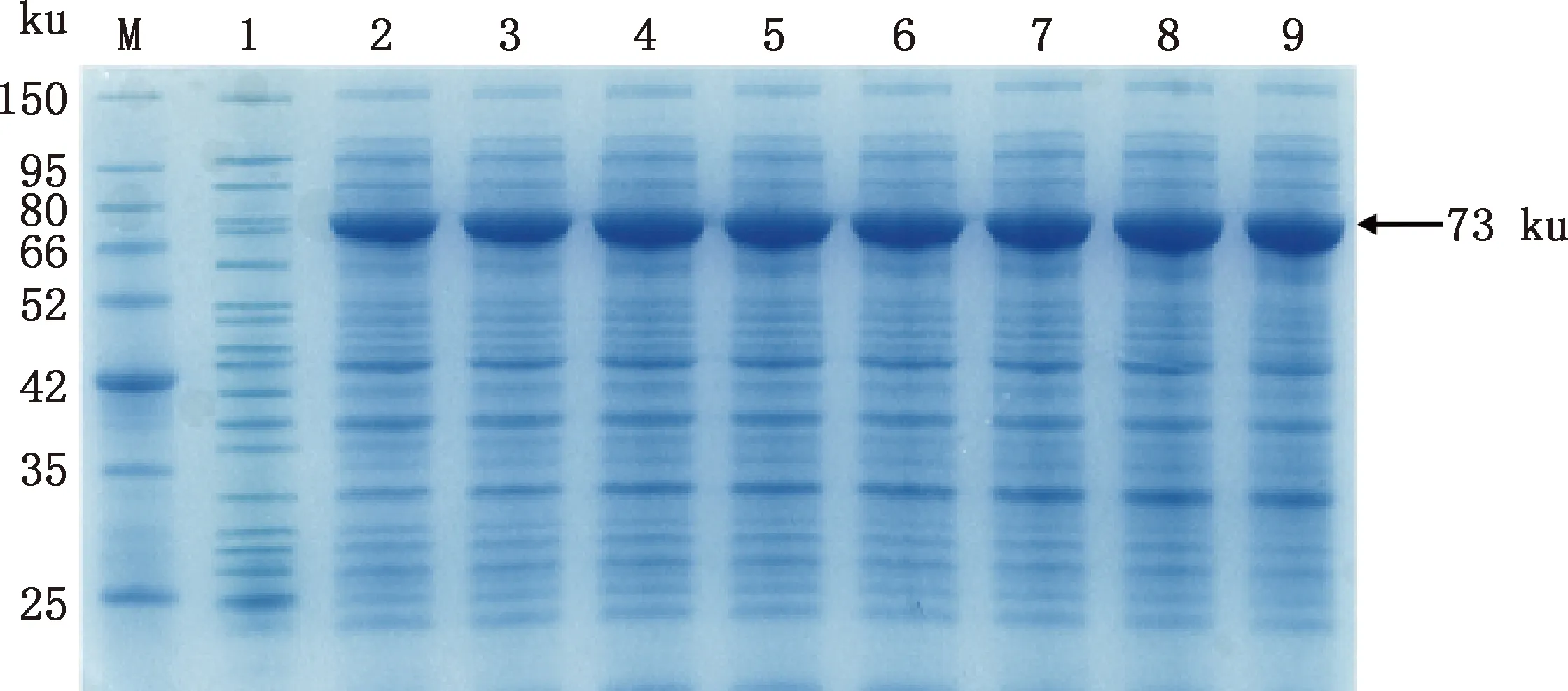
M,蛋白质分子质量标准;1~9,诱导时间分别为0、1、2、3、4、5、6、7、8 h M,Protein Marker;1-9,Induction time was 0,1,2,3,4,5,6,7 and 8 h,respectively图4 不同时间诱导NP蛋白表达Fig.4 NP protein expression induced by different time

M,蛋白质分子质量标准;1,诱导后全菌;2,未诱导全菌;3,16 ℃诱导上清;4,16 ℃诱导沉淀;5,25 ℃诱导上清;6,25 ℃诱导沉淀;7,37 ℃诱导上清;8,37 ℃诱导沉淀 M,Protein Marker;1,Full bacteria after induction;2,Full bacteria without induction;3,Hyperacoustic supernatant when induction temperature was 16 ℃;4,Hyperacoustic precipitation when induction temperature was 16 ℃;5,Hyperacoustic supernatant when induction temperature was 25 ℃;6,Hyperacoustic precipitation when induction temperature was 25 ℃;7,Hyperacoustic supernatant when induction temperature was 37 ℃;8,Hyperacoustic precipitation when induction temperature was 37 ℃图5 不同温度诱导NP蛋白表达Fig.5 NP protein expression induced by different temperatures
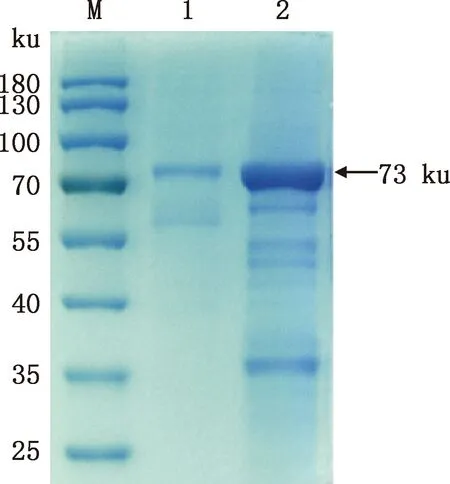
M,预染蛋白质分子质量标准;1,纯化后的重组蛋白;2,未纯化重组蛋白 M,Prestained Protein Marker;1,Purified recombinant protein;2,Unpurified recombinant protein图6 NP蛋白纯化SDS-PAGE结果Fig.6 SDS-PAGE result of the purification of NP protein

①A,一抗为His标签抗体;B,一抗为NP蛋白抗体。②M,预染蛋白质分子质量标准;1,纯化后的重组蛋白;2,未纯化的重组蛋白 ①A,The primary antibody is His tag antibody;B,The primary antibody is NP protein antibody. ②M,Prestained Protein Marker;1,Purified recombinant protein;2,Unpurified recombinant protein图7 纯化后重组蛋白的Western blotting鉴定Fig.7 Western blotting identification of the purified recombinant protein
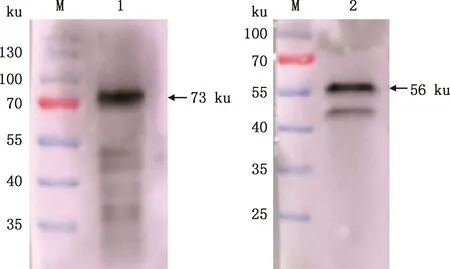
M,预染蛋白质分子质量标准;1,抗原为纯化后的重组蛋白;2,抗原为H9N2亚型AIV M,Prestained Protein Marker;1,The antigen is purified recombinant protein;2,The antigen is H9N2 subtype AIV图8 NP抗血清Western blotting鉴定Fig.8 Western blotting identification of NP antiserum

图9 NP抗血清IFA验证(100×)Fig.9 IFA result of NP antiserum (100×)
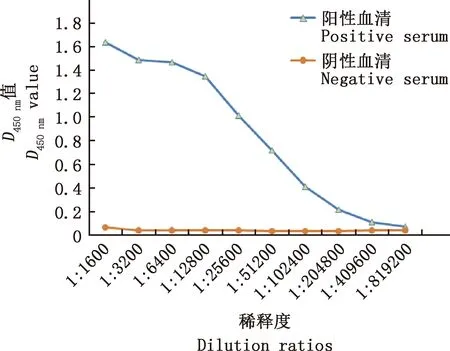
图10 NP抗血清抗体效价测定Fig.10 Antibody titer determination of NP antiserum
3 讨 论
H9N2亚型AIV在世界范围内广泛传播[18],但其引起的临床症状不够典型,与一些其他病毒引起的症状相似[19]。H9N2能造成家禽的免疫抑制,导致其他呼吸道疾病的严重继发感染[19-20],临床病理表现复杂,因此需要实验室检测来进行确诊。HI试验是AIV常用的血清学检测方法,但HI试验针对的靶蛋白是HA。HA蛋白时常为了逃避免疫而发生抗原漂移,导致标准抗体血清与流行株的交叉反应能力下降[21],造成HI试验的灵敏度下降。而NP蛋白具有型特异性,在不同亚型AIV间的保守度超过90%,因此常被选作为流感病毒ELISA检测的靶蛋白。Wu等[22]建立了H9N2亚型AIV NP蛋白的ELISA检测方法,该方法较HI试验更加灵敏,且能够同时检测H1~H15亚型甲型流感病毒。因此,以NP蛋白为靶点的AIV检测方法具有很强的应用价值。本研究对前期分离到的1株三源重组的Y280系H9N2亚型AIV进行了NP蛋白的原核表达和多克隆抗体制备,旨在为后期单克隆抗体的制备及ELISA检测方法的建立奠定基础。
本研究中,H9N2 NP蛋白在大肠杆菌Rosetta(DE3)感受态细胞中的表达水平远远高于大肠杆菌BL21(DE3)感受态细胞,与楼晶瑶[23]研究结果一致。大肠杆菌Rosetta(DE3)感受态细胞较大肠杆菌BL21(DE3)感受态细胞补充了6种稀有密码子,序列分析发现,BS/19 NP蛋白中大肠杆菌稀有密码子约占20%,因此更易在大肠杆菌Rosetta(DE3)感受态细胞中表达。可溶性分析结果表明,目的蛋白以包涵体沉淀的形式表达。包涵体的产生是由于蛋白在大肠杆菌中表达过快而来不及正确折叠[24-25],后期需要经过繁琐的变性、复性来纯化并得到具有正确生物学活性的蛋白。通过降低诱导温度能够使目的蛋白缓慢表达以增加蛋白折叠的时间,本研究在25 ℃诱导时,破碎上清中也能检测到目的蛋白,但大部分仍以包涵体沉淀的形式表达,且破碎上清中杂蛋白较多,不利于下游的纯化工作,今后可以尝试通过在载体上引入可溶性标签来帮助目的蛋白的可溶性表达。
通过ELISA测得所制备的兔抗NP血清效价达到1∶409 600,表明NP蛋白具有良好的免疫原性。但本研究的免疫原为带有His标签的重组NP蛋白,同时ELISA试验的包被抗原也带有His标签。虽然His标签的分子质量很小,但抗体效价测定结果也可能会受到影响。Western blotting及IFA试验结果均表明,所制备的NP抗血清能够高效地与H9N2亚型AIV结合,且特异性良好,可作为后期AIV NP蛋白血清学鉴定的生物材料。
4 结 论
本研究利用原核表达系统成功表达了H9N2亚型AIV NP蛋白,通过镍柱亲和层析获得了纯度较高的重组蛋白。免疫新西兰大白兔后获得NP蛋白多克隆抗体,间接ELISA测得抗体效价为1∶409 600,NP多克隆抗体能与BS/19病毒高效结合,表明NP蛋白免疫原性良好,可作为后期试验的生物材料。
——一道江苏高考题的奥秘解读和拓展

