糖络宁调控miR-211 对糖尿病周围神经病变大鼠背根神经元凋亡的影响
张 晨 陈 枫 辛竞妍 朱雨菲 李 矜 吴长江 谢文莹 张涛静
1.北京中医药大学第二临床医学院,北京 100029;2.北京中医药大学东方医院内分泌科,北京 100078
背根神经元(dorsal root ganglion neurons,DRGn)是人体内重要的感觉神经元,位于血神经屏障之外的特殊生理位置使其暴露在全身代谢和缺氧应激下,在高糖环境中更容易受到损害[1]。DRGn 细胞凋亡是糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)发生发展的重要因素[2-3]。既往研究发现,高糖能抑制DPN 大鼠DRGn 细胞活性,糖络宁可以降低高糖引起的细胞凋亡水平[4-5],其作用与内质网应激下的蛋白激酶R 样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)/C/EBP 同源蛋白(C/EBP homologous protein,CHOP)凋亡通路有关[6],而更深层的介导基因尚未明确。微RNA(microRNA,miRNA)在内质网应激下是调控细胞从保护性的未折叠蛋白反应转至激活凋亡的关键因子[7-8],其中miR-211 依赖PERK 诱导而作用于促凋亡转录因子CHOP 的表达[9]。本研究以miR-211 为切入点,通过体外实验观察糖络宁对大鼠DRGn 凋亡的影响及miR-211 在其中的作用,探讨其治疗DPN 的作用机制。
1 材料与方法
1.1 实验动物
用于制备含药血清和空白血清的SPF 级SD 大鼠[60 只,8 周龄雄性,体重(200±30)g]及用于提取DRGn 细胞的SPF 级SD 怀孕大鼠均购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2016-0006。大鼠饲养于北京中医药大学动物实验中心,实验室环境为国标GB14925-2001[10]规定的动物实验设施及大鼠SPF 级屏障环境。本研究经北京中医药大学东方医院实验动物伦理委员会批准(201811)。实验中心温度(20±2)℃,湿度45%~65%,12 h 明暗交替。
1.2 实验用药
糖络宁制剂(由生黄芪、丹参、川牛膝、狗脊、全蝎组成)为北京中医药大学东方医院药房提供,浓度为生药0.5 g/ml。
1.3 主要试剂及仪器
BeyoRTTMⅡcDNA 第一链合成试剂盒(碧云天公司,批号:D7168S)、BCA 蛋白浓度测定试剂盒(MDL,批 号:MD913053)、Annexin V-FITC/PI Kit/凋亡检测试剂盒(北京四正柏生物科技有限公司,批号:FXP018)、Neurobasal 培养基(Gibco,批号:21103049)、兔抗PERK、转录激活因子4(activator of transcription 4,ATF4)、真核细胞起始因子2α(eukaryotic initiation factor 2α,eIF2α)(abcam,批号:ab186284、ab216839、ab32157)、兔抗CHOP(Cell Signaling 公司,批号:L63F7)、低温离心机(德国Sigma 公司,型号:3-30K)、荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪(美国Applied biosystems,型 号:StepOne Softwar),电泳仪(北京百晶生物技术有限公司,型号:BG-subMIDI)。
1.4 研究方法
1.4.1 糖络宁含药血清的制备 雄性SD 大鼠60 只,适应性喂养1 周后,采用随机数字表法将其分为糖络宁含药血清组(30 只)和空白血清组(30 只),分别以糖络宁组方生药2.5 g/(kg·d)灌胃和等体积蒸馏水灌胃,连续给药10 d,末次给药后2 h 内以2%戊巴比妥(40 mg/kg)腹腔注射麻醉,腹主动脉取血,3000 次/min重复10 min(半径95 mm,温度4℃)离心,分离血清水浴灭活,过滤除菌后,-80℃环境中冷冻保存。
1.4.2 DRGn 细胞分离培养及分组 DRGn 细胞分离培养参照既往实验[11-12],神经元专用培养基中细胞贴壁达70%~80%后,进行分组。将细胞分为正常组、高糖组、糖络宁组、miR-211 抑制剂阴性组和miR-211 抑制剂组。正常组给予10%空白血清+神经元专用培养基;高糖组给予10%空白血清+高糖神经元专用培养基(含50 mmol/L 葡萄糖);糖络宁组予10%糖络宁含药血清+高糖神经元专用培养基;miR-211 抑制剂阴性组和miR-211 抑制剂组分别先予空载体和miR-211 抑制剂载体转染DRGn 细胞,再予10%空白血清+高糖神经元专用培养基培养。各组细胞干预24 h,随后收集细胞进行相关检测。
1.4.3 流式细胞仪检测 经胰酶消化、1 000 次/min 重复5 min 二次离心(离心半径95 mm,温度4℃)及稀释(调节浓度为1×105~5×105个/ml)后收集细胞悬液于流式管中。室温避光孵育,孵育5 min 后加入10 μl碘化丙锭溶液、400 μl PBS,立刻进行流式检测,用Cell Quest 软件进行分析,绘制双色散点图。
1.4.4 实时荧光定量PCR 提取各组实验细胞miR-211,使用BeyoRTTMⅡcDNA 第一链合成试剂盒将miR-211合成cDNA,根据引物设计原则,利用Primer 6 设计合成引物,引物序列见表1。取上述cDNA 及对应引物,开始qRT-PCR 反应程序,反应体系共20 μl:cDNA 2 μl,master mix 10 μl,正向引物1 μl,反向引物1 μl,ddH2O 6 μl。反应条件见表2。每次反应均设阴性平行对照组,实验重复3 次,根据得到的荧光信号计算Ct 值及基因的相对表达量。

表1 miR-211 引物序列
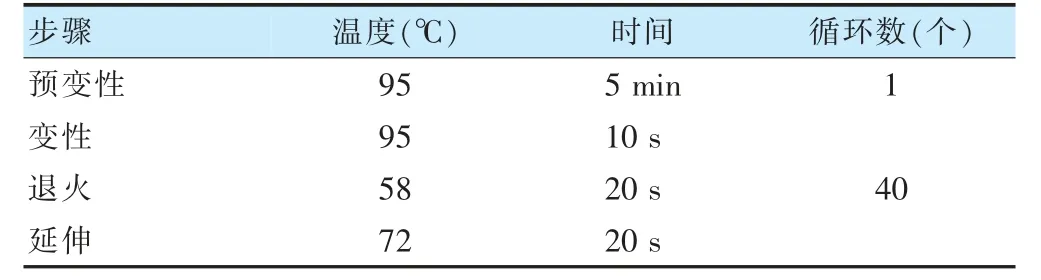
表2 聚合酶链式反应条件
1.4.5 Western blot 采用细胞悬液5 倍体积的细胞裂解液,提取总蛋白,经BCA 试剂盒进行浓度测定后,SDS-PAGE 法分离蛋白质,转移至PVDF 膜,5%脱脂奶粉溶液封闭摇动1 h,采用兔PERK、eIF2α、ATF4、CHOP 抗体(1∶1 000)4℃孵育过夜,并用HRP 标记山羊抗兔IgG(H+L)室温下孵育60 min(1∶4 000),最终显色成像获得蛋白条带,Image J 软件计算灰度值。
1.5 统计学方法
采用SPSS 26.0 对所得数据进行统计学分析。计量资料采用均数±标准差()表示,比较采用t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 五组细胞凋亡率比较
高糖组细胞凋亡率高于正常组,差异有统计学意义(P <0.05)。高糖组与miR-211 抑制剂阴性组细胞凋亡率比较,差异无统计学意义(P >0.05)。糖络宁组和miRNA-211 抑制剂组细胞凋亡率低于高糖组,差异有统计学意义(P <0.05)。见图1~2。
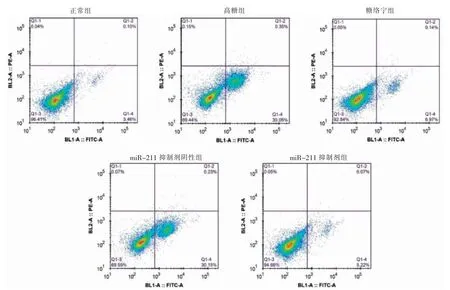
图1 各组细胞凋亡率散点图
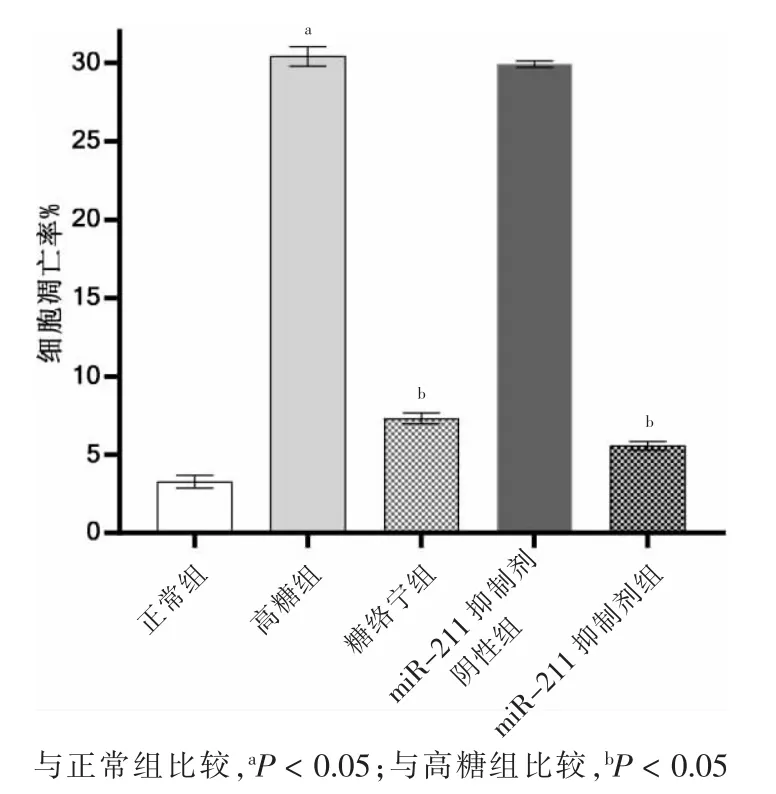
图2 五组细胞凋亡率比较(n=3)
2.2 五组miR-211 基因表达情况比较
高糖组miR-211 基因表达高于正常组,差异有统计学意义(P <0.05)。高糖组与miR-211 抑制剂阴性组miR-211 基因表达比较,差异无统计学意义(P >0.05)。糖络宁组和miR-211 抑制组miR-211 基因表达低于高糖组,差异有统计学意义(P <0.05)。见图3。
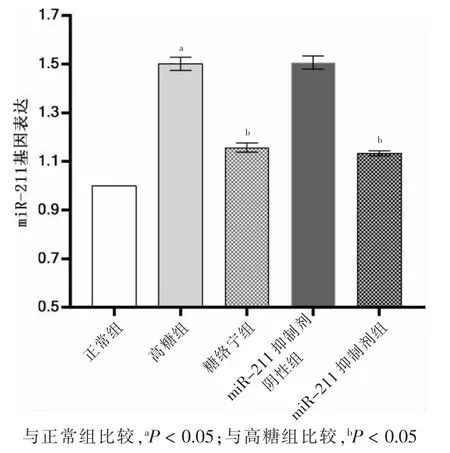
图3 五组miR-211 基因表达情况比较(n=3)
2.3 五组PERK、eIF2α、ATF4、CHOP 蛋白表达水平比较
高糖组PERK、eIF2α、ATF4、CHOP 蛋白表达水平高于正常组,差异有统计学意义(P <0.05)。高糖组与miR-211 抑制剂阴性组PERK、eIF2α、ATF4、CHOP蛋白表达水平比较,差异无统计学意义(P >0.05)。糖络宁组和miRNA-211抑制组PERK、eIF2α、ATF4、CHOP 蛋白表达水平低于高糖组,差异有统计学意义(P <0.05)。见图4~5。

图4 五组PERK、eIF2α、ATF4、CHOP 蛋白表达条带图
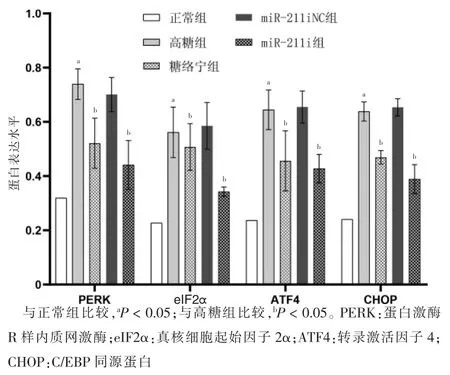
图5 五组PERK、eIF2α、ATF4、CHOP 蛋白表达水平比较
3 讨论
糖尿病周围神经病变属于中医“消渴病痹症”范畴,以气虚血瘀或阴虚血瘀,气阴两虚夹瘀,阴阳两虚夹痰瘀,阳虚寒凝,肝肾亏虚的规律动态演变[13-15]。高彦彬教授基于络病理论,认为其病机本质为气阴两虚、脉络瘀阻,治疗上强调以滋阴补气、活血化瘀通络为要,研制出中药成方糖络宁,临床疗效确切[16]。经既往研究证实,糖络宁可以减轻内质网应激的损害,抑制坐骨神经及施万细胞中PERK/IRE1α-CHOP、PI3K/Akt通路的表达,改善施万细胞及DRGn 细胞凋亡[17-22]。
目前临床普遍认为,血糖升高会激发内质网应激,长期持续的应激和细胞损伤启动细胞凋亡,但在应激背景下如何协调其他通路启动细胞凋亡,其转变的关键节点仍在探索。研究发现,PERK 信号依赖性的miR-211 可以抑制生物钟协调新陈代谢和昼夜节律,限制蛋白质超负荷,是内质网应激下调节凋亡的潜在靶点[23]。本团队前期通过基因芯片筛选发现,糖络宁对DPN 的治疗作用与miR-211 的下调有关[24],基于前期实验提出设想:糖络宁可能通过作用于miR-211下调PERK/CHOP 凋亡通路而保护背根神经元。本研究结果显示,高糖组细胞miR-211 与PERK/CHOP通路均显著升高,且呈现出高凋亡率,提示高糖诱导下的背根神经节中,miR-211 显著过表达可促进DRGn 细胞中PERK/CHOP 通路的表达及细胞凋亡,可能导致细胞功能障碍。糖络宁组DRGn 细胞凋亡率降低,miR-211 和PERK/CHOP 通路表达下调,达到与miR-211 基因沉默的相似效果,提示糖络宁可能通过作用于miR-211 下调凋亡通路而保护DRGn细胞,治疗DPN。
DPN 是糖尿病并发症中较为特殊的一种,治疗局限在预防性管理与疼痛控制上[25-28],针对病理机制的治疗方法仍在探索。目前临床主要关注神经在营养超负荷下的能量代谢问题,糖尿病营养物质代谢紊乱时神经元的内质网和线粒体功能如何调节、过量葡萄糖和脂质对神经能量的作用是否协同一致等尚未被解释。针对神经的能量利用是开发DPN 有效疗法的途径,miRNA 被认为是其中的关键靶点[29]。本研究从细胞角度分析糖络宁对DPN 模型大鼠背根神经元凋亡的作用,结果显示其机制与抑制miR-211 表达有关,但miR-211 如何靶向调控基因抑制凋亡及糖络宁如何抑制miR-211 的表达仍需进一步探索。

