灯盏细辛联合依帕司他对糖尿病肾病模型大鼠的治疗作用及机制
屈雅娟,张敬芳,孙 旗,王 雄,易文媛,吴子湘,郭承熙,陈天禹,董博然
(长沙医学院第一临床学院,湖南 长沙 410219)
糖尿病肾病(Diabetic nephropathy,DN)是常见的糖尿病微血管并发症,也是糖尿病患者发生致残致死的主要因素[1-2]。DN的治疗措施以降糖、降压、饮食控制为主,虽可以减少尿蛋白,但对延缓病情进展的效果有限,会导致终末期肾病的发生,而终末期肾病患者的5年生存率低于20%[3-4]。近年来,醛糖还原酶抑制剂(Aldose reductase inhibitor,ARIs)以及抗氧化等特殊疗法获得了极佳的疗效,愈发受到临床重视[5]。由于DN的发病机制复杂,单纯的西药对症治疗方案的疗效具有局限性,而中西医结合治疗可充分发挥各自的优势,已成为临床科研的重点领域和热门[6-7]。
灯盏细辛为菊科植物短葶飞蓬Erigeron breviscapus(Vant.)Hand-Mazz的干燥全草,具有活血化瘀、消炎止痛、抗氧化等多种药理作用,其主要成分黄酮类化合物-灯盏花素可通过抑制醛糖还原酶(Aldose reductase,AR)、氧化应激等多种机制,达到预防和治疗DN的目的[8-9]。西药依帕司他(Epalrestat,EPST)能有效抑制多元醇通路(Polyol pathway,PP)的激活,改善肾功能障碍,为机体肾组织形成屏障[10-11]。目前鲜有研究报道灯盏细辛联合EPST治疗DN的应用价值。所以本研究建立DN大鼠模型,采用中药灯盏细辛联合西药EPST抗DN,研究其对DN大鼠肾组织PP中AR表达的调控作用以及对肾功能损伤和肾脏氧化应激的影响,探究其可能的作用机制,为临床治疗DN提供新型的治疗方案。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:50只清洁级的8周龄健康SD大鼠体重(200±20) g,由湖南斯莱克景达实验动物有限公司提供[许可证号:SCXK(湘)2019-0004]。大鼠在实验期间都置于每日光照12 h、温度22~26 ℃、湿度40%~70%的清洁级环境中,适应环境至少1周后开始实验。
1.1.2 主要药物: 灯盏细辛提取物(灯盏花素)(批号:20210601);依帕司他(批号:21080045)。
1.1.3 试剂和主要仪器:高脂高糖饲料(58.8%基础饲料、20.0%猪油、1.0%胆固醇、0.2%胆盐、20.0%糖),购自南京盛民科研动物养殖场;链脲佐菌素(Streptozotocin,STZ),购自北京白鲨易科技有限公司,批号:BS185;AR和大鼠尿微量白蛋白(24 h urinary microcontent albumin,24 h UmAlb)酶联免疫(ELISA)试剂盒,购自武汉贝茵莱生物科技有限公司;尿素氮(Blood urea nitrogen,BUN,批号:20211214)、肌酐(Serum creatinine,Scr,批号:20211018)、超氧化物歧化酶(Superoxide dismutase,SOD,批号:20210909)、丙二醛(Malondialdehyde,MDA,批号:20210916)、还原型谷胱甘肽(Reduced glutathione,GSH,批号:20210607)和考马斯亮蓝色检测试剂盒(批号:20211109)均购自南京建成生物工程研究所;7600型全自动生化分析仪(日本日立公司);XSP-8CA型光学显微镜(上海双旭电子有限公司);DNM9602型酶标仪(北京朗普新技术有限公司);RM2126型石蜡切片仪器(徕卡公司);HWJ-3-160型恒温培养箱、HCF8型离心机(上海跃进医疗器械有限公司);HH-2型水浴锅(常州市江南实验仪器厂);JB包埋机、JK烤片机、DG-P8摊片机、JJ-12J脱水机(武汉俊杰电子有限公司)。
1.2 实验方法
1.2.1 DN模型建立:随即选择10只大鼠为正常对照组,并持续给予普通饲料喂食至实验结束。而对其他大鼠在进行1周的高脂高糖饮食喂养后,于腹腔内一次性注入STZ 55 mg/kg(需禁食不禁水12 h,注射用枸橼酸缓冲液以浓度为1%配制)。3 d后用血糖仪测尾静脉血,如血糖值≥16.7 mmol/L,则糖尿病模型构建完成。再进行14 d的高脂高糖饮食喂养,并采集24 h尿液,若24 h UmAlb在30~300 mg/24 h之间,即可确定DN大鼠模型已成功构建。
1.2.2 实验分组及给药:将成模的40只大鼠随即平均分为模型组、EPST组[100 mg/(kg·d)]、灯盏细辛组[200 mg/(kg·d)]及EPST+灯盏细辛组(两药物同剂量联合给药),用5 g/L CMC-Na配制成混悬液,灌胃6周,空白组和模型组给予等体积溶媒。
1.3 观测指标
1.3.1 一般形态学观察:实验过程中,观察大鼠的毛发光泽度、活动情况、精神状态以及饮食饮水量。
1.3.2 HE染色观察肾组织病理形态:取部分肾脏组织,经0.9%氯化钠溶液灌洗后,脱水,透明,浸蜡包埋,制成切片,行HE染色,再脱水封蜡,用光镜显微镜观察。
1.3.3 空腹血糖和体重检测:实验期间,每2周测1次FBG和体重。禁食不禁水12 h后,测定大鼠体重,接着用采血针扎大鼠尾部末梢,再用血糖仪测FBG。
1.3.4 肾功能指标检测:造模6周后,使用代谢笼收集24 h大鼠尿液,采用ELISA法检测24 h UmAlb;取大鼠腹主动脉血后,将获得的血样本1500 g离心10 min,在移取其上清液后,用全自动生化分析仪检验BUN、Scr。
1.3.5 试剂盒检测肾组织SOD活性、MDA和GSH含量:取部分肾脏组织先用0.9%氯化钠溶液漂洗,按1∶9的配比添加0.9%氯化钠水溶液,1500×g离心10 min(4 ℃),制备组织匀浆。严格按照各试剂盒说明书的方法进行SOD活性,MDA和GSH含量的测定。蛋白定量采用考马斯亮蓝法。
1.3.6 ELISA检测肾组织AR活性; 肾组织先用预冷的0.9%氯化钠溶液漂洗,按∶9添加0.9%氯化钠水溶液,1500×g离心10 min(4 ℃),制备组织匀浆。严格按照ELISA试剂盒说明书方法进行肾组织样本中的AR活性的测定。

2 结 果
2.1 各组大鼠一般状态比较 正常对照组大鼠毛色光泽顺滑、活动能力好、精神状态佳;模型组大鼠皮毛枯黄无光泽、身体呈现弓背、多饮、多食、多尿、反应迟钝、精神萎靡、嗜睡、肢体发冷、大便呈稀溏样等特征;与模型组比较,EPST组、灯盏细辛组和EPST+灯盏细辛组大鼠整体状态好转,其中,EPST+灯盏细辛组大鼠在所有给药组中整体状态恢复最佳。
2.2 各组大鼠肾脏形态学比较 光镜下结果显示,正常对照组大鼠肾小球、肾小管、肾囊腔、基底膜以及系膜区正常;模型组大鼠较正常对照组,出现肾小球肥大、囊腔缩小,基质膜和系膜区加厚,肾小管上皮细胞出现空泡样变性,管腔面积明显增加;EPST组、灯盏细辛组和EPST+灯盏细辛组较模型组,肾小球和肾小管均有不同程度地改善,EPST+灯盏细辛组改善作用最明显,肾小球大小与结构均趋向正常化,且基底膜未见明显增生,肾小管上皮细胞未见明显空泡变性(图1)。
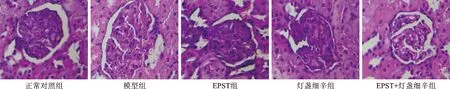
图1 各组大鼠肾脏形态学比较(HE染色,×400)
2.3 各组大鼠FBG和体重水平比较 相较于正常对照组,各干预组在造模后3 d,FBG水平显著升高(P<0.01),且血糖值均超过16.7 mmol/L,提示造模成功,各组大鼠均处在高血糖水平环境中;而各干预组在造模前,体重无统计学差异(P>0.05);EPST组、灯盏细辛组、EPST+灯盏细辛组在药物干预6周后,FBG均低于模型组(P<0.01),体重均高于模型组(P<0.01);与灯盏细辛或者EPST组比较,EPST+灯盏细辛组大鼠FBG降低(P<0.05),体重升高(P<0.05),提示EPST和灯盏细辛能降低DN大鼠的FBG和升高大鼠的体重,而灯盏细辛联合EPST给药治疗效果最显著。见表1。

表1 各组大鼠FBG及体重水平比较
2.4 各组大鼠肾功能水平比较 与正常对照组比较,模型组大鼠的BUN、Scr、24 h UmAlb水平均显著性增加(P<0.01),表明机体发生了肾功能损伤;于模型组比较,EPST组、灯盏细辛组、EPST+灯盏细辛组的BUN、Scr、24 h UmAlb水平显著降低(P<0.01),其中EPST+灯盏细辛组的BUN、24 h UmAlb水平显著低于EPST组或灯盏细辛组(P<0.05),说明灯盏细辛联合EPST给药可缓解DN大鼠肾损伤,且作用优于任一单独给药组。见表2。

表2 各组大鼠肾功能水平比较
2.5 各自大鼠氧化应激水平比较 模型组大鼠肾脏SOD、GSH水平较正常对照组显著降低(P<0.01),而MDA浓度显著提高(P<0.01),提示糖代谢紊乱已经造成了机体的氧化应激损伤;各给药组大鼠肾脏SOD、GSH水平较模型组显著升高(P<0.01),而EPST+灯盏细辛组大鼠肾脏SOD水平较EPST组或灯盏细辛组显著升高(P<0.05),EPST+灯盏细辛组大鼠肾脏GSH含量虽与EPST组比较,无统计学差异(P>0.05),但仍然有升高;各给药组大鼠肾脏MDA浓度较模型组显著降低(P<0.01),EPST+灯盏细辛组大鼠肾脏MDA浓度较EPST组或灯盏细辛组显著降低(P<0.05),说明灯盏细辛与EPST联合给药可显著降低DN大鼠肾脏氧化应激损伤,且作用最显著。见表3。

表3 各组大鼠氧化应激水平比较
2.6 各组大鼠肾脏AR活性比较 与正常对照组比较,模型组肾脏AR活性显著增强(P<0.01),说明机体肾组织AR活性升高,PP激活,机体已经发生糖代谢紊乱。EPST组、灯盏细辛组较模型组显著降低(P<0.01),其中EPST+灯盏细辛组肾脏AR活性显著低于EPST组或灯盏细辛组(P<0.05),说明灯盏细辛与EPST联合给药可显著降低DN大鼠肾脏AR活性,抑制PP激活,且作用最显著。见表4。

表4 各组大鼠肾脏AR活性比较(ng/mg)
3 讨 论
本研究在实验过程中,各干预组大鼠在注射STZ后,机体的FBG浓度和24 h UmAlb含量显著升高且出现糖尿病“三多一少”典型症状,提示DN模型造模成功。灯盏细辛结合EPST给药6周后,DN大鼠的整体状态改善显著,FBG显著下降以及体重显著升高,且其治疗效果优于灯盏细辛和EPST单独给药组,表明灯盏细辛联合EPST对DN大鼠具有治疗作用,而且作用强于单纯的西药或者中药治疗。
DN的主要表现是肾小球硬化和蛋白尿异常增多,当蛋白尿持续地不断增多时,机体肾功能损害程度就不断加重[12-13]。24 h UmAlb为诊断肾脏功能性衰竭的关键性指标[14]。Scr和BUN的浓度则与肾小球滤过能力密切相关,Scr和BUN浓度异常升高说明肾小球功能障碍,肾脏出现损伤[15-16]。本研究结果表明,以灯盏细辛结合EPST给药6周后,对DN大鼠肾功能改善作用显著强于模型组和任一单独给药组,其24 h UmAlb、Scr、BUN水平均与正常对照组最接近,且HE结果表明,灯盏细辛联合EPST 灌胃6周后,肾脏病变程度最低,肾小球和肾小管形态结构均趋向正常,提示以灯盏细辛结合EPST给药能彼此协调,提高药物的药理作用,从而提高肾功能,对DN具有一定的治疗效果。
葡萄糖代谢紊乱会促使PP、氧化应激、糖基化终末产物等多种病理因素增强[17]。其中,抑制PP过度活化已成为了临床上干预DN的研究热点,而AR是催化该通道完成的主要限速酶,当血糖含量不断增加时,会激活AR,并过度强化PP,从而使肾髓质细胞内的葡萄糖大量地转化成山梨醇,而由于山梨醇的不断增加,使细胞的渗透压过大,发生水肿,进而出现大量的蛋白尿和肾小球肥大以及肾间质纤维化[18]。本研究结果表明,灯盏细辛联合EPST给药后,肾组织AR活性显著降低,其对AR活性的抑制作用优于任一单独给药组,提示了灯盏细辛联合EPST可能通过降低AR活性,抑制PP激活,延缓DN的进展。
在高糖环境中,PP过度活化不仅仅会导致体内产生大量活性氧,SOD、CAT等抗氧化酶活性下降,也导致NADPH大量消耗,造成抗氧化剂GSH减少,进而引起机体氧化和抗氧化系统紊乱[19]。在生物体中,SOD可以高效地清除机体内产生的超氧自由基,其降低与DN的发生密切相关。而膜脂过氧化物终产物MDA为氧化应激标志物,可降低血糖和尿糖水平[20]。此外,GSH是重要的细胞内抗氧化剂。SOD、MDA和GSH通常用于评估机体的抗氧化水平[21]。所以,本研究在发现灯盏细辛联合EPST可通过降低PP中AR活性保护DN肾脏的基础上,进一步探索灯盏细辛联合EPST是否能在抑制肾组织AR活性的同时,也协同抑制氧化应激改善DN肾损伤的过程。研究结果表明,EPST+灯盏细辛组SOD、GSH水平较单独给药组显著升高,而MDA则显著降低。提示EPST+灯盏细辛组可在抑制肾组织AR的同时,可能也同样抑制氧化应激,且两者联合干预作用更强。本研究初步证实了灯盏细辛联合EPST对DN的治疗作用可能与其抑制PP活化并协同抑制氧化应激有关,但要明确具体机制,仍需进一步深入探究。
综上所述,灯盏细辛和EPST联合给药对DN有干预作用,且优于其他单独给药组,其可能与中药与西药发挥相辅相成的作用,并通过下调肾组织AR活性来抑制PP的激活,协同抑制肾组织氧化应激增加有关。

