补肾活血安胎方治疗妊娠早期绒毛膜下血肿疗效研究
王思允,汪亚琼,陈晓颖
(1.哈尔滨医科大学附属第一医院妇科,黑龙江 哈尔滨 150010; 2.哈尔滨医科大学附属第二医院老年科,黑龙江 哈尔滨 150010)
妊娠早期绒毛膜下血肿(Subchorionic hematoma,SCH)为先兆流产主要并发症之一,SCH是孕妇底蜕膜、绒毛膜板脱离,进而导致出血,血液瘀积在绒毛膜板、底蜕膜,产生血肿[1]。有研究指出,SCH能够增加不良妊娠结局[2]。中药治疗SCH方法众多,有一定优势。补肾活血安胎方有补肾固肾、健脾养血安胎之功,本研究选用补肾活血安胎方治疗SCH,并观察其对Ps、Pc、D-D及β-HCG、P、E2水平的影响。
1 资料与方法
1.1 一般资料 选择2020年4月至2021年10月哈尔滨医科大学附属第一医院妇科收治的120例妊娠早期SCH患者,按照不同治疗措施对患者进行编号分组。中西药结合组42例,平均年龄(28.25±2.16)岁;平均孕周(11.94±0.92)周;有孕史12例,无孕史30例;大血肿7例,中等血肿21例,小血肿14例;合并症:糖尿病2例,高血压1例。西药组41例,平均年龄(27.76±2.08)岁;平均孕周(12.60±0.71)周;有孕史11例,无孕史30例;大血肿9例,中等血肿19例,小血肿13例;合并症:糖尿病1例,高血压1例,高脂血症1例。中药组37例,平均年龄(29.41±1.95)岁;平均孕周(12.03±0.58)周;有孕史9例,无孕史28例;大血肿8例,中等血肿18例,小血肿11例;合并症:糖尿病1例,高血压2例,高脂血症1例。三组孕妇在年龄、孕产史、血肿程度、合并症等一般资料比较差异无统计学意义(均P>0.05)。本研究经医学道德伦理委员会审批通过。西医诊断标准[3-4]:符合《临床超声影像学》及《妇产科学》中SCH的诊断标准:①尿妊娠试验(+);②孕妇有腹痛、腰背痛等症状,伴有阴道出血;③B超证实宫内妊娠,提示妊娠单活胎;④B超示宫壁、宫腔内、妊娠囊间无回声区,胎膜、子宫腔间分离,形态多是新月形、三角形等;⑤依据血肿、孕囊比例判断血肿程度:比例超过25%为大血肿,低于5%为小血肿,其余为中等血肿。中医诊断标准:符合《中药新药临床研究指导原则》《中医妇科学》孕妇SCH脾肾亏虚证或肾虚血瘀证诊断标准。病例纳入标准[5]:年龄21~39岁;符合SCH中西医诊断标准;患者均签署知情同意书;孕周在6~12周。排除标准:孕妇生殖道畸形者;患有精神障碍者;伴子宫肌瘤、子宫颈息肉等疾病者;习惯性流产者;合并遗传性疾病者;过敏体质者。
1.2 治疗方法
1.2.1 中药组:予患者补肾活血安胎方加减(菟丝子、阿胶、续断、桑寄生、人参、茯苓、白术、甘草、三七、丹参)治疗。
1.2.2 西药组:予患者口服地屈孕酮片,10 mg/次,3次/d。
1.2.3 中西药结合组:予补肾活血安胎方联合地屈孕酮治疗。三组均治疗1周。
1.3 观察指标
1.3.1 血浆相关指标:分别于患者治疗前后采集1.8 ml空腹静脉血,添加0.2 ml枸橼酸钠抗凝,采用医用高速离心机(型号:sigma1-14)离心血样,离心20 min,收集血浆,采用全自动血凝分析仪分析(型号:CA-500)检测D-二聚体(Plasma D-dimer,D-D)、凝血因子Ⅷ、自然杀伤细胞(Natural killer cell,NK)水平及蛋白s(Protein S,Ps)、蛋白c(Protein C,Pc)活性。
1.3.2 血清激素指标:分别于患者治疗前后采集1.5 ml空腹静脉血。用电化学发光全自动免疫分析系统(型号:Elecsys2010)以化学发光法分析孕妇血清催乳素(Prolactin,PRL)、雌二醇(Estradiol,E2)、黄体生成素(Luteotropic hormone,LH)、人绒毛膜促性腺激素(β-human chorionic gonadotropin,β-HCG)、促卵泡激素(Follicle-stimulating hormone,FSH)、孕酮(Progesterone,P)水平。
1.3.3 妊娠结局:包括流产、早产、畸形、死胎、足月分娩,比较三组孕妇不良妊娠结局率。
1.3.4 产科并发症:包括绒毛膜羊膜炎、胎盘早剥、产后出血、胎膜早破、前置胎盘,比较三组孕妇产科并发症总发生率。

2 结 果
2.1 三组治疗前后血浆相关指标比较 治疗前,三组NK细胞、Ps、Pc、D-D、凝血因子Ⅷ比较,差异无统计学意义(均P>0.05);治疗后,三组Ps、Pc活性增加,NK细胞、D-D、凝血因子Ⅷ表达水平降低(均P<0.05);组间比较,中西药结合组凝血因子Ⅷ、NK细胞、D-D水平均低于其他两组,Ps、Pc活性高于其他两组(均P<0.05)。见表1。

表1 三组治疗前后血浆相关指标比较
2.2 三组治疗前后血清激素指标比较 治疗前,三组PRL、E2、FSH、β-HCG、LH、P水平比较差异均无统计学意义(均P>0.05);治疗后,三组E2、P水平升高,PRL、β-HCG水平降低(均P<0.05);三组LH、FSH较治疗前比较差异无统计学意义(均P>0.05);组间比较,中西药结合组PRL、β-HCG水平低于其他两组,E2、P水平高于其他两组(均P<0.05)。见表2。

表2 三组治疗前后血清性激素指标比较
2.3 三组妊娠结局比较 中西药结合组不良妊娠结局率为14.29%,西药组不良妊娠结局率31.71%,中药组不良妊娠结局率24.32%,中西药结合组不良妊娠结局率低于其他两组(均P<0.05)。见表3。
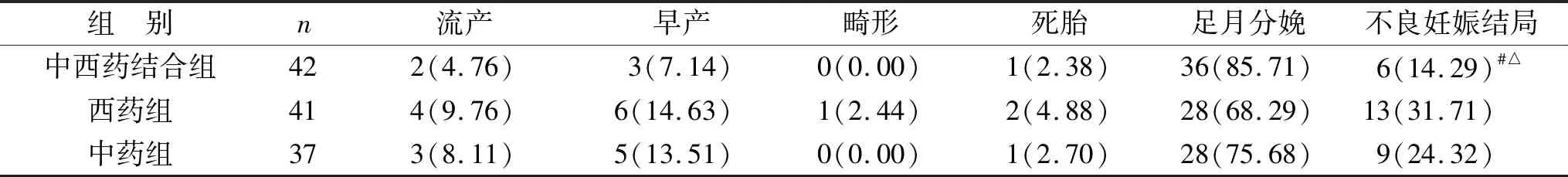
表3 三组妊娠结局比较[例(%)]
2.4 三组产科并发症发生情况比较 中西药结合组并发症总发生率为11.90%,西药组并发症总发生率34.15%,中药组并发症总发生率27.02%,中西药结合组并发症总发生率低于其他两组(均P<0.05)。见表4。
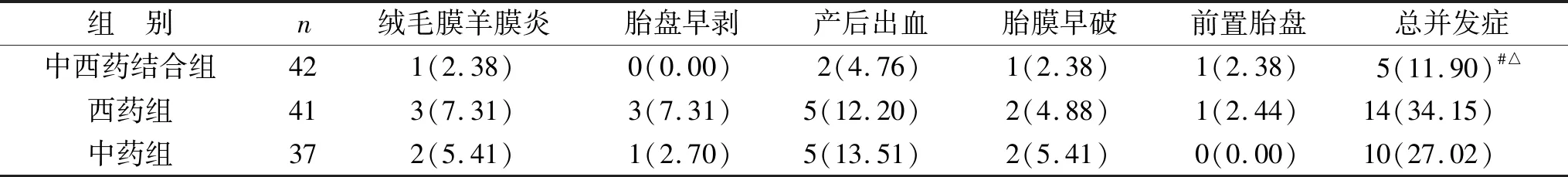
表4 三组产科并发症发生情况比较[例(%)]
3 讨 论
SCH发病机制是妊娠早期绒毛膜向蜕膜扩张,蛋白水解酶的分泌水平大量增加,对蜕膜血管造成一定损害,导致蜕膜、绒毛膜间出血,继而细胞凋亡,产生生理性萎缩,诱发本病[6]。SCH孕妇血液呈高凝状态,NK细胞可影响血管内凝血机制,其大量分泌会增加血小板聚集,促进血管收缩,进一步损伤蜕膜,加重血栓,甚至导致远端毛细血管缺血坏死及出血。凝血因子Ⅷ为蛋白质组分的一种,其参与凝血机制,血管出血时凝血因子Ⅷ被激活,能够黏连血小板,并与其共同填补血管漏口[7]。D-D属于纤维蛋白降解产物,主要存在于纤维蛋白原形成、分解的稳定时期,在血栓形成、纤溶酶降解交联纤维蛋白时,血栓中的交联纤维蛋白产生变化,D-D被释放至血液循环,其浓度明显增加,故D-D是反映凝血功能紊乱的重要标志物之一。Ps、Pc由肝脏合成,均为血浆蛋白,对维生素K有较强依赖性。Ps主要参与补体活化过程,是一种能够调控补体活化的血浆蛋白质,其作为辅因子,具有激活Pc的作用,在抑制凝血酶激活物方面有重要作用;Pc主要是蛋白C、凝血酶调节蛋白、蛋白S等物质构成的,为重要的抗凝蛋白活化标志物。在机体凝血过程中,Pc经凝血酶催化,可转换成活化蛋白C,并进一步转换成氨酸蛋白酶,氨酸蛋白酶作为一种抗凝物质,通过灭活凝血因子Ⅷ等,促进血栓溶解,发挥抗凝作用[8-9]。本研究中,中西药结合组Ps、Pc在治疗后明显增加,凝血因子Ⅷ、D-D、NK细胞显著下降,且低于中药组与西药组,说明中西药结合组在抗凝血、防止血栓形成及降解血栓方面更具优势。
孕激素与SCH病情程度关系密切,其中β-HCG主要产生于合体滋养细胞,可体现孕囊发育、胚胎发育情况,属于妊娠特异性标记物;若E2水平较低,或可诱发先兆流产[10];LH具有维持胎盘正常分泌P的作用;P生成于黄体、滋养细胞、胎盘等,其表达水平可反映妊娠状态;P具有提升胞内钠浓度,降低钾浓度,调节子宫平滑肌细胞通透性的作用,使肌纤维处于松弛的状态,以此缓解子宫收缩,促进胚胎在子宫内发育[11-15]。本研究中,中西药结合组在治疗后E2、P水平明显升高,PRL、β-HCG水平明显降低,与中药组、西药组比较差异有统计学意义,提示中西药结合组在调节性激素水平方面作用更为明显。
本研究观察了三组孕妇并发症与妊娠结局,结果显示,中西药结合组不良妊娠结局、产科并发症发生率更低,提示中西药结合组治疗效果更好。地屈孕酮为口服孕激素,具有促使淋巴细胞产生孕酮诱导阻滞因子的作用,辅助子宫内膜进入分泌相,主要应用在内源性孕酮不足的治疗,改善由E2等分泌异常造成的多种子宫病变,降低SCH发病风险[16-17]。
SCH在中医学中归为“胎动不安”“胎漏”范畴,病机多与气血虚、脾肾虚、血热兼血瘀相关。典籍曾记载:“盖肾为先天之本,主生殖……脾为后天之本,气血生化之源,血能养胎,而气能载胎”[16],若孕妇存在脾肾气虚,推动无力,血行不畅,血行迟滞,瘀血占踞子宫,瘀血不去,新血不生,继而诱发胎动不安、小产等。本研究选取补肾活血安胎方治疗SCH,补肾活血安胎方由寿胎丸合四君子汤加丹参、三七组成。方中桑寄生、续断、菟丝子有补肾益精、养血固胎的作用;阿胶补血滋阴、润燥止血;三七、丹参活血祛瘀、通经止痛;人参大补元气、复脉固脱;甘草止痛、解痉;茯苓渗湿利水、宁心安神;白术益气健脾[18-20]。全方共奏温补肾气、扶正祛邪、补血活血的功效。与SCH肾虚血瘀之病机相契合,可达到补肾化瘀安胎的治疗目的。

