抗血管生成药物联合程序性细胞死亡蛋白-1抑制剂治疗晚期非小细胞肺癌的临床效果
徐保辰
山东省新泰市人民医院肿瘤三科,山东新泰 271200
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肿瘤科常见的肺癌类型,多见于吸烟或被动吸烟群体中,该病的发病率可占肺癌患者的85%及以上。针对早期NSCLC,临床以手术切除为主,而对于晚期或无法经手术切除的NSCLC,则多使用放疗+化疗联合疗法或靶向治疗达到杀灭肿瘤细胞, 抑制肿瘤生长的目的。 有研究指出,NSCLC 的发生发展与免疫应答及血供关系密切。 程序性细胞死亡蛋白-1(programmed cell death protein-1,PD-L1)抑制剂是当前研究最多且临床发展最快的一种免疫检查点抑制剂,该药可激活机体自身的免疫细胞,杀伤肿瘤细胞。抗血管生成药物通过阻断癌细胞血液供应达到治疗恶性肿瘤的目的。但既往关于二者的研究较少。故本研究选取新泰市人民医院肿瘤三科收治的86 例晚期NSCLC 患者作为研究对象, 观察抗血管生成药物联合PD-L1 抑制剂治疗晚期NSCLC 的效果。
1 资料与方法
1.1 一般资料
选取2019年8月至2020年12月新泰市人民医院肿瘤三科收治的86 例晚期NSCLC 患者作为研究对象, 按照入院编号奇偶数分组法将其分为试验组(43 例)和对照组(43 例)。对照组中,男27 例,女16例;年龄40~77 岁,平均(59.94±3.22)岁;临床TNM 分期:Ⅲa 期16 例,Ⅲb 期21 例,Ⅳ期6 例;病理分型:腺癌25 例,鳞癌18 例;患病时间2~8 个月,平均(4.16±1.42)个月;吸烟史31 例。 试验组中,男30 例,女13例;年龄41~79 岁,平均(60.12±3.04)岁;临床TNM 分期:Ⅲa 期18 例,Ⅲb 期13 例,Ⅳ期12 例;病理分型:腺癌20 例,鳞癌23 例;患病时间2~9 个月,平均(4.27±1.56)个月;吸烟史35 例。 两组患者的一般资料比较,差异无统计学意义,具有可比性(P>0.05)。 所有患者及家属均对本研究知情同意,本研究获得新泰市人民医院医学伦理会批准(医学伦理编号:2020C011)。
纳入标准:①患者经肺部核磁共振造影(magnetic resonance imaging,MRI)及实验室指标检查,确诊为NSCLC;②均为晚期患者;③患者均存在PD-L1 高表达。排除标准:①合并小细胞肺癌患者;②合并早中期肺癌患者;③合并不能耐受药物治疗者;④合并肝肾等其他器官功能障碍者。
1.2 方法
对照组患者给予常规化疗药治疗。 治疗前6 h 口服20 mg 地塞米松(广东雷允上药业有限公司,国药准字H44022582,生产批号:210709,规格:20 mg×5片)。入院后第1 天,给予紫杉醇注射(江苏红豆杉药业有限公司,生产批号:315471,国药准字H20067344,规格:5 ml∶30 mg), 将135 mg/m本品与0.9%氯化钠溶液500 ml 混合后, 经静脉滴注,3 h 内滴注完毕。 第2~4 天,加用顺铂注射液(济南益民制药有限公司,生产批号:ZBD1915,国药准字H20050269,规格:2 ml∶10 mg),将20 mg/m本品与0.9%氯化钠溶液500 ml混合后,经静脉滴注。 连续用药5 d。 间隔3~4 周重复1 次为1 个疗程。 共治疗2 个疗程。 治疗期间同时给予护肝、护胃、止吐等辅助治疗。
试验组患者采用抗血管生成药物贝伐单抗(山东博安生物技术有限公司,生产批号:401238,国药准字S20200015,规格:100 mg∶4 ml)与PD-L1 抑制剂替雷利珠单抗[诺华(中国)生物医学研究有限公司,生产批号:JBD2613,国药准字S20190045,规格:10 ml∶100 mg)]治疗。 将200 mg 替雷利珠单抗与0.9%氯化钠溶液500 ml 混合后经静脉输注, 输注时间应在60 min以上。间隔3 周给药1 次。贝伐单抗第一次给药在化疗后, 此后用药可自主选择。 将5 mg/kg 本品与0.9%氯化钠溶液500 ml 混合后,经静脉滴注,90 min内滴注完毕。 间隔14 d 给药1 次为1 个疗程,共治疗2 个疗程。
1.3 观察指标及评价标准
1.3.1 比较两组患者治疗前后的血清学指标 治疗前、治疗2 个疗程后,采集两组患者的空腹上臂静脉血样4 ml,经乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝后,在离心半径为20 cm 离心机(德国eppendorf 生命科学公司,型号:5427 R)中以3000 r/min的转速离心5 min 后,取血清置于4℃冷藏。采用高效液相色谱分析仪[赛默飞世尔科技(中国)有限公司,型号:UHPLC 型]以酶联免疫法检测血管内皮生长因子(vascular endothelial growth factor,VEGF),实时荧光定量分析法检测胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)、单磷酸腺苷(adenosine monophosphate,AMP)激活的蛋白激酶(AMP-activated protein kinase,AMPK)水平。
1.3.2 比较两组患者治疗前后的肿瘤标志物 治疗前、治疗2 个疗程后,使用“1.3.1”项血清学指标检测使用的化学发光免疫法检测癌胚抗原(carcinoembryonic antigen,CEA)、 细胞角蛋白19 可溶性片段(soluble fragment of cytokeratin 19,CYFRA21-1)、甲胎蛋白(alpha-fetoprotein,AFP)值。 检测仪器同“1.3.1”项。
1.3.3 比较两组患者治疗前后的肿瘤体积 治疗前及治疗1、2、3 周,使用64 层螺旋CT 扫描系统(飞利浦医疗有限公司,型号:Micro-CT)行3~5 mm 间隔扫描,获得所有肿瘤图像后上传至计算机图像分析系统,计算肿瘤体积(tumor volume,TV)。TV=肿瘤长径×肿瘤短径。
1.3.4 比较两组患者的生存情况 包括中位无进展生存期(median progression-free survival,mPFS)、中位总生存期(median overall survival,mOS)。
1.3.5 比较两组患者的治疗效果 治疗效果评价指标包括完全缓解、部分缓解、稳定、进展。 完全缓解(complete relief,CR)是指患者的病灶消失,肿瘤标志物恢复至正常水平,且随访半年未见新病灶产生;部分缓解(partial relief,PR)是指患者的病灶缩小面积在60%以上,肿瘤标志物较治疗前下降,但未恢复至正常水平,随访半年未见新病灶产生;稳定(stabilization of disease,SD)是指患者的病灶缩小面积在25%~60%,肿瘤标志物较治疗前无明显差异,随访半年未见新病灶产生;进展(progression of disease,PD)是指患者的已有病灶面积较治疗前扩大25%及以上,或有新病灶产生,肿瘤标志物水平持续升高。 肿瘤控制率(disease control rate,DCR)=CR+PR+SD。 客观缓解率(objective response rate,ORR)=CR+PR。
1.4 统计学方法
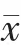
2 结果
2.1 两组患者治疗前后血清学指标的比较
两组患者治疗前的VEGF、IGF-1、AMPK 水平比较,差异无统计学意义(P>0.05);治疗2 个疗程后,两组患者的VEGF 均低于治疗前,IGF-1、AMPK 均高于治疗前, 试验组患者的VEGF、IGF-1 低于对照组,AMPK 高于对照组,差异有统计学意义(P<0.05)(表1)。
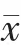
表1 两组患者治疗前后血清学指标的比较(±s)
2.2 两组患者治疗前后肿瘤标志物水平的比较
两组患者治疗前的CEA、CYFRA21-1、AFP 水平比较,差异无统计学意义(P>0.05);治疗2 个疗程后,两组患者的CEA、CYFRA21-1、AFP 均低于治疗前,且试验组患者的CEA、CYFRA21-1、AFP 低于对照组,差异有统计学意义(P<0.05)(表2)。
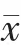
表2 两组患者治疗前后肿瘤标志物水平的比较(±s)
2.3 两组患者治疗前及治疗1、2、3 周TV 的比较
两组患者时间、组间、交互作用比较,差异有统计学意义(P<0.05)。 治疗前,两组患者的TV 比较,差异无统计学意义(P>0.05);治疗1、2、3 周,两组患者的TV 均小于本组治疗前,且试验组患者的TV 小于对照组,差异有统计学意义(P<0.05)(表3)。
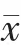
表3 两组患者治疗前及治疗1、2、3 周TV 的比较(mm3,±s)
2.4 两组患者生存情况的比较
试验组患者的mPFS、mOS 均长于对照组, 差异有统计学意义(P<0.05)(表4)。
表4 两组患者生存情况的比较(月,±s)
2.5 两组患者治疗效果的比较
两组患者的ORR 比较,差异无统计学意义(P>0.05);试验组患者的DCR 高于对照组,差异有统计学意义(P<0.05)(表5)。

表5 两组患者治疗效果的比较[n(%)]
3 讨论
手术、化疗、放疗被称作恶性肿瘤治疗的三驾马车。 常规放化疗虽也能杀灭肿瘤细胞,但患者可能出现脱发、失眠、呕吐等严重不良反应,治疗体验感较差。 随着分子生物学的发展,临床逐渐将抗癌重点倾向于细胞、基因层面,免疫治疗、抗血管生成治疗方案逐渐进入大众视野。
肿瘤细胞的增殖、分化与机体的血液供应密不可分。 瘤体可自行生成新生血管,并经机体获取营养供应自身生长。 VEGF 是常用的血管功能评价指标,它可特异性结合血管内皮细胞, 参与促进内皮细胞增殖、提高血管通透性。 VEGF 在恶性肿瘤中高表达,对瘤体新生血管形成、肿瘤生长及转移均有重要作用。IGF-1 主要由肝脏产生, 可促进细胞增殖及分化,抑制细胞凋亡,是肿瘤重要的促生长因子。AMPK 具有调节能量代谢的作用。 高水平的AMPK 可调节神经元凋亡,减轻氧化应激反应,改善细胞线粒体功能,促进血管功能恢复。 本研究结果显示,治疗2 个疗程后, 试验组患者的VEGF、IGF-1 低于对照组,AMPK高于对照组,差异有统计学意义(P<0.05)。 提示抗血管生成药物与PD-L1 抑制剂联合使用, 可改善NSCLC 患者的血清学指标,抑制新生血管生成。 分析原因,贝伐单抗是一种新型抗血管生成药物,该药可与肿瘤细胞VEGF 相结合, 抑制VEGF 受体活化,从而抑制瘤体上生成新生血管,切断肿瘤的血液和营养供应,起到持续抗肿瘤效果。 PD-L1 是机体重要的免疫抑制因子,可抑制免疫细胞活性,避免其被过度激活,稳定免疫系统生理功能。 但肿瘤细胞可改变机体内部微环境,诱导PD-L1 及PD-L2 高表达。 PDL1 抑制剂替雷利珠单抗通过阻断PD-L1 及PD-L2分泌通路,部分恢复T 淋巴细胞功能,从而恢复受抑制的免疫系统功能。抗血管生成药物与PD-L1 抑制剂联合使用,具有协同增效作用,在抗瘤体新生血管生成的基础上,通过激活免疫系统功能去攻击肿瘤细胞,抑制癌细胞过度增殖、分化,保护机体正常的生理功能,进而达到调节血清学相关指标水平的目的。
肿瘤标志物是特异性反映肿瘤存在的物质,肿瘤标志物的存在及含量可提示肿瘤性质、治疗效果及预后。 CEA 是常用的肿瘤标志物,在恶性肿瘤尤其是胃肠道癌、胰腺癌、肝癌、肺癌患者体内,CEA 高表达。CYFRA21-1 是肝癌的特异性诊断指标。 它是细胞角蛋白19 的可溶性片段。 在恶性肿瘤患者的上皮细胞内,细胞角蛋白19 被激活,细胞降解速度加快,大量细胞角蛋白释放进入血液中,并与单克隆抗体特异性结合,为肿瘤生长创造条件。CYFRA21-1 显著升高常提示肿瘤晚期。 AFP 是诊断肝癌和生殖细胞肿瘤的特异性标志物,约80%的肝癌患者体内均存在高浓度AFP。 本研究结果显示,治疗2 个疗程后,试验组患者的CEA、CYFRA21-1、AFP 低于对照组, 差异有统计学意义(P<0.05)。 提示抗血管生成药物与PD-L1抑制剂联合使用,可降低肿瘤标志物水平,提升治疗效果。 分析原因可能与PD-L1 抑制剂与抗血管生成药物联合使用的机制有关。 两种药物联合使用,不仅可抑制肿瘤生成新生血管,阻断肿瘤营养供应,诱导瘤体凋亡,避免肿瘤继续增殖、分化,稳定病情,同时还通过直接作用于免疫系统,减少肿瘤与免疫细胞巨噬细胞免疫球蛋白G 表面的Fc γ 受体结合, 发挥体液免疫及细胞免疫作用,促进肿瘤抗原的摄取、处理及递呈, 消除抗体依赖的免疫细胞介导的吞噬效果,维持T 淋巴细胞正常的数量,从而提升抗肿瘤疗效。 本研究结果显示,治疗1、2、3 周,试验组患者的TV 小于对照组,DCR 高于对照组, 且PFS、OS 均长于对照组,差异有统计学意义(P<0.05)。 与既往研究类似,提示相较于常规化疗药物,抗血管生成药物与PD-L1抑制剂联合使用,可更好地促进瘤体体积缩小,还可延长患者生存期。 但本研究所选样本量较少,研究结果还有待进一步深入研究验证。
综上所述, 晚期NSCLC 联合抗血管生成药物贝伐单抗与PD-L1 抑制剂替雷利珠单抗治疗, 效果确切,可降低肿瘤标志物水平,改善血清学指标,还可缩小TV,延长患者生存期。

