偕胺肟改性聚丙烯腈电极材料的制备及其从海水中吸附铀试验研究
高子腾,陈树森,丁海云,宋 艳,宿延涛,勾阳飞,常 华,吴浩天
(核工业北京化工冶金研究院,北京 101149)
海水提铀已开发出多种方法,如吸附法[1]、溶剂萃取法[2]、化学沉淀法[3]、生物吸附法[4]、离子交换法[5]和超导磁分离法[6]等。其中,吸附法研究最多[1],研究核心为材料研发。目前,偕胺肟基材料因其在螯合海水中的铀酰离子方面有很好的亲和力而受到广泛关注。据报道,吸附容量最高的偕胺肟基聚合物在模拟海水中对铀的吸附量可达200 mg/g[7]。然而,简单的物理化学吸附有一定局限性。由于海水中铀浓度低,铀酰离子向吸附剂表面的扩散速度缓慢,而且吸附的阳离子带正电,会由于库仑作用而排斥铀酰离子,使得大部分表面活性位点无法被占用[8]。因此,结合光催化、电催化等技术,多种具有高吸附容量和高选择性的新型海水提铀材料不断涌现[9-11]。
电化学吸附技术的关键为电极,需要对电极表面进行化学修饰使其具有铀配位能力,能够从溶液中吸附铀[12]。研究表明,用偕胺肟改性多孔碳纤维材料并结合电吸附对铀有较高分离选择性[13]。多孔碳材料通常具有非常大的比表面积和孔径,且化学性质稳定,表面易于官能化修饰,是常用的功能性吸附材料之一[14-15]。对其表面进行功能化改性可以制备铀酰离子吸附材料,如在多孔碳材料表面接枝聚丙烯腈并偕胺肟化,接枝苯甲酰硫脲或羟甲基化聚乙烯亚胺等[16-19],可有效提高其对铀酰离子的吸附能力和选择性。但上述研究针对的大都是纯的铀溶液或模拟溶液,而针对含低浓度铀的海水的试验很少,且吸附能力有待进一步改进。试验研究通过化学改性制备偕胺肟聚丙烯腈电极材料并考察其在低浓度加标海水中吸附铀的能力。
1 试验部分
1.1 试剂与材料
聚丙烯腈(PAN,分子量50 000)、盐酸羟胺(98.5%)、N,N-二甲基甲酰胺(DMF)、氢氧化钠(99.5%)、氯化钠(95%),均为分析纯。
碳毡,厚度2 mm。

加标海水:铀质量浓度3 mg/L。
φ6 mm×90 mm石墨棒电极,R232甘汞参比电极。
1.2 主要仪器
KQ5200E型超声波清洗器,BS224S型分析天平,pHS-3C型精密pH计,电磁搅拌器,SHE-82A型恒温振荡器,DHG-9140A型电热鼓风干燥箱,200 mL电解池,CHI660E型上海辰华电化学工作站,KYKY-2800B型扫描电镜,WQF-510A型傅里叶变换红外光谱仪,MHY-UV1200型紫外-可见分光光度计。
1.3 试验方法
1.3.1 电极材料的制备
1)电极的预处理。将碳毡剪切成60 mm×60 mm片状,放入去离子水中超声清洗5 min,然后放入鼓风干燥箱内于100 ℃下烘干2 h,冷却至室温。
2)涂覆电极材料制备。将PAN粉末放入100 ℃鼓风干燥箱内干燥2 h,冷却至室温后密封于干燥器内。制备1∶30的PAN-DMF涂覆液,并将其涂覆在预处理后的碳毡基材上,使涂覆液在纤维表面完成沉降并粘覆。将涂覆后的材料放入真空干燥箱内于100 ℃下干燥2 h,待溶剂完全挥发质量不再变化后,记录该材料质量,保存备用。
3)偕胺肟改性电极材料的制备。在锥形瓶中加入26.23 g盐酸羟胺,6.00 g氯化钠,然后加入250 mL水、250 mL甲醇,使之完全溶解,再用氢氧化钠调节溶液pH=7。将涂覆后的电极材料剪裁成15 mm×20 mm片状,加入到上述溶液中,在75 ℃、搅拌速度150 r/min条件下反应24 h。反应结束后,用去离子水清洗至电极材料表面pH=7,放入鼓风干燥箱中于100 ℃下干燥2 h,即得偕胺肟改性电极材料(AO-PAN),记录其质量。AO-PAN与未改性前的电极材料相比,外观没有明显变化,但亲水性有较大提升。
具体反应过程如下:

1.3.2 电极材料吸附铀的性能测试
以AO-PAN为工作电极,石墨棒为对电极,饱和甘汞电极为参比电极,在150 mL加标海水(pH=7.8)中进行电化学吸附。试验过程中可以用0.1 mol/L HCl溶液或Na2CO3溶液调加标海水pH。所用方法为CHI电化学工作站方波交流电压为-3~0 V计时电流法。吸附6 h后,用滤芯孔径为0.22 μm的过滤膜取样,按HJ700-2014[20]测定溶夜中铀质量浓度,按下式计算U(Ⅵ) 吸附率(η)。

2 试验结果与讨论
2.1 电极材料的表征
2.1.1 红外分析表征
偕胺肟改性前、后电极材料的红外光谱如图1所示。

图1 偕胺肟改性前、后电极材料的红外光谱

2.1.2 扫描电镜分析
偕胺肟改性前、后及吸附铀前、后的电极材料的扫描电镜照片如图2所示。可以看出:碳纤维是一种多孔材料,孔径从几十到几百纳米不等,表面平整无杂质,这些孔结构保证铀酰离子的传输,可以最大限度利用偕胺肟活性位点;涂覆PAN变得粗糙;偕胺肟化改性后,碳纤维表面的点物质更加明显,结合图3中N、O元素的出现可以说明存在功能基团;AO-PAN电极的纤维表面及膜表面可以吸附铀,孔道被填满。

a—碳毡基材;b—涂覆PAN;c—AO-PAN;d—吸附铀的AO-PAN。图2 电极材料的扫描电镜照片

图3 AO-PAN的扫描电镜-X射线能谱成分分析结果
2.1.3 循环伏安法测试
AO-PAN在加标海水中的循环伏安曲线如图4所示。

图4 AO-PAN在加标海水中的循环伏安曲线

2.2 电极材料吸附铀
2.2.1 吸附时间对铀吸附率的影响
吸附时间对铀吸附率的影响试验结果如图5所示。可以看出:随时间延长,铀吸附率升高:吸附1 h内,吸附速率接近于线性;吸附6 h后,吸附率趋于稳定,为53.9%;吸附12 h时,铀吸附率为66.2%,之后继续吸附,铀吸附率变化不大。试验中发现,吸附6 h后,溶液中有少量白色和黄色絮状沉淀,电极材料上也有一些黄色物质沉积,综合考虑,确定适宜吸附时间为6 h。

图5 吸附时间对铀吸附率的影响
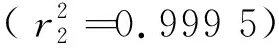

图6 拟一级动力学模型拟合曲线

图7 拟二级动力学模型拟合曲线
2.2.2 外加电压对铀吸附率的影响
外加直流电压及交流电压对铀吸附率的影响试验结果如图8所示。

a—外加直流电压;b—外加交流电压。图8 外加电压对铀吸附率的影响
由图8看出:随外加直流电压增大,铀吸附率有所提高,因为电压增大会影响溶液中的离子扩散;但直流电压增大至-3 V后,铀吸附率反而下降,这可能是因为电压增大会使更多物质沉积并占据吸附位点,也消耗部分能量,也可能使电极表面产生更多气泡,阻碍其吸附铀;外加直流电压为-3 V时,铀吸附率为66.5%。外加交流电压时,设置脉冲电压占空比为0.5,可以看出,虽然通电时间较短,但铀吸附率并没有明显下降,且趋势更平稳;另外,溶液中产生的杂质更少,吸附环境更简单,对后续工序更有利。综合考虑,确定以-3~0 V的交流电进行试验。
2.2.3 溶液pH对铀吸附率的影响
溶液pH对铀吸附率的影响试验结果如图9所示。

图9 溶液pH对铀吸附率的影响
当溶液pH>9.5时,溶液中的铀会生成氢氧化物不溶物,并吸附在电极表面占据大量活性位点,因此试验在pH<9.5条件下进行。由图9看出:随pH增大,铀吸附率升高;pH在5~8范围内,AO-PAN对铀的吸附效果最好。在pH较低条件下,偕胺肟基团发生质子化,表面携带的正电荷产生静电斥力,阻止其对铀的吸附;当pH低到2以下时,偕胺肟基团会被破坏;而pH大于8时,施加电压后使得阴极周围pH进一步升高,金属离子以氢氧化物形式沉淀,占据一部分吸附位点,电极对铀的吸附性能也有所下降。
2.2.4 温度对铀吸附率的影响
温度对铀吸附率的影响试验结果如图10所示。温度通过影响离子传导速率影响AO-PAN对铀的吸附。可以看出:随溶液温度升高,铀吸附率提高;但溶液温度高于30 ℃后,石墨棒电极腐蚀严重,溶液呈褐色,且底部有碳屑,铀的吸附受到影响。因此,确定吸附试验在室温下进行即可。

图10 温度对铀吸附率的影响
2.2.5 初始铀质量浓度对铀吸附率的影响

图11 初始铀质量浓度对电极材料吸附铀的影响
由图11看出:电化学吸附法的吸附效果比物理化学法的吸附效果要好。随溶液中初始铀质量浓度升高,电化学吸附法对铀吸附率降低,而物理化学吸附法的铀吸附率升高。随溶液中铀质量浓度升高,吸附速率加快,吸附的量增多,AO-PAN可以更快接近饱和;溶液中初始铀质量浓度升至1 000 mg/L时,经24 h吸附,AO-PAN对铀的吸附量高达1 136 mg/g,吸附效果较好。以上结果表明,电化学吸附法更适合从低浓度溶液中吸附铀,有望用于从海水吸附铀。


图12 Langmuir等温吸附模型拟合曲线

图13 Freundlich等温吸附模型拟合曲线
2.3 吸附产物分析
海水中的铀一般以铀酰离子与碳酸根、氢氧根配合形式存在,主要为U(Ⅵ)。电化学吸附过程中,铀酰离子被电沉积到工作电极上形成电中性的二氧化铀,也就是U(Ⅳ)。分析结果表明,沉淀物中,U(Ⅳ)质量分数为1.94%,U(Ⅵ)质量分数为16.45%,说明电吸附过程中确实存在氧化还原过程。U(Ⅵ)的产生是由于试验是在有氧环境下进行的,U(Ⅳ)会被溶液中的溶解氧氧化;而通过试验也证实,已经被吸附出来的U(Ⅵ)在不断搅拌过程中不会重新溶解。
3 结论
利用非均相法对涂覆在电极表面的PAN进行偕胺肟化改性可制得AO-PAN电极材料,这种材料多孔,比表面积较大,可作为吸附材料。
以AO-PAN为电极材料,从低浓度加标海水中电化学吸附铀,可获得较好吸附效果,加标海水pH在5~8范围内,电化学吸附24 h,其对铀的吸附量高达1 136 mg/g。
AO-PAN电极材料可用于从海水中电化学吸附铀,且制备过程简单,成本低,有良好的应用前景。

