足金999饰品中银检测关键技术研究
祝培明,王 萍1,,李桂华1,,范春丽1,,刘雪松1,,孙 冰,程春玲
(1.山东省计量科学研究院,山东省计量检测重点实验室,山东 济南 250014;2.国家黄金钻石制品质量检验检测中心,山东 济南 250014)
金饰品日常检测工作中,有损检验[1-2]样品以足金999金饰品为多。笔者选取了近一年所做的足金999金饰品[3-4]分析数据为统计分析样本,以探讨杂质元素[5]的规律为重点,对足金999饰品中杂质元素总量分布规律进行了统计。进一步梳理各杂质元素发现,Ag、Cu、Zn、Fe四元素为主要杂质元素[6-8],基本占每个样品杂质总量95%以上。而且以Ag为主,所以Ag是杂质元素检测结果准确性评判的关键。
其中Ag含量相对较高的样品分析数据的形成过程对其检测结果准确性影响更大[9-10],直接导致Ag分析结果偏低即差减法得出的金检测结果偏高。而数据形成过程就是样品分析实验操作,它直接决定了分析结果的准确性。
对于足金999饰品中杂质元素分析各类检验机构与生产企业质检部门绝大多数都采用国标GB/T 38145《高含量贵金属合金首饰 金、铂、钯含量的测定 ICP差减法》[11]。应用该法的实验操作主要为样品溶液制备、上机测定和数据分析处理,其样品溶液制备直接关系整个实验的成败。为此本文重点讨论Ag由固体进入溶液中成为离子的转化过程。
1 实验
1.1 仪器
美国铂金埃尔默公司电感耦合等离子体发射光谱仪(ICP-OES),型号为PE8300,电子天平(德国赛多利斯公司,CPA225D,精度0.01 mg)。
1.2 仪器工作条件选择
PE8300仪器工作条件:氩气99.99%;氩气压力0.7 MPa;射频功率1300 W;等离子体气流量9 L/min;辅助气流量0.2 L/min;雾化气流量0.6 L/min;进样量1 mL/min;进样冲洗时间30 s。以强度比率为纵坐标,杂质元素的质量浓度为横坐标,绘制工作曲线。
1.3 试剂
高纯金:ωAu≥99.999%;HCl、HNO3:优级纯;单元素Ag标准溶液:1000 μg/mL,国家一级标准物质;实验用水为超纯水。
1.4 标准溶液的配制
5%金基体储备溶液的配制:准确称取高纯金10.00 g,用30 mL王水加热溶解后,缓慢加热蒸发至粘稠状,加入30 mL浓盐酸继续加热至溶液清亮无不溶物,冷却后转入200 mL容量瓶中,定容摇匀,配制成5%的金基体储备溶液。
Ag标准储备溶液100 μg/mL配制:移取1000 μg/mL Ag标准溶液10 mL置于预先加入5 mL浓硝酸的100 mL容量瓶中,用超纯水定容摇匀。
Ag标准系列溶液配制;在6只100 mL容量瓶中均预先加入20 mL 5%金基体储备溶液、20 mL HCl (1+1),移取Ag标准储备溶液 0.00、1.00、2.00、3.00、5.00、10.00 mL 于容量瓶中,用超纯水定容,配制成 0.00、1.00、2.00、3.00、5.00、10.00 μg/mL 的Ag标准系列溶液,摇匀备用,上机测定。
2 影响Ag检测结果的因素
2.1 样品溶液制备
准确称取500 mg样品两份,精确至0.01 mg,转移至50 mL烧杯中,加入10 mL王水,缓慢加热直至样品完全溶解,继续加热赶尽氮氧化物,加入5 mL浓盐酸继续加热至溶液清亮无不溶物,冷却后,转移至50 mL容量瓶中,定容混匀。
2.2 影响样品溶液制备的主要因素
参照国标 GB/T 38145-2019 制备样品溶液,关键在于溶液酸度的控制,对银尤为重要,而这一点国标中未明确说明。
2.2.1 酸介质的选择
当样品溶液中盐酸浓度为10%时,溶液中Ag离子的允许浓度见回收率(图1)。
由图1可见,当盐酸浓度一定(如10%)时,仅允许一定浓度的Ag离子以银氯络离子形式存在于溶液中。即10%盐酸酸度可使小于 11 μg/mL的Ag离子以银氯络离子形式存在,大于此浓度则过量Ag离子以氯化银白色沉淀的形式沉淀出来,且浓度过量越多沉淀越多。工作实践中发现,一旦白色氯化银沉淀出来,再行补加盐酸也难以保证全部复溶从而致使结果偏低。
通常实验操作中,大批量溶样时较难控制盐酸酸度完全一致,同批中溶液酸度有所差别在所难免,因而在10%盐酸酸度的条件下可供选择的银离子浓度以不大于10 μg/mL为好,它决定了银标准曲线的配制上限。因而,若按国标要求的称样量和定容体积以及溶样过程进行溶液制备操作时,当银含量达 1000 μg/g及以上时,极有可能出现银分析结果偏低,应予以关注。
2.2.2 在不同盐酸酸度中不同银标准溶液的回收率
由图2可知:当溶液中盐酸浓度小于9%时,10 μg/mL Ag溶液将开始出现氯化银沉淀,其测得浓度(即回收率)将随盐酸浓度的降低而下降,见表1。盐酸小于6%时5 μg/mL Ag、盐酸小于5%时2和3 μg/mL Ag均按图2所显示的规律发生变化。但唯有1 μg/mL Ag不受酸度的影响,有比较宽泛的酸度适应范围。而1 μg/mL Ag(即含量为100 μg/g)正是999.9‰金达标与否的临界点,也就是说999.9‰金饰品测银不必过于在意盐酸酸度的掌控。
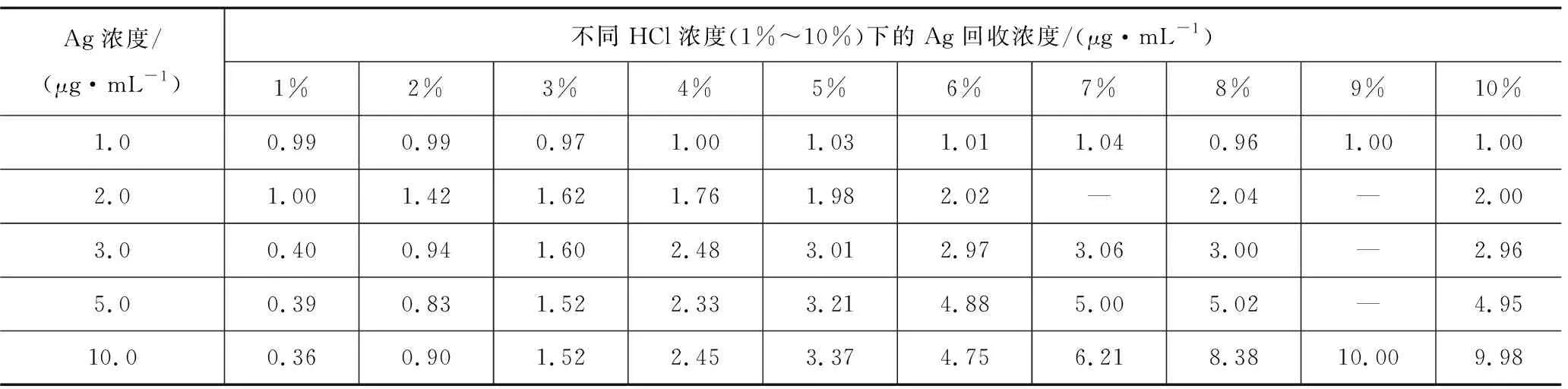
表1 不同浓度银标准溶液在不同盐酸酸度中回收浓度Table 1 Recovery concentrations of different concentrations of silver standard solution in different hydrochloric acid acidity
回收率曲线(图2)及回收浓度(表1)所显现出的规律:
(1)溶液中Ag+浓度越大则要求的盐酸酸度越高,因其生成银氯络离子需要的氯离子越多,也就越容易因操作不当出现测得浓度偏低,特别是杂质元素超标样品,很容易得出不超标的错误结果。检测未经提纯的足金999回收料时更应引起注意。
(2)1.0 μg/mL Ag溶液适应盐酸酸度范围很大,即便赶氮氧化物时溶液体积较小或定容盐酸酸度低至1%,仍能得到满意的回收率,说明其对溶液制备操作这个环节要求不高。这也从另一个角度诠释了为什么999.9‰金ICP分析很少出现银误差大现象,因为其杂质总量一般不超过100 μg/g,即杂质元素总浓度不超过1 μg/mL,银在此溶液中浓度较少大于1.0 μg/mL所致。实验中发现,银氯络离子的形成不易掌控,波动较大。
2.2.3 对银分析结果平行性的影响
银分析结果平行性不好,除了取样位置、环境污染等因素外,样品溶液制备过程也就是赶氮氧化物与盐酸酸度掌控应为主要影响因素。
例如:一个样品制得的两份平行试液,使用 ICP-OES测得的浓度值,一份为5.0 μg/mL,另一份仅为3.0 μg/mL。由5 μg/mL回收率曲线及回收浓度表推算可得,第二份很有可能赶氮氧化物时溶液体积过小或定容盐酸酸度4%~5%,由此导致本份结果偏低并造成Ag平均值变低,最终转化为金含量偏高。
2.2.4 实验操作的掌控
针对以上现象,只要严格把控好实验操作中的几个关键点,即可大大降低其出现的几率。
王水溶金目前有两种解释,见化学反应式。
Au+4HCl+HNO3=H[AuCl4]+NO↑+2H2O
(1)
Au+3HCl+HNO3=AuCl3+NO↑+2H2O
(2)
由以上两化学反应式可看出,无论哪种解释其过程中都消耗了大量的盐酸即氯离子。所以,溶样时当溶液中仅有少量盐酸时,银与少量氯生成白色氯化银沉淀(图3)。
Ag++Cl-=AgCl↓(白色) (溶度积常数 ksp=1.56×10-10)
(3)
盐酸的特点:具有还原性质;具有成络作用,能够与许多金属离子(如贵金属银、铱、钯等)形成络合物,从而加快了试样的分解;容易挥发除去;生成的盐类(如氯络合物)易溶于水。
当盐酸酸度相对较大,有大量氯离子存在时:
AgCl + Cl-= [AgCl2]-1
(4)
AgCl + 2Cl-= [AgCl3]-2
(5)
由此可见:盐酸既可以生成氯化银沉淀,也可以复溶氯化银沉淀。如何避免生成氯化银沉淀而使其直接形成银氯络离子,关键在于操作过程中应重点关注赶硝酸时溶液蒸发体积与溶液转移定容过程。
为此,在样品溶液制备过程中应注重以下几点:
(1)赶硝酸时切不可浓缩过快或造成局部蒸干、体积过小(小于2)以致蒸干(图4)。一旦蒸干则应补加王水再溶解及重赶硝酸。
(2)赶氮氧化物后加入一定量浓盐酸,此量可致定容后盐酸酸度不低于10%。放置于220℃高温电热板上快速加热2~3 min溶解酸可溶物。因盐酸加热蒸发较快,此时不可加热时间过长,以避免盐酸损失过多导致酸度偏低。
(3)溶液冷却至室温由烧杯向容量瓶转移定容时要快速操作。
(4)尽快摇匀。因转移及定容时容量瓶内上下形成了很明显不均匀的盐酸浓度梯度,所以应该定容一个立刻摇匀一个,尽量不要全部定容完后再摇匀。特别是大批量样品同时操作时更应注意以上几点。
3 结语
足金999饰品检测无论是在各质检部门还是在各生产企业都占有重要地位,然而对杂质元素银的检测至今难以形成准确的分析操作规程体系。本文依据多年有损分析工作实践积累的经验,参照相应的分析测试国标,明确指出银为影响检测结果准确性的重要因素。通过相关实验及理论分析,重点研讨了直接影响银检测结果准确性的关键所在——溶液盐酸浓度,并结合日常工作实践经验有针对性的提出了具体实验操作步骤与注意事项,希望对同业人员起到借鉴与参考作用。

