PI3K/AKT/NF-κB信号通路在大鼠尿酸性肾病中的作用机制
隋晓露, 许云鹏, 张燕子, 张艾莎, 谢婷妃, 袁树珍,邹杰锋, 曾启城, 陈继红
(深圳大学第二附属医院 肾内科, 广东 深圳, 518000)
肾间质炎症和肾间质纤维化是尿酸性肾病的主要病理损害机制,信号通路介导的炎症损伤机制是其病理损害发生的重要原因。目前,已知多种信号通路在尿酸性肾病的发生发展过程中起重要作用[1]。PI3K/AKT/NF-κB信号通路广泛参与细胞的凋亡、增殖、分化和迁移等过程。本研究通过“腺嘌呤+乙胺丁醇灌胃”建立尿酸性肾病大鼠动物模型,观察尿酸性肾病大鼠PI3K/AKT/NF-κB信号通路基因、蛋白和炎性细胞因子表达水平,探讨 PI3K/AKT/NF-κB信号通路在尿酸致肾脏细胞炎症损伤中的调控机制。
1 材料与方法
1.1 实验动物分组及处理
雄性SD大鼠36只,由南方医科大学动物实验中心提供,体质量180~200 g, 恒温环境下标准化饲养1周。36只大鼠随机分为实验组及对照组,每组18只。本研究方案经深圳市宝安区人民医院伦理委员会伦理审查通过。
实验组大鼠予腺嘌呤+乙胺丁醇灌胃建立大鼠高尿酸性肾病模型。腺嘌呤 10 g、乙肝丁醇 25 g, 加生理盐水定容至1 L,-20 ℃分装保存,使用前恢复至室温。按腺嘌呤100 mg/kg+乙肝丁醇250 mg/kg, 每日1次灌胃,连用28 d。给药前、腺嘌呤+乙胺丁醇灌胃28 d时采血,检测血浆中黄嘌呤氧化酶(XO)、血尿酸(UA)、肌酐(Cr)和尿素氮(BUN), 上述指标显著高于对照组提示造模成功。对照组给予等量生理盐水灌胃。
1.2 标本收集及处理
采集颈静脉血,每次1 mL, 肝素抗凝后提取血浆,-80 ℃保存。实验结束处死大鼠,摘取双侧肾脏,取部分肾脏观察肾脏组织病理学改变,剩余肾脏-80 ℃冻存。
1.3 观察指标及方法
1.3.1 生化指标检测: 采集新鲜静脉血,肝素抗凝后提取血浆,检测血浆中XO、UA、Cr和BUN水平。
1.3.2 肾脏组织病理学: 取各组新鲜肾脏皮质、髓质和皮髓交界处标本,用 10%福尔马林固定,脱水、石蜡包埋、切片,经苏木精-伊红(HE)染色后,观察肾脏各部位的组织病理学改变。
1.3.3 逆转录-聚合酶链反应(RT-PCR)检测磷酯酰肌醇3激酶(PI3K)、蛋白激酶B(AKT)和核转录因子-κB(NF-κB)基因表达水平: 总RNA抽提。匀浆器加入1 mL Trizol Reagent, 置冰上预冷。取约100 mg新鲜肾脏于匀浆器中充分研磨,离心取上清,加入200 μL三氯甲烷,剧烈振荡45 s, 使其充分混匀呈乳状,室温静置3 min。4 ℃下12 000转/min, 离心10 min, 上清液转移到新离心管中,加入等体积异丙醇,颠倒混匀,-20 ℃放置5 min, 4 ℃下12 000转/min, 离心10 min, 管底白色沉淀即为RNA。吸除上清液,加入75%乙醇1 mL颠倒混匀,使沉淀悬浮。4 ℃下12 000转/min, 离心5 min, 弃上清液,吸净管底乙醇,离心管置于超净台上吹3 min, 晾干沉淀。加入50 μL无RNA酶的水溶解RNA, Nanodrop 2000检测RNA浓度及纯度,浓度过高的RNA进行适当比例的稀释,终浓度为100 ng/μL。反转录: PCR管加入含100 ng RNA以上的溶液作为反转录的模板。加入1 μL 特异性miRNA反转录引物,无核糖核酸酶去离子水补足至12 μL, PCR仪上65 ℃保温5 min, 迅速置冰上冷却。依次加入4 μL 5×ES Reaction Mix, 2 μL 10 mmol/L dNTPs, 1 μL RNA inhibitor和1 μL反转录酶,移液枪抽吸混匀。PCR仪上42 ℃保温60 min, 结束后80 ℃保温5 min灭活反转录酶。定量PCR: 取0.2 mL PCR管,配制反应体系(2×qPCR Mix 12.5 μL, 7.5 μmol/L基因引物2.0 μL, 反转录产物2.5 μL, 双蒸水8.0 μL), 每个反转录产物配制3管。PCR扩增: 预变性95 ℃ 5 min, 循环(44次)95 ℃, 15 s→56 ℃, 30 s→72 ℃ 20 s, 熔解曲线75 ℃→95 ℃, 每20 s升温1 ℃。△△CT法进行结果处理。
1.3.4 蛋白免疫印迹(Western Blot)法检测各组PI3K、AKT和NF-κB 蛋白表达水平: 组织总蛋白提取。新鲜肾脏约100 mg用预冷磷酸盐缓冲液(PBS)漂洗3次,去除血污,剪成小块置于匀浆器中,加入蛋白质裂解液(RIPA∶PMSF∶磷酸酶抑制剂按100∶1∶1的比例配置),冰浴彻底匀浆,将匀浆液转移至离心管中,振荡。冰浴30 min, 期间用移液器反复吹打,确保匀浆液完全裂解。4 ℃下13 000 g离心5 min, 收集上清液(总蛋白溶液)。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE): 根据样品浓度确定上样量,在蛋白样品中加入蛋白上样缓冲液, 100 ℃沸水浴5 min。配制分离胶加入四甲基乙二胺(TEMED)后立即摇匀灌胶。配制浓缩胶加入TEMED后立即摇匀灌胶,剩余空间灌满浓缩胶然后将梳子插入浓缩胶中。拔出梳子,将电泳架放入电泳槽中,加入电泳缓冲液,将样品加入点样孔中。按浓缩胶50 V、分离胶120 V进行恒压电泳。转膜: 甲醇活化聚偏氟乙烯膜(PVDF)膜,按照正负极的方向摆放转膜“三明治”结构, 100 V恒压转膜。抗体孵育: 转好的膜加入封闭液,室温封闭1 h, 除去封闭液,加入已稀释的一抗4 ℃过夜。回收一抗,用洗膜缓冲液(TBST)洗3次,每次5 min, 加入稀释好的二抗,室温孵育30 min, TBST在室温下摇床洗4次,每次5 min。化学发光检测: 滴加新鲜配制的ECL混合溶液于膜的蛋白面侧,暗室中曝光、显影和定影。Image J软件处理系统分析目标带的光密度值。
1.3.5 酶联免疫吸附试验(ELISA)法检测白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)、白细胞介素-1β前体(Pro-IL-1β)、白细胞介素-1β(IL-1β)和转化生长因子-β1(TGF-β1)表达水平: 取约100 mg新鲜肾脏样本置于匀浆器内充分研磨, 5 000转/min, 4 ℃离心5 min, 取上清液,按ELISA试剂盒检测法检测IL-6、TNF-α、MCP-1、Pro-IL-1β、IL-1β和TGF-β1 水平。
1.4 统计学分析
2 结 果
2.1 血浆中BUN、Cr、UA和XO水平测定
给药前, 2组BUN、Cr、UA和XO水平比较,差异无统计学意义(P>0.05)。给药后,实验组BUN、Cr、UA和XO水平高于对照组,差异有统计学意义(P<0.05或P<0.01)。见表1。
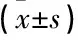
表1 2组大鼠给药前后BUN、Cr、UA、XO水平
2.2 PI3K/AKT/NF-κB信号通路mRNA表达水平测定
实验组PI3K、AKT和NF-κBmRNA 表达水平高于对照组,差异有统计学意义(P<0.05或P<0.01)。见表2。
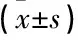
表2 2组大鼠PI3K、AKT、NF-κB mRNA表达水平
2.3 PI3K/AKT/NF-κB信号通路蛋白表达水平测定
实验组PI3K、AKT和NF-κB 蛋白表达水平高于对照组,差异有统计学意义(P<0.05或P<0.01)。见表3。
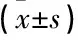
表3 2组大鼠PI3K、AKT、NF-κB蛋白表达水平
2.4 PI3K/AKT/NF-κB信号通路下游炎性细胞因子表达水平测定
实验组TNF-α、MCP-1、IL-6、Pro-IL-1β和IL-1β水平高于对照组,差异有统计学意义(P<0.05或P<0.01)。见表4。
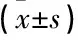
表4 2组大鼠PI3K/AKT/NF-κB信号通路下游炎性细胞因子表达水平 pg/mL
2.5 2组大鼠肾脏组织病理学变化
对照组大鼠肾小管上皮结构正常,未见萎缩,未见明显空泡变,管内无尿酸盐结晶,间质无炎症细胞浸润。
实验组大鼠肾小管上皮细胞可见不同程度变性坏死及囊性扩张,扩张小管内大量管型; 肾间质可见以中性粒细胞为主的大面积炎症细胞浸润,淋巴细胞、单核细胞等亦可见; 间质纤维增生,肾皮髓质、间质及小管内可见大小不等棕色结晶沉积,部分肾集合管内可见蛋白管型及红细胞管型; 肾小球不同程度增大,肾小球囊壁层细胞肥大,内膜增厚,伴少量血浆渗出。见图1。

A、B: 对照组大鼠肾脏组织HE染色; C、D: 实验组大鼠肾脏组织HE染色。
3 讨 论
高尿酸水平可导致多种靶器官功能损害,其主要发病机制有尿酸盐沉积、免疫紊乱、炎症损伤、肾素血管紧张素系统(RAS)激活、氧化应激和内质网应激等。细胞吞噬尿酸盐晶体可通过激活补体系统及巨噬细胞,导致炎症细胞因子表达增高,激发炎症反应,导致脏器损伤[2]。肾小管细胞通过内吞尿酸晶体并释放细胞因子,诱导局部炎症反应,肾间质成纤维细胞分泌紊乱又可造成细胞外基质合成降解失衡,最终导致肾间质炎症和肾间质纤维化[3-4]。
转移生长因子(TGF)/smad、酪氨酸激酶(Syk)和寡聚化结构域样受体蛋白3(NLRP3)/Toll样受体(TLRs)等多种信号通路参与尿酸性肾病的发生发展过程[5]。PI3K/AKT/NF-κB信号通路已证实参与尿酸性肾病的发病过程。PI3K是由调节亚基p85和催化亚基p110组成的异二聚体,可接受来自G蛋白连接受体、酪氨酸激酶连接受体传递的信号,通过与连接蛋白相互作用,使二聚体构象改变而激活。AKT是PI3K的靶蛋白,可接收PI3K传递的生物信息,通过磷酸化途径被激活。NF-κB可与基因启动子固定核苷酸序列结合,调节编码细胞因子,激活相关炎性细胞分化,引发炎症反应[6-8]。
本研究通过建立尿酸性肾病大鼠动物模型,观察尿酸性肾病大鼠PI3K/AKT/NF-κB信号通路目标基因mRNA、蛋白表达、炎性细胞因子水平变化和大鼠肾脏病理变化情况。本研究结果表明,与对照组相比,实验组目标基因PI3K、AKT和NF-κBmRNA表达水平增高及其蛋白表达增加,炎性细胞因子NF-α、MCP-1、TGF-β1、IL-6、Pro-IL-1β和IL-1β表达水平增高。HE染色病理结果提示,实验组大鼠肾小管上皮细胞不同程度变性坏死及囊性扩张,肾间质可见以中性粒细胞为主的大面积炎症细胞浸润,间质纤维增生,肾皮髓质、间质及小管内可见大小不等棕色结晶沉积,肾小球不同程度增大,肾小球囊壁层细胞肥大,内膜增厚,伴少量血浆渗出。
本研究发现,肾小管细胞可内吞尿酸结晶,可能通过激活PI3K/AKT/NF-κB信号通路并释放炎症因子,诱导炎症反应,导致肾间质炎症和肾间质纤维化。其可能的机制如下: ① PI3K与酪氨酸残基受体结合后,生成磷酸化的磷脂产物,磷脂产物可将AKT转位到细胞膜上[9],在磷酸肌醇依赖性酶的作用下,参与细胞周期的调控,血管平滑肌细胞增生、迁移并发生血管重构。在肾间质和肾小管内,入球小动脉管壁增厚,引起管腔狭窄甚至管腔闭塞,导致肾灌注严重不足,促使肾纤维化,进而加重肾损害[10-12]。② 在高尿酸诱导的肾组织炎性损害中, NF-κB激活可引起一系列的酶促反应。胞内NF-κB诱导性激酶激活IκB激酶复合物,经过磷酸化、泛素化后转移到细胞核,与基因上的κB位点发生特异性结合,促使肾小管上皮细胞赖氨酰氧化酶和MCP-1蛋白表达上调,细胞外基质纤连蛋白合成增加,基质蛋白沉积加速肾间质纤维化[12-14]; ③ 在PI3K/AKT/NF-κB信号通路激活状态下,单核-巨噬细胞分泌TNF-α和IL-1β明显增加,可反过来进一步活化NF-κB, 形成炎症信号的正反馈,肾间质单核胞浸润导致炎症损伤,加剧肾间质炎性损伤和肾组织纤维化[13-14]。TNF-α还可使血管内皮舒张功能减退,从而影响肾脏血流动力学,使肾小球滤过率下降,加剧肾间质炎性损伤和肾组织纤维化[15]。④ IL-6、TGF-β1是导致肾小球硬化和肾脏疾病恶化的重要因素[16]。IL-6可通过自分泌与旁分泌的方式与TGF-β1相互作用,两者相互促进引发炎症级联反应,加剧肾脏纤维化进程,同时还可以促进内皮细胞的促凝血活性,并增加系膜细胞蛋白激酶活性,加重肾损害[16-17]。
高尿酸激活PI3K/AKT/NF-κB信号通路,通过诱导血管重构、激活酶促反应、改变血流动力学和引发炎症级联反应等途径,引起肾灌注不足、细胞外基质沉积加速和肾间质单核细胞浸润等后果,导致肾间质炎性损伤和肾间质纤维化,这可能为尿酸性肾病发生发展的重要机制,未来或将成为尿酸性肾病干预及治疗靶点。

