促红细胞生成素衍生物在急性肾损伤中的研究进展
刘 敏, 徐 夏, 王 荣, 刘昌华, 徐道亮
(扬州大学附属苏北人民医院/江苏省苏北人民医院 肾脏内科, 江苏 扬州, 225001)
急性肾损伤(AKI)是指由多种原因引起的短时间内肾功能快速减退而出现的临床综合征,其特征是肾小球滤过率突然下降,血清肌酐浓度升高或尿量减少。AKI是住院患者和重症监护病房患者的严重并发症,可增高患者的病死率[1]。目前,AKI仍缺乏特异性的治疗方法,肾脏替代治疗(RRT)是仅有的治疗选择,但RRT的启动时间尚存在争议,并且受多种因素的影响,仅有11.8%的患者接受RRT[2]。
促红细胞生成素(EPO)是一种糖蛋白激素,因其具有促进骨髓造血的功能而被广泛应用于治疗肾性贫血。EPO除了具有造血功能,还具有组织保护作用。EPO受体(EPOR)广泛分布于组织器官及不同类别的细胞中,EPO通过与细胞表面相应受体结合发挥多种功能,包括肾脏保护功能[3]。在AKI动物模型中, EPO已被验证具有肾脏保护功能[4-5]。临床试验[6-7]显示,在心脏手术前预防性应用EPO可以预防AKI并改善术后的肾脏功能。因此, EPO及其受体可能成为AKI治疗的选择之一。
1 EPO治疗AKI的效应及缺陷
EPO是一种高糖基化蛋白质,分子量约为30.4 kDa, 主要在胎儿肝脏和成人肾脏中合成。在成人中,当红细胞水平下降时,肾小管间质细胞以经典的内分泌方式将EPO分泌到循环中,最终与骨髓中的红系祖细胞上的同源二聚体EPO受体(EPOR)2结合,通过抑制凋亡和激活生存信号通路使红系祖细胞终末分化以维持红细胞生成的动态平衡。然而, EPO的作用不仅局限于促进红细胞生成这一方面。研究[8-9]表明EPO可通过改善自噬、抗细胞凋亡和抗炎对缺血诱导的肾脏、心脏、脑和肝脏组织损伤具有保护作用。
EPO信号可通过2种受体传递,一种是EPOR形成的同源二聚体(EPOR)2, 另一种是EPOR和β共同受体(βCR)形成的异源二聚体。βCR又称CD131, 是Ⅰ型细胞因子共有的亚单位受体,包括粒细胞-巨噬细胞集落刺激因子(GM-CSF)、白细胞介素-3(IL-3)和白细胞介素-5(IL-5)[10]。EPOR/βCR也称为先天修复受体,可以激活组织保护和修复,在正常组织中通常不表达,在损伤或炎症中迅速被诱导。大量动物实验研究[11-12]显示, EPO可改善肾功能及减轻肾组织损伤,但在缺乏βCR的情况下, EPO的肾脏组织保护作用消失,表明EPO与EPOR/βCR受体结合具有组织保护作用[5, 13]。血浆中EPO的正常浓度是1~10 pmol/L, 经典的(EPOR)2复合物与EPO结合的亲和力是10~15 pmol/L, 而EPOR/βCR复合物与EPO的亲和力大于1 nmol/L[14-15]。EPO对(EPOR)2的亲和力显著高于EPOR/βCR, 因此EPO的全身剂量需要显著高于常规治疗剂量才能实现细胞保护作用。尽管EPO 对AKI的肾功能和结构具有保护作用,但从长远的角度看,使用超生理剂量的EPO会增加肾脏纤维化[16]和心血管不良事件的风险。临床研究[17]发现,静脉给予EPO治疗对接受冠状动脉搭桥手术患者无肾脏保护作用。AYDIN Z等[18]发现,肾移植后使用高剂量EPO并未对肾脏显示出保护性作用,反而增加血栓事件的发生风险。血清 EPO 浓度升高会提高血细胞比容及增强血小板和内皮活化,这些机制是心血管不良事件发生风险增加的原因。
2 EPO衍生物治疗AKI的效应及优势
EPO衍生物仅与EPOR/βCR特异性结合,避免引起红细胞生成。因此,不具有促进红细胞生成作用的EPO衍生物在器官组织保护方面比EPO的应用领域更加宽泛。
BRINES M等[19]通过对EPO及其受体结构的研究发现,在EPO的三级结构中,只有螺旋A、C、D和连接螺旋AB的环与(EPOR)2相互作用促进红细胞生成,而这些并不是组织保护所必需的结合位点。通过对这些区域内的氨基酸残基进行化学或突变修饰,可以阻断EPO与(EPOR)2结合,从而解离了组织保护和红细胞生成。
螺旋B表面肽(HBSP)又称ARA290, 是一种由EPO螺旋B结构域衍生而来的线性多肽,由11个氨基酸组成。与EPO相比, HBSP可减轻因红细胞生成引起的副作用,在体外和体内均具有更显著的组织保护作用。HBSP可减轻内毒素诱导的AKI, 降低炎症因子水平,改善脓毒症大鼠的肾功能[20]。在小鼠缺血再灌注损伤(IRI)模型中, HBSP通过EPOR/βCR激活磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)通路,降低caspase-9、caspase-3活性,降低肾脏细胞凋亡率,减轻组织损伤,保护肾脏[21]。
环状螺旋B肽(CHBP)是在HBSP结构基础上通过环化合成的新型EPO衍生肽。与血浆半衰期只有2 min的HBSP相比, CHBP不仅提高了代谢稳定性,也提高了对蛋白水解酶的抵抗力和肾脏保护作用[22]。CHBP可明显改善大鼠移植肾急性排斥反应,减轻CD4+、CD8+T细胞的浸润及细胞凋亡,减少移植肾组织的损伤[23]。在小鼠和人近端肾小管上皮细胞中, CHBP可抑制转化生长因子-β诱导的细胞外基质蛋白表达和细胞外基质转化,减轻IRI诱导的肾纤维化[24]。此外,在AKI大鼠模型中, CHBP通过减少caspase-3的激活、细胞凋亡和炎症反应改善肾功能和组织损伤[25-26]。
氨基甲酰化EPO(CEPO)是一种由EPO赖氨酸残基氨甲基化形成的EPO衍生物,不激活(EPOR)2, 只与EPOR/βCR复合体结合发挥效应,缺乏红细胞生成和血管收缩作用。与EPO治疗相比, CEPO可更好地改善肾功能及患者存活率,不会显著提高红细胞压积水平和血压[15, 27]。因此,在改善AKI的预后方面, CEPO疗法可能优于EPO。此外,在大鼠模型中, CEPO治疗的残肾血流速度明显加快,肾小球和肾小管周围毛细血管内皮细胞显著增生,而血红蛋白变化幅度较小,对延缓肾小管间质损伤更有益[28]。EPO及其衍生物的作用受体见图1。
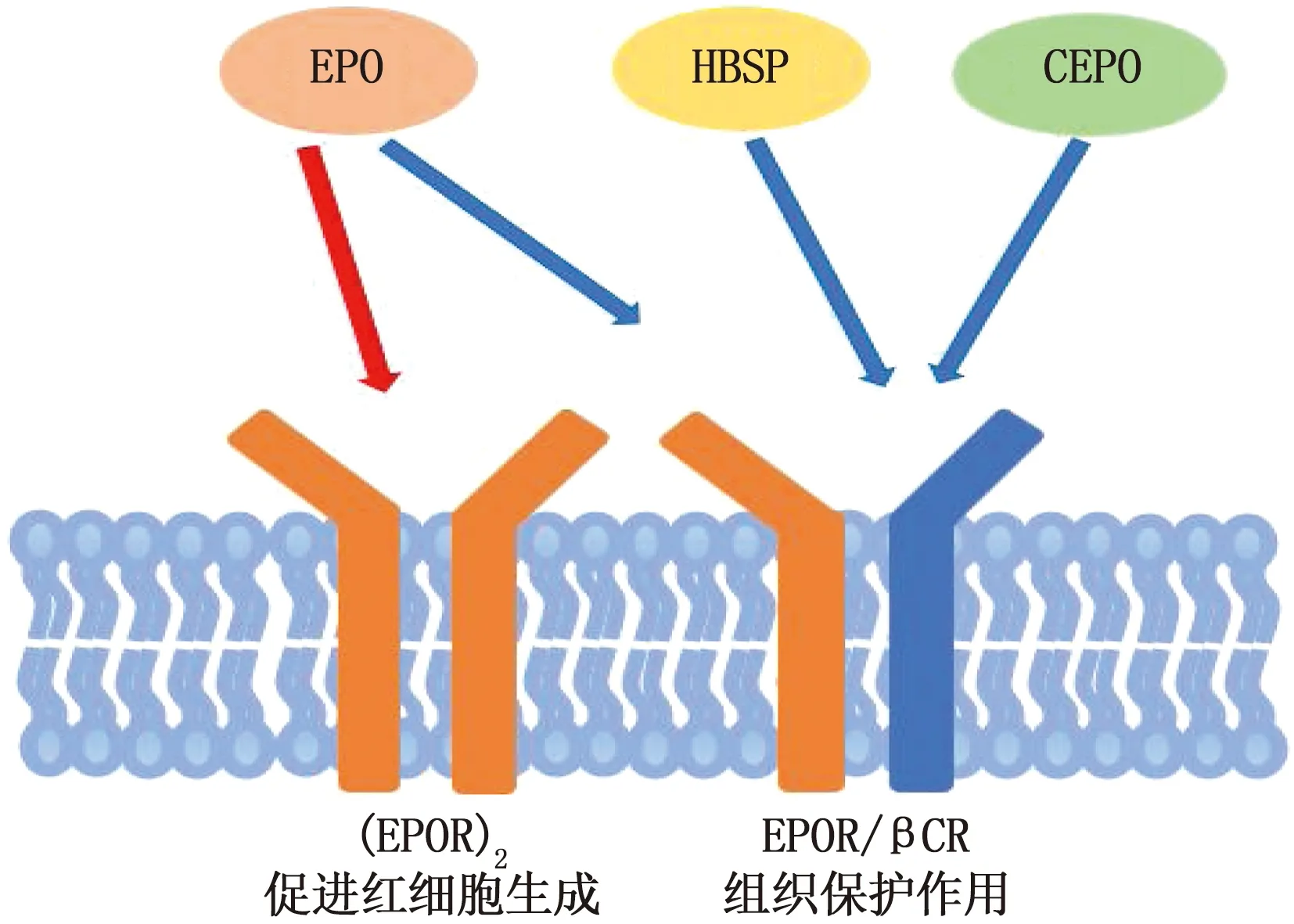
图1 EPO及其衍生物的作用受体
3 EPO衍生物治疗AKI的机制
在对EPO及其衍生物的研究过程中, EPO衍生物治疗AKI的作用机制也得到了深入探索。EPO及其衍生物在肾脏中产生的组织保护作用的信号转导通路复杂多样, EPO及其衍生物与EPOR/βCR复合体结合使Janus激酶2(JAK2)自动磷酸化来触发细胞内信号传导,这种信号通过几种不同的分子通路级联,包括信号转导和转录激活因子(STAT)通路、PI3K/Akt通路、核因子κB(NF-κB)通路、AMP活化蛋白激酶(AMPK)通路、促分裂原活化蛋白激酶(MAPK)通路。
3.1 STAT信号通路
在细胞应激后, HBSP可使EPOR/βCR迅速转移到细胞膜表面,增加EPOR/βCR复合体的表达[29]。当 EPO及其衍生物与EPOR/βCR复合体结合后通过激活JAK2从而使STAT5磷酸化并移位到细胞核内,触发特定靶基因的转录。研究[30]显示, EPO可通过JAK2/STAT5信号通路对小鼠坏死的肾小管上皮细胞发挥保护作用。此外,在大鼠肾移植模型中发现, CHBP可通过激活JAK2/STAT3/SOCS1通路抑制树突状细胞成熟来改善肾移植急性排斥反应[23]。
3.2 PI3K/Akt信号通路
PI3K/Akt作为细胞应激的关键调节因子,是细胞存活的最重要通路之一。研究[20]显示, HBSP可通过激活PI3K/Akt通路调节肾功能,抑制炎症反应,对脓毒症大鼠肾损伤具有保护作用,其肾脏保护作用与抑制PI3K/Akt信号通路下游糖原合成酶激酶-3(GSK-3β)的磷酸化有关,通过使GSK-3β磷酸化来抑制GSK-3β的激活,从而激活核因子红2相关因子2(Nrf2)和抑制NF-κB来减弱氧化应激和炎症反应[31-32]。在叶酸所致的AKI模型中,敲除GSK-3β或用微剂量锂阻断肾小管中的GSK-3β可恢复肾脏中Nrf2的抗氧化反应,并减缓AKI向CKD的转变[33]。在肾脏IRI模型中, CHBP激活Akt的下游效应因子Forkhead box O3a(FOXO3a)参与抗纤维化。此外, PI3K/Akt通路还可激活eNOS导致微循环中一氧化氮(NO)的表达水平升高,引起局部血管舒张,抑制血小板和中性粒细胞的黏附并调节血管生成,从而减轻过度的肾内血管收缩,进而减轻肾脏功能障碍[5]。
3.3 NF-κB信号通路
NF-κB是一种炎症转录因子,参与多种炎症细胞因子的转录调控,通过激活炎症信号通路导致细胞损伤。在大鼠同种异体肾移植模型中, ARA290通过减弱NF-κB与DNA的结合来抑制下游靶基因的转录,从而减轻炎症反应,改善肾功能[34]。
3.4 AMPK通路
AMPK是细胞能量状态的重要传感器,在能量生产和线粒体网络中发挥重要作用。AMPK在肾脏中高度表达,能调节肾小管细胞中各种离子和肌酸转运体的活性,降低足细胞通透性和脂联素激活的蛋白尿。AMPK激活物在IRI模型中通过诱导自噬/线粒体自噬发挥肾脏保护作用[35]。AMPK/AKT/mTOR信号通路在CHBP介导的自噬调节中起着关键作用。CHBP可通过抑制mTORC1和激活mTORC2而诱导自噬,从而对缺血再灌注产生肾脏保护作用[22]。
3.5 MAPK信号通路
MAPK在将细胞外刺激转化为广泛的细胞反应(包括细胞生长、迁移、增殖、分化和凋亡)方面发挥着关键作用,细胞外信号调节激酶(ERK)1/2是MAPK的下游通路[36]。HBSP通过激活ERK1/2减少心肌细胞凋亡来保护心脏功能。动物研究[37]发现ERK/p53 信号通路在保护IRI诱导的肾脏凋亡中发挥重要作用,在大鼠肾移植模型中, EPO可通过激活STAT6/MAPK/NF-κB信号通路减少炎症反应和调节细胞凋亡来保护肾移植后的AKI。EPO衍生物与EPOR/βCR结合后的下游信号通路见图2。
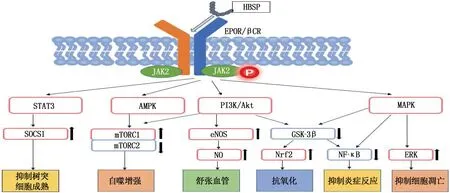
图2 EPO衍生物与EPOR/βCR结合后的下游信号通路
4 前景与展望
EPOR/βCR在肾脏、心脏、肝脏、肺脏和神经系统等中共同表达,在各种IRI模型中, EPO衍生物被证明通过与EPOR/βCR结合发挥组织保护作用。在AKI模型中, EPO衍生物可通过多种信号传导通路产生肾脏保护作用。临床研究[38]显示,术前予以EPO治疗可降低患者术后发生AKI的风险,缩短患者的住院时间, EPO及其衍生物有望成为AKI治疗的选择。在已有的研究[39]中, ARA290可促进小神经纤维再生,缓解神经性疼痛,已被FDA和欧洲药品管理局指定为治疗结节病神经性疼痛的药品。BRINES M等[40]进行的一项临床研究发现,ARA290可以改善代谢,减轻2型糖尿病患者的神经病变症状,且具有极好的安全性。目前尚无EPO衍生物治疗AKI的相关临床研究,因此需要大型随机临床研究来全面评估EPO衍生物在AKI中的作用。

