日本血吸虫带电多泡体蛋白5的生物学特性研究
张 旻,傅志强,林矫矫,洪 炀
血吸虫病是由裂体吸虫感染而引起的一种易被忽视的寄生虫病。目前,报告的血吸虫病感染病例数超过2.5亿,因此,该病对全球的公共卫生造成了较大威胁[1]。血吸虫的体被是一层覆盖于整个虫体表面的合胞体,在虫体侵入终末宿主体内进行生长发育的过程中,该结构进行不断地更新,从而使不同发育阶段虫体体被呈现差异性[2]。体被是血吸虫与终末宿主内环境直接作用的界面,一方面,胞质桥可以将由位于细胞体中的内质网、高尔基体等细胞器合成的产物运输到体被中,为该结构的形成提供原料;另一方面,宿主源性蛋白可以通过体被被膜的内吞作用进入到胞质桥中,并被运输至高尔基体中进行降解,为虫体逃避宿主的免疫攻击提供帮助[3]。因此,体被对维持虫体在宿主体内的生长发育繁殖起着极为关键的作用,而体被蛋白也普遍被认为是开发抗血吸虫病疫苗与药物的理想候选分子[4]。
带电多泡体蛋白家族(Charged multivesicular body protein,CHMP)为内吞体分选转运复合体III(ESCRT-III)的重要组分,该复合体参与了多泡体(Multivesicular bodies,MVBs)的形成,而该结构可以将与营养物质、信号受体等相关的蛋白质进行分选,部分送至溶酶体降解,部分送至细胞膜上利用,从而参与到各种代谢过程中[5-6]。在拟南芥的相关研究中表明,高尔基体合成的糖转移酶、糖蛋白以及多糖等物质被MVBs运送至细胞壁,从而促进其生长与更新[7]。作为CHMP家族的主要成员,CHMP5可以通过调节ESCRT-III的作用而影响MVBs发挥其功能[8]。在S.japonicum体被蛋白质组学的研究中鉴定到CHMP5,推测该蛋白可能在血吸虫体被更新的过程中起着重要作用[9]。
本研究对S.japonicumCHMP5基因进行克隆、表达,分析其在不同时期虫体中的转录水平,检测其重组蛋白的反应原性及其在虫体组织中的分布情况,并评估重组蛋白在小鼠体内诱导的免疫保护效果,为进一步探讨S.japonicumCHMP5的生物学特性提供基础。
1 材料与方法
1.1 尾蚴、血清与实验动物S.japonicum尾蚴(中国大陆株)、兔抗日本血吸虫可溶性成虫抗原的免疫血清、健康兔血清、健康小鼠血清均由国家动物血吸虫病参考实验室提供。BALB/c小鼠(雄性,6~8周龄,35只)购自中国科学院上海实验动物中心。

1.3 引物的设计与合成 根据GenBank中S.japonicumCHMP5(FN320038.1)、S.japonicumα-tubulin(AY815746.1)的基因序列,利用Primer 5.0软件设计引物(表1)。引物由上海华津生物技术有限公司合成。

表1 S. japonicum CHMP5和α-tubulin引物信息Tab.1 Primer sequences of S. japonicum CHMP5 and α-tubulin
1.4 CHMP5基因的扩增及重组质粒的构建 以S.japonicum成虫cDNA文库为模板,以F1/R1为上下游引物,PCR扩增CHMP5基因片段,经酶切后连接至表达载体pET28a(+)中,构建重组质粒pET28a(+)-CHMP5,将其转化至BL21(DE3)感受态细胞,经菌液PCR、质粒双酶切和测序对重组质粒鉴定。
1.5 CHMP5基因的生物信息学分析 利用BLAST在线程序搜索CHMP5基因编码氨基酸序列的同源序列,并通过Clustalx进行同源性比对分析。利用Compute pI/MW、TMHMM、SignalP、IEBD及GOR4等在线程序分析CHMP5氨基酸序列的理论等电点(pI)、相对分子质量(MW)、跨膜结构域、信号肽、B细胞抗原表位及二级结构。
1.6 荧光定量PCR检测CHMP5基因在不同发育阶段S.japonicum中的转录水平 采用肝门静脉灌注法收集S.japonicum7 d、14 d、21 d、28 d、35 d、42 d虫体及42 d雌虫、42 d雄虫,利用TRIzol法提取各时期虫体的总RNA,反转录为cDNA后作为模板,以F2/R2、F3/R3为上下游引物,利用SYBR GreenⅠ荧光定量PCR检测CHMP5、α-tubulin基因的转录水平。以α-tubulin基因为内参,采用相对定量法(2-ΔΔCt)计算CHMP5基因在不同发育时期虫体中的相对表达水平。
1.7 重组蛋白的表达、纯化及质谱鉴定 将pET28a(+)-CHMP5/BL21(DE3)宿主菌培养至OD600=0.6时,加入终浓度为1 mmol/L的IPTG诱导6 h,将宿主菌进行超声裂解,收集上清液,以His Bind树脂纯化试剂盒对表达产物进行纯化,经SDS-PAGE凝胶电泳检测后,将SDS-PAGE凝胶上的重组CHMP5蛋白目的条带切下,利用胰蛋白酶进行胶内酶解,经基质辅助激光解吸电离飞行时间串联质谱(MALDI-TOF/TOF-MS)技术对重组蛋白鉴定。
1.8 Western blotting检测重组蛋白的反应原性 将纯化的重组CHMP5蛋白与206佐剂充分乳化后,采用皮下分点注射法免疫5只SPF级BALB/c小鼠(20 μg,100 μL/只),每隔两周免疫1次,共免疫3次。于3免后第10 d,经摘眼球采血并分离血清,即为小鼠抗CHMP5重组蛋白的免疫血清。以纯化的重组CHMP5蛋白作为抗原,以兔抗日本血吸虫可溶性成虫抗原的免疫血清(1∶100)、小鼠抗CHMP5重组蛋白的免疫血清(1∶100)作为一抗,以山羊抗兔IgG-HRP(1∶1 000)、山羊抗小鼠IgG-HRP(1∶1 000)作为二抗,经DAB显色,通过Western blot检测重组CHMP5蛋白的反应原性,设健康兔血清、健康小鼠血清作为阴性对照。
1.9 免疫组化实验分析CHMP5在42 d虫体中的分布 将42 d血吸虫合抱成虫制成6 μm的冰冻切片,经丙酮固定、10%山羊血清封闭后,以小鼠抗CHMP5重组蛋白的免疫血清(1∶100)作为一抗,以山羊抗小鼠IgG-Cy3(1∶1 000)作为二抗,经DAPI(10 μg/mL)复染,通过荧光显微镜观察CHMP5在血吸虫虫体中的定位情况并进行拍照,设健康小鼠血清作为阴性对照。
1.10 重组蛋白对小鼠免疫保护效果的评价 将30只SPF级BALB/c小鼠随机等分成3组,即:重组蛋白免疫组、佐剂对照组及PBS对照组。重组蛋白免疫组小鼠注射含PBS、206佐剂和20 μg纯化重组CHMP5蛋白的乳化液(100 μL/只),佐剂对照组小鼠注射含206佐剂和PBS的乳化液(100 μL/只),PBS对照组小鼠注射等体积的PBS。每隔14 d免疫1次,共免疫3次。第3次免疫后的14 d,3组小鼠均经腹部皮肤贴片法感染S.japonicum尾蚴(40±1)条/只。于免疫后0 d、10 d、24 d、38 d、84 d,经眼眶静脉窦采血并分离血清。以纯化的重组CHMP5蛋白作为包被抗原(10 μg/mL),以各组小鼠血清(1∶100)作为一抗,以山羊抗小鼠IgG-HRP(1∶1 000)作为二抗,利用间接ELISA法检测特异性抗体水平。于感染后第42 d剖检小鼠,采用肝门静脉灌注法收集虫体并计数,统计减虫率;通过镜检计算肝组织虫卵数,统计肝脏减卵率。
1.11 统计方法 利用Excel 2010和SPSS 19.0软件进行数据统计分析。实验数据用(均数±标准差)表示,数据间比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 CHMP5基因的扩增及重组质粒的鉴定 以S.japonicum成虫cDNA文库为模板,PCR扩增获得大小约为675 bp的CHMP5基因目的片段,将其连接至表达载体pET28a(+)构建重组质粒,利用限制性内切酶BamH I与XhoI对重组质粒进行双酶切鉴定(图1),表明成功获得重组质粒pET28a(+)-CHMP5。
2.2 CHMP5基因编码氨基酸序列的生物信息学分析 对重组质粒pET28a(+)-CHMP5进行测序,分析其编码的氨基酸序列,结果显示,该测序序列编码224个氨基酸,与目标序列完全相符。利用NCBI的BLAST对S.japonicumCHMP5氨基酸序列进行相似性搜索,选择来自牛血吸虫(Schistosomabovis,RTG85136)、华支睾吸虫(Clonorchissinensis,GAA55213)、人类(Homosapiens,NP_057494)、牛(Bostaurus,NP_001029854)、小鼠(Musmusculus,NP_084090)共5个物种的CHMP5蛋白进行多重序列比对(图2)。结果显示,S.japonicumCHMP5与牛血吸虫的CHMP5相似性为82%,与其余物种的CHMP5相似性介于50%~56%。

M:DL2 000 DNA Marker;1:pET28a(+);2:pET28a(+)-CHMP5;3:pET28a(+)-CHMP5双酶切图1 重组质粒pET28a(+)-CHMP5的鉴定Fig.1 Identification of the recombinant plasmid pET28a(+)-CHMP5

图2 不同物种CHMP5氨基酸序列的同源性分析Fig.2 Homology analysis of the derived amino acid sequences of CHMP5 from various species
该蛋白pI为4.63,MW约为25 kDa,无跨膜结构域,无信号肽。在该蛋白的二级结构中,无规则卷曲所占比例为47.32%,α-螺旋为46.88%,延伸链为5.8%。S.japonicumCHMP5氨基酸序列中存在6个长度大于7个氨基酸[10]的B细胞抗原表位,主要分布于aa5-aa18、aa28-aa37、aa43-aa63、aa70-aa85、aa120-aa133、aa147-aa221,表明该蛋白可能具有良好的反应原性。
2.3 CHMP5基因在不同发育时期虫体中的转录水平 利用SYBR GreenⅠ荧光定量PCR检测CHMP5基因在S.japonicum感染7 d、14 d、21 d、28 d、35 d、42 d虫体及42 d雌虫、42 d雄虫中的转录水平(图3),其在35 d、42 d虫体中的转录水平高于7 d、14 d、21 d、28 d虫体中的转录水平(P<0.05),在42 d雌虫中的转录水平约是42 d雄虫的3倍(F=718.465,P<0.05)。结果表明,在终末宿主小鼠体内,CHMP5基因在虫体的发育过程中持续表达,且转录水平呈升高趋势。
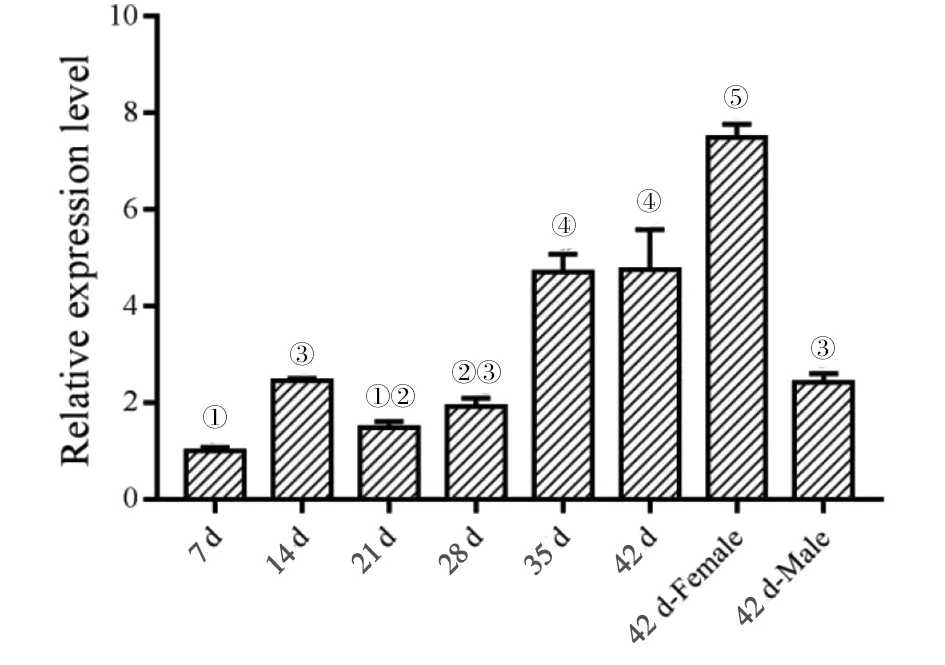
注:柱图上所标数字相同表示二者差异无统计学意义(P>0.05),所标数字不同表示二者差异有统计学意义(P<0.05)。图3 CHMP5在不同时期、性别S. japonicum虫体中的转录情况Fig.3 Patterns of stage- and sex-specific differential expression of CHMP5 in S. japonicum
2.4 重组蛋白的表达、纯化及质谱鉴定 重组CHMP5蛋白在IPTG(1 mmol/L)诱导6 h时达到最大表达量,且以可溶性蛋白形式存在,经His Bind树脂纯化,通过SDS-PAGE电泳检测,结果显示,诱导后的pET28a(+)-CHMP5/BL21(DE3)宿主菌在34 kDa左右出现了目的条带,略大于理论值29 kDa,且纯化后的产物呈现出单一的目的条带(图4)。利用MALDI-TOF/TOF-MS技术对SDS-PAGE凝胶上单一的目的条带进行鉴定,结果显示该产物确实为S.japonicumCHMP5,Mascot检索分值为446分,肽段匹配数为9个,序列覆盖率为39.29%。表明获得纯化的S.japonicum重组CHMP5蛋白。
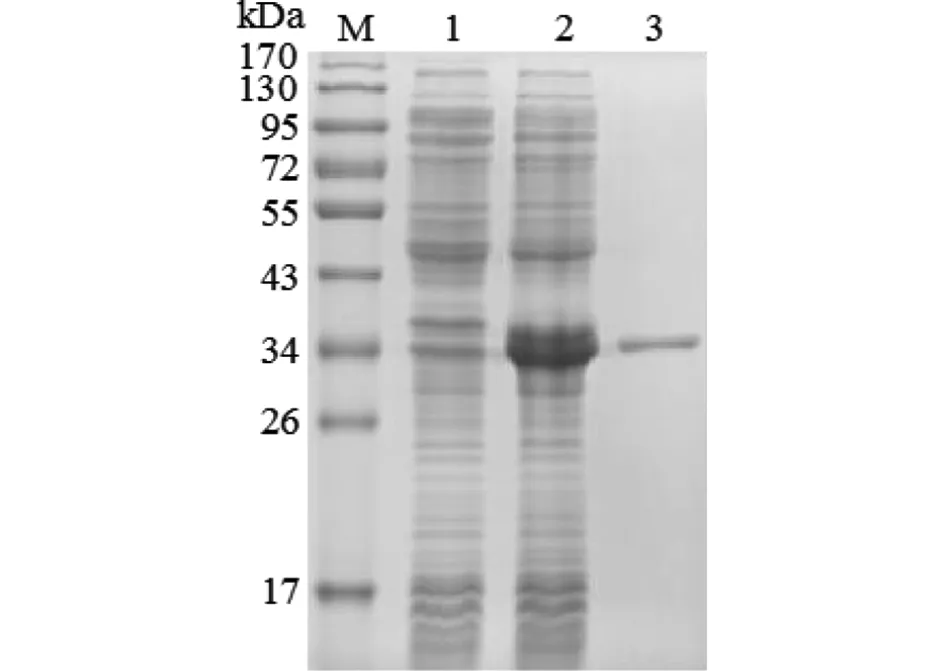
M:蛋白分子质量标准;1:诱导后的pET28a(+)/BL21(DE3)宿主菌;2:诱导后的pET28a(+)-CHMP5/BL21(DE3)宿主菌;3:纯化后的重组CHMP5蛋白图4 重组CHMP5蛋白表达和纯化的SDS-PAGE检测Fig.4 Expression and purification analysis of the recombinant CHMP5 protein by SDS-PAGE
2.5 重组蛋白的反应原性分析 以重组CHMP5蛋白为抗原进行Western blot分析,结果显示,重组蛋白与兔抗日本血吸虫可溶性成虫抗原的免疫血清(图5A)、小鼠抗CHMP5重组蛋白的免疫血清(图5C)发生了特异性反应,于34 kDa处出现了特异性条带,而阴性对照无反应(图5B、图5D),表明该重组蛋白具有良好的反应原性和免疫原性。

M:蛋白分子质量标准;1:兔抗日本血吸虫可溶性成虫抗原的免疫血清;2:健康兔血清;3:小鼠抗CHMP5重组蛋白的免疫血清;4:健康小鼠血清图5 重组CHMP5蛋白反应原性的Western blotting鉴定Fig.5 Reactogenicity analysis of the recombinant CHMP5 protein by Western blotting
2.6 CHMP5蛋白在42 d虫体中的分布 以小鼠抗CHMP5重组蛋白的免疫血清、健康小鼠血清作为一抗进行免疫组化实验,结果显示,前者在42 d血吸虫成虫体被出现了特异性的红色荧光(图6A),而后者无反应(图6B)。结果表明,CHMP5主要分布于S.japonicum虫体的体被上。

A:小鼠抗CHMP5重组蛋白的免疫血清;B:健康小鼠血清图6 S. japonicum CHMP5蛋白的免疫组化实验分析(100×)Fig.6 Immunolocalization of CHMP5 in adult S. japonicum,detected by IHC (100×)
2.7 免疫小鼠血清抗重组蛋白特异性抗体的检测 用间接ELISA方法检测重组蛋白免疫组、佐剂对照组及PBS对照组小鼠血清中抗CHMP5重组蛋白特异性IgG抗体的变化,结果显示,与两个对照组相比,重组蛋白免疫组小鼠的抗体滴度在免疫24 d时即达到较高水平,并在免疫38 d时略有升高至最大值,直到感染后42 d剖杀动物时,抗体一直维持在较高水平(图7)。表明重组CHMP5蛋白具有良好的反应原性。
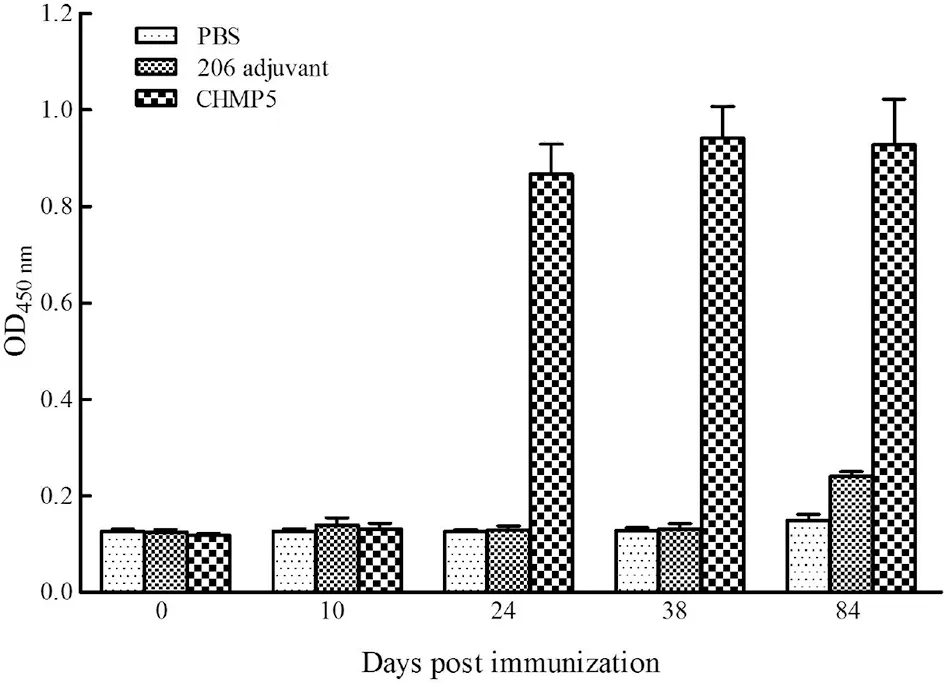
图7 小鼠抗CHMP5重组蛋白特异性IgG抗体水平的ELISA检测Fig.7 ELISA detection of specific IgG antibodies against the recombinant CHMP5 protein in mouse sera
2.8 重组蛋白在小鼠体内诱导的免疫保护效果 重组蛋白免疫组、佐剂对照组及PBS对照组所有小鼠于3免后2周攻击感染尾蚴,42 d后计算减虫率及肝脏减卵率。结果显示,PBS对照组、佐剂对照组、重组蛋白免疫组的小鼠平均荷虫数分别为25.2±6.2、24.5±5.8、19.9±5.4,平均每克肝组织虫卵数分别为88 665±10 894、85 333±10 020、48 660±9 238(图8)。与佐剂对照组相比,重组CHMP5蛋白在小鼠体内诱导了18.96%的减虫率和42.98%的肝脏减卵率,表明该重组蛋白可诱导小鼠产生部分的免疫保护效果。
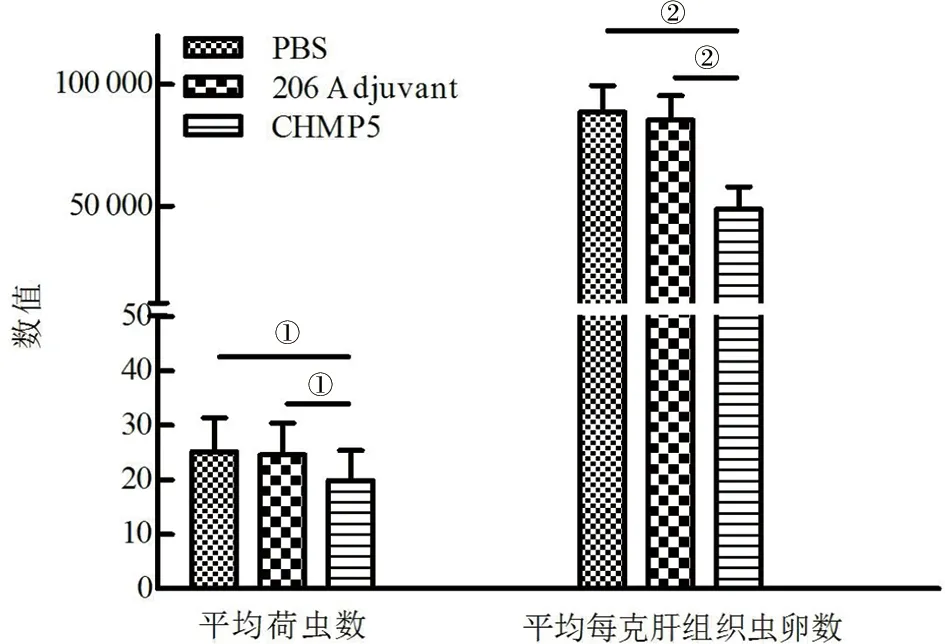
①:P<0.05;②:P<0.01图8 重组CHMP5蛋白在小鼠体内诱导的免疫保护效果Fig.8 Immunoprotective effects induced by the recombinant CHMP5 protein in mice
3 讨 论
辐射致弱的血吸虫尾蚴/童虫疫苗是目前公认最为有效的抗血吸虫感染的免疫原,在小鼠、猪等多种动物体内诱导产生高水平的免疫保护效果,但是由于存在不安全性、虫体来源受限等缺点而无法在现场推广使用[11]。近些年来,国内外的科学家利用分子生物学技术鉴定到一些具有免疫保护性作用的抗原分子,进而推动了基因工程疫苗的发展。其中,埃及血吸虫的Sh28GST以及曼氏血吸虫的Sm14、SmTSP-2和Smp80已经分别进入临床试验[12]。Sh28GST的重组蛋白免疫猴子后,使其膀胱、肝、肠、肺等组织虫卵总数减少50%,尿液和粪便虫卵总数减少77%[13]。Smp80的重组蛋白诱导狒狒产生了93%的减虫率(雌虫)、90%的肝及肠组织总减卵率,使粪便虫卵孵化率降低了81%[14]。体被是血吸虫与宿主血液直接接触的界面,所以普遍认为其与血吸虫营养摄取、免疫逃避、免疫调节、排泄、渗透压调节和信号转导等密切相关[15]。体被蛋白作为生物学功能的承担者,通过对其研究有可能发现新的疫苗候选分子。
在前期围绕S.japonicum体被开展的免疫蛋白质组学研究中,鉴定到了S.japonicumCHMP5,推测该蛋白很可能定位于体被上。在本研究中,利用免疫组化实验进一步证明其为体被蛋白。荧光定量PCR检测结果显示,S.japonicumCHMP5基因在42 d雌虫中的转录水平约是42 d雄虫的3倍。这可能是由于S.japonicumCHMP5通过参与MVBs的形成而参与到营养物质代谢、信号传导等过程[6,8],而42 d雌虫大量产卵需要消耗更多的营养物质,从而引起该基因在42 d雌虫中的转录水平高于42 d雄虫中的转录水平。利用生物信息学技术对S.japonicumCHMP5氨基酸序列进行分析,结果显示,其具有6个B细胞抗原表位,而后者为能有效刺激机体产生特异性抗体的物质基础,提示该蛋白在理论上可能具有良好的反应原性。
重组CHMP5蛋白的理论分子量约为29 kDa,但在SDS-PAGE分析中出现在34 kDa大小的位置,将其纯化产物进行质谱鉴定,结果证明该重组蛋白为S.japonicumCHMP5,推测出现这种问题很有可能是因为该蛋白所带电荷影响了其在SDS-PAGE凝胶上的迁移。以纯化的重组CHMP5蛋白为抗原进行Western blotting分析,结果显示,该蛋白与兔抗日本血吸虫可溶性成虫抗原的免疫血清、小鼠抗CHMP5重组蛋白的免疫血清均能发生特异性的免疫反应,具有较好的反应原性和免疫原性,为该蛋白作为抗日本血吸虫病保护性抗原研究奠定了一定基础。
以小鼠为动物模型进行免疫保护实验,结果表明,重组CHMP5蛋白不仅刺激机体产生了高水平的特异性IgG抗体,还诱导其产生了18.96%的减虫率和42.98%的肝脏减卵率。目前,普遍认为有效的预防性疫苗诱导机体产生的减虫率和减卵率都应达到75%[12]。可以通过更换佐剂或者将多种蛋白的保护性抗原表位串联制成嵌合蛋白等多种方式来提高S.japonicumCHMP5的免疫保护力[16],这为未来的研究提供了思路。
利益冲突:无
引用本文格式:张旻,洪炀,傅志强,等.日本血吸虫带电多泡体蛋白5的生物学特性研究[J].中国人兽共患病学报,2022,38(9):764-770.DOI:10.3969/j.issn.1002-2694.2022.00.120

