小尾寒羊不同生长阶段肌球蛋白与肌球 蛋白重链相关基因的变化
薛宝玲,宋晓彬
(1.内蒙古农业大学职业技术学院,内蒙古 包头 014109;2.乌兰察布市食品药品检验所,内蒙古 乌兰察布 012000)
肌球蛋白是参与肌肉伸缩活动的一种形似“Y”形且具有ATP酶活性的大基团生物活性物质,由2 条肌球蛋白重链(myosin heavy chain,MyHC)和4 条轻链组成。2 条重链分子质量约为210 kDa,大部分空间区域相互缠绕螺旋形成杆状的尾部,4 条轻链分子质量为18~32 kDa,构成“Y”形的头部。肌肉伸缩依靠MyHC参与,MyHC的功能多样性与肌动蛋白的特异性与受到Ca作用时ATP酶活性的功能多样性相关。红肌纤维与白肌纤维都有对应的基因进行翻译编码,Chang等研究表明,MyHC相关基因的特异性表达是骨骼肌肌纤维进行相应分型的依据。
不同的MyHC进行转录时都有相对应的基因进行编码,研究证实,骨骼肌肌纤维依据MyHC相关基因的特异性表达分为Ⅰ型、Ⅱa型、Ⅱb型和Ⅱx型。本研究采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDSPAGE)法分离1~18 月龄小尾寒羊股二头肌中MyHC异构体,利用实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术测定MyHC相关基因mRNA的相对表达量并分析其与肌球蛋白含量之间的相关性,旨在为提高肉品质和农畜产品的深度加工所需参数提供有效数据支撑,为自然放牧条件下小尾寒羊的最佳育肥月龄提供参考。
1 材料与方法
1.1 材料与试剂
取自然放牧条件下的1~18 月龄小尾寒羊股二头肌作为研究对象(=3)。将股二头肌迅速分装,保存于无酶无菌EP管中避免肌纤维受到破坏,液氮快速冷冻, -80 ℃保存以备后续实验测定使用。
核酸染料 北京擎科生物科技有限公司;反转录试剂盒 宝生物工程(北京)有限公司;牛血清白蛋白(bovine serum albumin,BSA)、四甲基乙二胺 上海浦予工业科技有限公司;SDS 河南派广化工有限公司;-巯基乙醇 上海至吉生化科技有限公司;过硫酸铵 邯郸市丛台区少杰化工有限公司;考马斯亮蓝G-250 合肥健砷化工有限公司;丙烯酰胺 天津西典化学科技有限公司。
1.2 仪器与设备
CX31光学显微镜 上海惠诚生物科技有限公司;MS-H-S磁力搅拌器 信钰仪器(北京)有限公司;FSH-2A匀浆机 济南童鑫生物科技有限公司;TD5A台式离心机 常州金坛良友仪器有限公司;DYY-6C稳流恒压电泳仪 济南欧莱博科学仪器有限公司; LB-E05050电子天平 苏州卡吉德化学科技有限公司;LHS-80HC-1恒温恒湿箱 济南思明特科技有限公司;TU-1810紫外-可见分光光度计 武汉鑫九星电子科技有限公司;ZT-288凝胶成像仪 上海金鹏分析仪器有限公司;CFX96TM实时荧光定量PCR仪 美国Bio-Rad 公司;WSB-18恒温水浴振荡器 北京汉达森机械技术有限公司。
1.3 方法
1.3.1 肌球蛋白的提取
参考Light等方法进行提取。取1.5~2.0 cm肌肉组织,去掉结缔与脂肪组织并切碎。称取15 mg切碎的肌肉组织,加入750 μL蛋白准备液(pH 6.8、0.05 mol/L KPO),3 000 V、0.3 s匀浆5 次,4 ℃静置50 min,3 000 r/min离心15 min后取上层液体,4 ℃保存备用。
1.3.2 肌球蛋白含量的测定
采用BCA法测定肌球蛋白含量。准确称取所需用量的BSA,保存备用。分别称取10 g BCA二钠盐、20 g无水NaCO、1.6 g NaCHO、4 g NaOH与9.5 g NaHCO混合,定容至1 L。液体混合均匀后pH值调至11即为BCA法A溶液;4 g CuSO定容至100 mL即为BCA法B溶液。BCA法A溶液与B溶液按照体积比49∶1充分混匀后配制成BCA法工作液C。标准品(400 μg/mL BSA溶液)与工作液C等体积混匀,置于35 ℃恒温恒湿保存50 min。
根据表1的比例进行配制,以BSA含量作为横坐标(),测得的作为纵坐标(),绘制标准曲线,方程为=0.025 6+0.137 7(=0.990 3),表明与BSA含量的相关性良好。根据所测标准品与样品的及标准曲线方程计算出样品的肌球蛋白含量。

表1 肌球蛋白含量测定标准曲线的绘制Table 1 Preparation of standard curve for quantitative analysis of myosin
1.3.3 SDS-PAGE分离MyHC异构体
参考Light等的方法。配制样品缓冲液、下槽缓冲液、上槽缓冲液、分离胶与浓缩胶;2×样品缓冲液与提取得到的上清液按照体积比1∶2混合均匀配制为样品溶液,振荡45 s,煮沸5 min,4 ℃、13 000 r/min离心10 min,样液终质量浓度10~110 ng/μL;下槽缓冲液注入下槽,上槽缓冲液注入上槽,4 ℃条件下用微量进样器在胶孔中按顺序注入25 μL样液;接通电源,调节层析柜温度始终保持4 ℃,电泳仪140 V电压进行SDS-PAGE,至蓝色移动条距离凝胶板底部2 cm位置时停止电泳;染色时间为1.5 h,脱色液定时更换至染色凝胶清晰,取下凝胶板。
1.3.4 骨骼肌总RNA的提取
参考TRIzol法,快速研磨肌肉组织,随时补充液氮使其始终处于冷冻状态,取300~500 mg备用,将100~150 mg样品组织放入1.5 mL灭酶灭菌EP管中低温放置12 min;4 ℃、3 000 r/min离心8 min取上清液,加入约为其体积20%的氯仿,强烈混匀20 s,20 ℃静置至无分相沉淀产生;4 ℃、3 000 r/min离心20 min,保留上清液,加入与其等体积的异丙醇于灭酶灭菌管中,20 ℃保存20 min;4 ℃、3 000 r/min离心15 min弃上清液,下层沉淀即为白色胶状RNA,加入1 mL灭酶灭菌水配制的体积分数75%乙醇溶液,上下颠倒洗涤沉淀;4 ℃、3 000 r/min离心8 min弃上清液;反置于20 ℃下干燥;加入30~60 μL灭酶灭菌水溶解凝胶沉淀至完全溶解, -80 ℃放置;取10 μL RNA溶液与4 μL试剂盒缓冲液混匀,测定总RNA质量,对其含量进行判定;根据样品RNA的OD/OD值,将其质量浓度调整为500 ng/μL。
1.3.5 反转录与引物合成
利用反转录试剂盒合成c D N A第1链;按照、、和4 种基因的核苷酸序列,应用Primer Premier软件进行分析,由博览特生物技术有限公司进行引物的设计和合成。
1.3.6 实时荧光定量PCR
利用实时PCR系统进行实时荧光定量PCR扩增。以反转录的cDNA为模板,看家基因为内参,每个样品进行3 个重复。实时荧光定量PCR反应总体系为50 μL,其中:灭菌ddHO 17 μL、cDNA模板4 μL、上游引物 (1 μmol/L)2 μL、下游引物(1 μmol/L)2 μL、SYBR Premix ExII(2×)25 μL。采用两步法PCR反应程序:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,共40 个循环。采用2法计算基因相对表达量。
1.4 数据处理
使用SAS 9.4软件进行数据分析,结果用平均值±标准差表示,方差分析采用PROC ANOVA程序,多重比较采用Duncan程序,相关性分析采用Proc Corr程序。
2 结果与分析
2.1 股二头肌中肌球蛋白含量测定结果
由表2可知,1~9 月龄小尾寒羊股二头肌中肌球蛋白含量呈现上升趋势,且1~6 月龄间差异显著 (<0.05),6~12 月龄肌球蛋白含量差异不显著,在9 月龄达到峰值,肌球蛋白含量与吸光度总体呈现线性规律。

表2 1~18 月龄小尾寒羊股二头肌的肌球蛋白含量Table 2 Content of myosin in the Biceps femoris muscle of Small Tailed Han sheep aged from 1 to 18 months
2.2 SDS-PAGE分离MyHC
Ⅱa、Ⅱx、Ⅱb与Ⅰ型的MyHC主要是由其所在的基因所决定的。Ⅱa、Ⅱx、Ⅱb与Ⅰ型的MyHC分子质量有所差异,通过SDS-PAGE将Ⅱa、Ⅱx、Ⅱb与Ⅰ型的MyHC进行分离。通常情况下,不同类型基因的特异性表达与不同类型的肌纤维之间存在相互对应关系,不同基因之间也存在相互转化关系,这也是导致Ⅱa、Ⅱx、Ⅱb与Ⅰ型MyHC之间相互转化的诱导因素。由图1可知,分离出MyHC中的4 种类型,这一结果与本团队前期ATPase组织化学染色结果相一致,表明小尾寒羊股二头肌中存在上述类型的MyHC。Ⅱa、Ⅱb型的MyHC条带较Ⅱx型的MyHC略为清晰,是由于Ⅱx型MyHC属于中间型MyHC,易于转化。

图1 1~18 月龄小尾寒羊股二头肌肌球蛋白异构体SDS-PAGE图Fig. 1 SDS-PAGE profile of myosin heavy isoforms in Biceps femoris muscle of Small Tailed Han sheep aged from 1 to 18 months
2.3 骨骼肌中总RNA含量和纯度及质量检测
由表3可知,3~12 月龄小尾寒羊股二头肌OD/OD差异不显著,1~3 月龄与12~18 月龄之间差异显著 (<0.05),并且呈现先增加后降低的趋势,在3 月龄达到最大。1~18 月龄样品的OD/OD为1.8~2.0,表明总RNA在后续实验中可被继续使用。
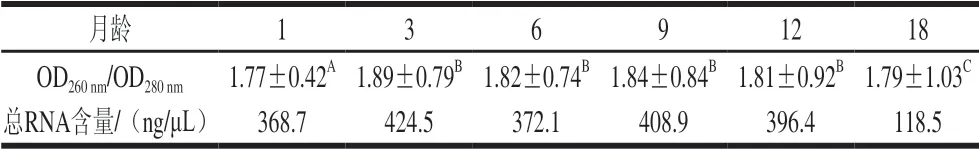
表3 1~18 月龄小尾寒羊股二头肌OD260 nm/OD280 nm及总RNA含量Table 3 OD260 nm/OD260 nm and total RNA content in Biceps femoris muscle in Small Tailed Han sheep aged from 1 to 18 months
2.4 MyHC相关基因PCR产物扩增结果
由图2可知,普通实时荧光定量P C R扩增出的基因长度为200 bp、基因长度为284 bp、型基因长度为216 bp、型基因长度为165 bp,看家(内参)基因长度为233 bp。与Marker进行比对得出,Ⅱa、Ⅱx、Ⅱb与Ⅰ型基因长度与预计相一致,并且没有其他条带,说明Ⅱa、Ⅱx、Ⅱb与Ⅰ型基因片段出现明显的特异性扩增条带,基因引物的特异性良好,满足后续的反转录实验精度要求。

图2 实时荧光定量PCR产物琼脂糖凝胶电泳图Fig. 2 Agarose gel electrophoresis of real-time PCR amplified products
2.5 股二头肌实时荧光定量PCR

图4 MyHC基因实时荧光定量PCR溶解峰Fig. 4 Real-time PCR melting peaks of MyHC gene
由图3~4可知,实时荧光定量PCR扩增曲线达到所设阈值范围,溶解曲线说明、、、和基因序列都是单一峰值,各引物特异性良好,没有出现非特异性扩增并且没有产生引物二聚体。表明实验结果所得的相对表达量分析数据可信。
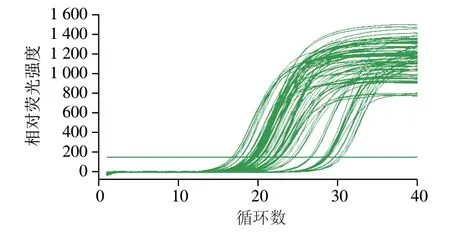
图3 MyHC基因实时荧光定量PCR扩增曲线Fig. 3 Real-time PCR amplification curve of MyHC gene
由表4可知,小尾寒羊股二头肌基因总体呈现随着月龄的递增相对表达量稳步递减的趋势,1~18 月龄中两端月龄分别为最高值与最低值。基因总体呈现随着月龄的递增相对表达量先降低后增加的趋势,差异均显著(<0.05),12 月龄为最高值,6 月龄为最低值。基因的相对表达量与基因总体呈现出相反的趋势,随着月龄的增加逐渐增加,1~18 月龄中两端月龄分别为最低值与最高值。基因相对表达量总体上差异均显著,12 月龄为最高值,9 月龄为最低值。基因相对表达量测定结果与SDS-PAGE结果一致。总体上看,随着月龄的增加,小尾寒羊股二头肌中、基因的相对表达量高于基因。

表4 1~18 月龄小尾寒羊股二头肌MyHC基因相对表达量Table 4 Relative expression levels of MyHC gene in Biceps femoris muscle during one to 18 months of age
3 结 论
随着1~18 月龄的变化,小尾寒羊股二头肌中基因的相对表达量与同月龄时肌球蛋白含量变化规律一致。小尾寒羊股二头肌中基因相对表达量高于基因,基因相对表达量低于基因和基因相对表达量之和,与前期研究肌纤维含量变化相一致。基因相对表达量在6~9 月龄变化范围较大,9~12 月龄变化范围较小,6~9 月龄生长缓慢,9~12 月龄生长较快。肌球蛋白含量可能是由于1~18 月龄小尾寒羊在天然放牧条件下由于受自然条件的变化发生变化。小尾寒羊自身发育时,可能由于品种、部位、外界饲养条件、营养因素区别等,导致骨骼肌中不同肌纤维类型之间能够相互转化。通过实时荧光定量PCR测定MyHC相关基因mRNA的相对表达量可以确定股二头肌中不同类型肌纤维,本实验所用到的分析方法是建立在分子水平上,因此用到的实验样品较少却能反映出样品的整体情况,在遗传育种、饲养等实践中有广泛的应用和潜在的价值。

