QuEChERS-LC-MS/MS法测定干制红枣中多菌灵的残留量
曾敏 杨晋青 俞晓琴 陈慧*
(1.浙江五芳斋实业股份有限公司; 2.上海市质量监督检验技术研究院)
0 引言
红枣作为一种具有中国特色的水果,有着很好的营养与药用价值,一直被开发和研究。随着近年来红枣栽培面积的扩大,其生长过程中病虫害的发生率也不断增加,而且由于其果皮质地脆嫩,采收后需经贮藏、干燥、晾晒、加工等干制过程,极易感染细菌而引起腐烂变质。为了保证红枣产量,枣农会适时喷洒农药。
多菌灵为一类广谱剂农药,对人、畜均低毒。对许多作物的病害都有一定防治效果,可进行叶面喷洒、播种与土壤处理等,因此也常作为防治红枣病害的农药。GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》规定:多菌灵在枣(鲜)中的最高残留限量为0.5 mg/kg、检测方法标准为GB/T 20769—2008《水果和蔬菜中450种农药及相关化学品残留量的测定 液相色谱-串联质谱法》和NY/T 1453—2007《蔬菜及水果中多菌灵等16种农药残留测定 液相色谱-质谱-质谱联用法》。但是对于干制红枣却缺乏具体的质量限量规定和具体的测定办法,仅认为干制水果可以依据GB/T 20769和NY/T 1453所规定的办法检测。随着干制红枣在红枣产业中的比重越来越大,农药残留问题也应该引起重视。为了保障红枣质量,最大限度地减少农药残留对人类生活的影响,亟需开发高效、准确的检测方法。
目前的检验技术手段有气质联用法(GC-MS)、气相色谱法(GC)、液相色谱法(HPLC)、液质联用法(HPLC-MS)和红外光谱法等,前处理技术大多采用固相萃取技术,但前期处理费时而且操作较复杂、所产生主要问题重现性差和回收率较低。此外,由于干制红枣中糖分含量较高,有机溶剂的提取效率和准确度均较低。“QuEChERS”算法由于具备快捷、简便、经济、有效、平稳、安全可靠等优势,越来越多地运用于农产品的农药残留检测。为有效监测干制红枣中多菌灵的存在状况,本方法利用了“QuEChERS”的前处理工艺,并结合液相色谱-串联质谱法的监测手段,通过比较不同“QuEChERS”净化包的净化效率,建立了干制红枣中多菌灵的残留检测方法,为多菌灵在干制红枣上的残留检测提供技术支持。
1 材料与方法
1.1 材料与试剂
氯化钠(分析纯);超纯水;乙腈(色谱纯);QuEChERS萃取盐包(含无水硫酸镁6 g 和乙酸钠1.5 g);QuEChERS专用净化管A(15 mL离心管中装MgSO1200 mg、乙二胺-N-丙基硅烷400 mg)、QuEChERS专用净化管B(15 mL离心管中装MgSO1200 mg、PSA 400 mg、十八烷基键合相硅胶 400 mg)、QuEChERS专用净化管C(15 mL离心管中装MgSO1200 mg、PSA 400 mg、C18 400 mg,石墨化碳黑45 mg);Carbon/NH专用固相萃取柱(500 mg,6 mL)。标准品:多菌灵(纯度不低于98.0%,100 μg/mL)。
1.2 仪器与设备
液相色谱仪;串联质谱仪;其他设备包括涡旋多空共混器;超声清洗仪;氮吹浓缩仪;离心机;0.22μm有机相滤膜。
1.3 实验方法
色谱柱:3 μm,2.1 mm×100 mm,柱温为:35 ℃;建议进样量:2 μL;流动相:乙腈和0.1%甲酸水溶液,梯度洗脱的条件见表1。
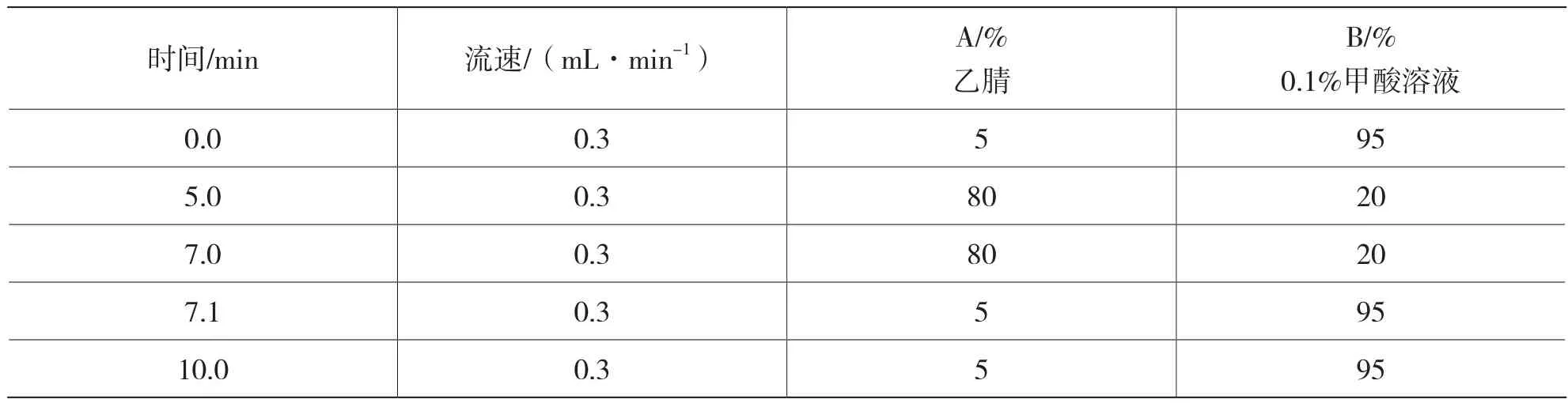
表1 梯度洗脱表

表2 多菌灵的质谱分析参数
准确称取共计约5 g粉碎、混匀的干制红枣样品,精确至0.01 g,将其置于塑料离心管(50 mL)中,先加入超纯水约10 mL,涡旋混匀,静置10 min,再准确量取加入乙腈 20 mL,马上涡旋、振荡混匀,超声处理15 min,在其中加入无水硫酸镁6 g和 乙酸钠1.5 g,立即涡旋、振荡混匀,9 000 r/min离心1 min。准确移取10 mL上层乙腈相于装有1200 mg硫酸镁、400 mg PSA、400 mg C18粉末的离心管中,立即涡旋振荡2 min,再置于9000 r/min离心1 min后静置,取上层清液用0.22 μm滤膜过滤于进样瓶中,上机测定。
多菌灵标准工作溶液的配制方法为:量取适量浓度为100 μg/mL多菌灵标准品,使用乙腈配制1.0 μg/mL的标准工作溶液。
多菌灵标准曲线工作溶液的配制方法为:精确移取适量的多菌灵标准工作使用液,用乙腈稀释后成标准浓度为2.5 ng/mL、5.0 ng/mL、10.0 ng/mL、20.0 ng/mL、50.0 ng/mL、100 ng/mL的标准曲线工作溶液。
红枣基质工作曲线溶液的配制方法:将空白试样按样品处理方式进行处理,以获得工作净化液。精确量取适量的多菌灵标准工作溶液,用该工作净化液稀释成浓度为2.5 ng/mL、5.0 ng/mL、10.0 ng/mL、20.0 ng/mL、50.0 ng/mL、100 ng/mL的红枣基质工作曲线溶液。
2 结果与分析
2.1 仪器采集条件的确定
本实验通过ESI源以及MRM模式对多菌灵进行研究。将1 μg/mL的标准工作溶液以流动注入的形式注入离子源,然后采用ESI正离子或负离子的模式开展全扫描,扫描后得知多菌灵在ESI正离子模式下响应值更高,于是选择采用正离子数字化扫描,以确认母离子质荷比为 192。同时,通过优化检测条件(如喷雾电压、雾化压力、干燥气压)及去簇电压,确保母离子的丰度和稳定性最优化,获得最优的去簇电压;在Product模式下,选择对母离子响应最高的子离子2 个分别为定量子离子和定性子离子。接着在MRM采集模式下,分别对子离子的相互碰撞能量加以优化,得到各自最优的碰撞能量,建立MRM采集方法。图1为多菌灵MRM定量离子色谱图。

图1 多菌灵标准溶液的MRM定量离子色谱图
采用2.1 mm×100 mm, 3 μm色谱柱,分别对比了水和乙腈,含甲酸水溶液(0.1%)/乙腈和含甲酸水溶液(0.1%)+5 mmol/L乙酸铵溶液/乙腈为流动相时的色谱的分离情况特点。含甲酸(0.1%)的流动相离子化分离时效果好,且灵敏度较高。在流动相中添加入乙酸铵溶液则可以优化色谱峰形,但灵敏度也会下降;另外,因为进样体积比较小,在流动相中如不加入乙酸铵溶液,多菌灵的色谱峰形和保留时间都较为理想。因此,选取了乙腈和含甲酸水溶液(0.1%)的流动相,在1.3.1色谱条件下,进行了梯度洗脱实验。在柱温(35 ℃)和流速(0.3 mL/min)条件下,进样量为2 μL时,可获得干制红枣样品基质中多菌灵检测结果的稳定和优异的分离效果。
2.2 样品前处理条件的确定
本实验比较了干制红枣加水浸润与否对提取效率的影响。称取样品后,根据样品自身含水量的多少,在加入提取溶剂之前首先加入10 mL纯水以充分浸润样品。浸润10 min,涡旋1 min后,再加入提取溶剂进行提取实验,结果见图2。实验结果表明,充分浸润样品后,目标物的提取效率明显增加。由于样品含糖量较高,若不经过加水充分浸润,直接加入提取溶剂容易造成样品结团,导致目标物难以被充分提取出来,导致提取效率很低。
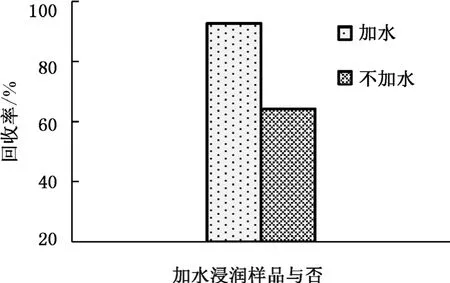
图2 加水浸润样品对提取效率的影响
本实验以乙腈和1%乙酸乙腈溶液作为萃取试剂后开展对比试验,对待测样品中多菌灵的加标萃取效果,结果见图3。图3表明,乙腈和乙酸乙腈(1%)溶液作为萃取试剂后的平均回收率分别为95.1%、74.4%,因此,乙腈的萃取效率相对较好。因多菌灵其本身为一种两性物质,其水解度受pH值波动的影响很大。在酸性环境下,多菌灵易溶于水,多菌灵在中性和偏碱性水溶液中其水溶性变化较小,多菌灵更容易被化学有机溶剂萃取。故确定乙腈作为萃取试剂。
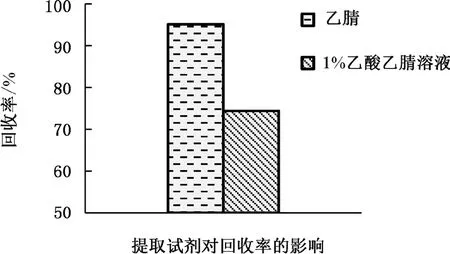
图3 不同萃取试剂的回收率
本实验比较了超声辅助提取时间对多菌灵回收率的影响。选择的基质为干制红枣等空白样品,多菌灵的加标浓度为10 μg/kg。考察在5 min、10 min、15 min、20 min等各种超声的时间下,多菌灵的回收率,结果见图4。图4表明,超声提取10 min时多菌灵回收率达最高,随着超声持续时间的继续增加,多菌灵回收率呈现明显下降趋势,究其原因可能由于杂质成分被萃取出来使得多菌灵核心目标物的离子化效率减低,导致总回收率有所降低。基于以上情况,本试验采用超声辅助处理10 min。
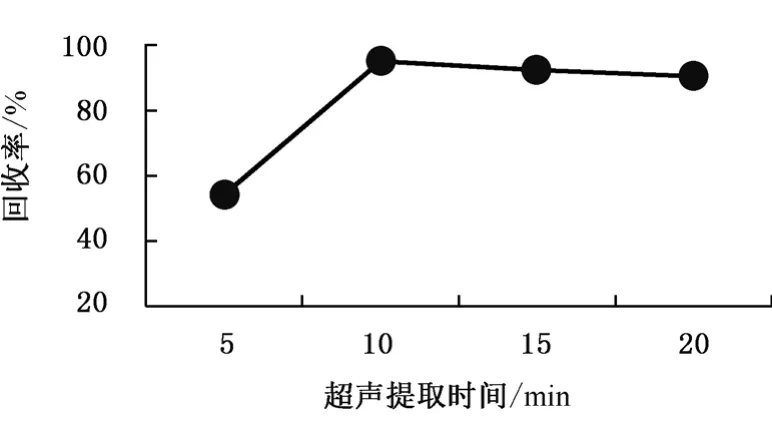
图4 不同超声提取时间的回收率
本实验对比了QuEChERS不同类型的净化包对多菌灵回收率的效果。取含有浓度为10 ng/mL多菌灵的干制红枣工作曲线溶液,对含有不同类型净化剂的3个QuEChERS净化包和1个固相萃取柱(具体成分见1.1)进行处理效果净化比较,处理后的平均回收率结果见表3。实验结果显示,在各种净化方式中,多菌灵的回收率分别为88.6%、96.7%、67.3%和62.4%。净化包B的最终回收率最高;但净化包A、净化包C和萃取柱D的最终回收率相对较低。主要是因为净化包A中不含有C18吸附剂,因此去杂效果并不理想,对基质干扰过多而产生的回收率也较低;而净化包C中含有石墨化炭黑,因此可以对具有平面结构的农药产生很大的吸收效果,在去除杂质的同时对多菌灵也产生了不同程度的吸附,使得回收率较低;而萃取柱D的操作则较为繁琐,去除红枣中所含的极性有机酸、大量糖类等元素的作用并不明显,同时也会受洗脱次数的影响使得回收率也较低;最后,通过移取10 mL提取液到含有1200 mg MgSO、400 mg PSA、400 mg C18粉末的净化包B来净化并除去提取液中的杂质组分,进而达到了对干枣样品的净化除杂并降低基质干扰的效果。

表3 经不同种类净化方式处理后的回收率
2.3 线性范围和基质效应
本实验采用标准工作溶液在1.3规定的试验条件下开展测定,以多菌灵标准溶液质量浓度为横坐标,峰面积为纵坐标,绘制多菌灵的工作标准曲线,按公式 (1) 计算基质效应(ME),多菌灵溶液的标准曲线工作溶液和红枣基质工作曲线溶液(1.3.4)的线性方程见表4。在2.5 ng/mL~100 ng/mL的范围内线性关系良好,相关系数大于0.995。同时具有良好的基质抑制效应。
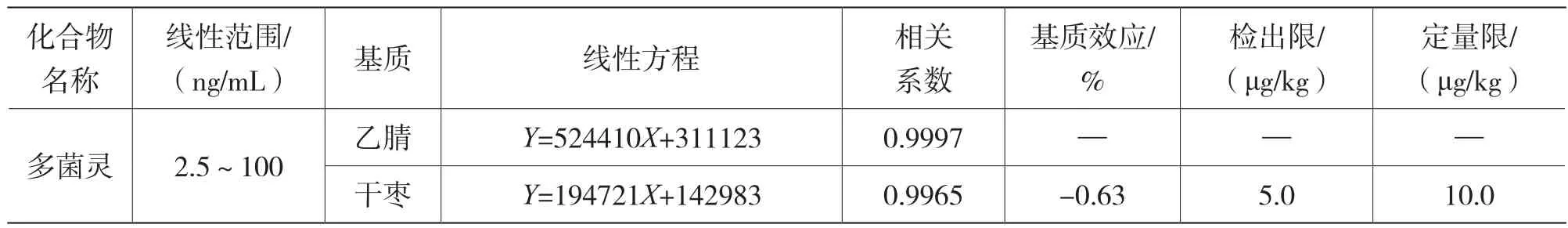
表4 多菌灵的线性范围、线性方程、相关系数、基质效应、检出限及定量限
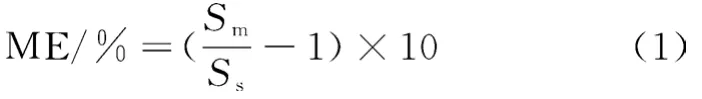
式中,和分别表示基质工作曲线溶液和标准曲线工作溶液的斜率。当ME>0时,说明为基质增强效应;ME<0,说明为基质抑制效应。
2.4 方法的检出限和定量限
在空白样品基质内添加相应含量的标准工作溶液,在2.3的试验条件下进行测试,按信噪比等于3计算该方法检出限,按信噪比等于10计算该方法定量限,结果见表4。多菌灵在干制红枣基质中的检出限为5.0 μg/kg,定量限为10.0 μg/kg。
2.5 方法的回收率和精密度
在不含多菌灵的阴性干制红枣样本中添加3个标准水平(10.0 μg/kg、20.0 μg/kg 和 100 μg/kg)的标准工作溶液,静置30 min,按以上样品处理方式进行检测,每个加入水平重复测定6 次,计算多菌灵标准工作溶液加入后其回收率及相对标准偏差(RSD)(=6),测定结果见表5。表5表明,多菌灵在干制红枣中平均回收率为86.9%~109.1%,RSD为3.01%~7.27%,以上说明该检测技术的回收率良好、重复性较好。

表5 多菌灵在3个添加水平下的平均回收率及其RSD值(n=6)
2.6 实际样品检测结果
采用本试验所建立的方法对10批次干制红枣样品进行多菌灵的检测,其中有2个样品检出多菌灵残留,含量分别为 28.4 μg/kg 和 41.1 μg/kg。
3 结语
本研究利用QuEChERS-LC-MS/MS检测技术,在优化样品前处理和仪器采集条件的基础上,建立了一种高效准确、灵敏度高和重现性好的测定干制红枣中多菌灵残留量的检测方法。用乙腈超声辅助提取干枣样本中的多菌灵,经QuEChERS包净化,净化液采用0.22 μm滤膜过滤,使用液相色谱-串联质谱仪(LC-MS/MS)检测。选用Waters Atlantis T3 C18(3 μm,2.1 mm×100 mm) 色谱柱进行分离处理,电喷雾离子化、正离子扫描及动态多反应监测模式检验,最终通过基质工作曲线外标法进行定量。多菌灵在2.5 ng/mL~100 ng/mL范围内线性关系良好,相关系数为0.9965。3个多菌灵添加水平的平均回收率为86.9%~109.1%,RSD为3.01%~7.27%,定量限为10.0 μg/kg。该方法能够很好解决实际干制红枣产品对多菌灵残留量的检测需求。

