西北地区大蒜及其野生蒜SSR-PCR体系优化及引物筛选
李守明, 史荣梅, 李辉玲
(1.石河子农业科学研究院,新疆石河子 832000; 2.新疆埃乐欣药业有限公司,新疆乌鲁木齐 830000;3.巴音郭楞蒙古自治州农业科学研究院,新疆库尔勒 841000)
大蒜(L.)别称胡蒜,属于百合科(Liliaceae) 葱属()中重要的蔬菜植物,素有“植物黄金”之称,大蒜精、深加工品已经产业化,走俏欧洲、美国。大蒜栽培历史悠久,最早在地中海沿岸国家栽培,后由张骞从西域引入我国陕西关中地区,随后大面积种植,为适应特殊的地理环境,在长期栽培中形成了不同的生态型地方品种,其中我国四大名蒜之一就是位于天山北坡吉木萨尔的绿嘴白皮蒜。有效利用大蒜种质资源并对其变异性进行精准评价,单靠极易受环境影响的形态特征来评价物种多样性难度极大,不能全面反映大蒜资源的真实状况,加上长期无性繁殖导致品种退化严重、相互引种导致背景资料缺乏等势必造成选育和推广工作滞后等生产问题发生。
近年来,分子标记技术被广泛应用于物种亲缘关系、品种纯度鉴定及遗传多样性分析等辅助育种领域。基于转录组数据开发的简单重复序列(SSR)标记研究鲜有报道,因此笔者试图建立适宜西北地区大蒜及其野生蒜的SSR-PCR分子标记体系,对影响试验结果的主要因素进行优化,以期为后期的种质鉴定、遗传多样性分析及构建图谱等分子标记辅助育种工作提供参考依据。
1 材料与方法
1.1 供试材料
供试25份大蒜种质资源分别由巴音郭楞蒙古自治州农业科学研究院特色作物室、新疆维吾尔自治区农业科学研究院园艺所收集、提供(表1),分别于2021年4月初种植于巴音郭楞蒙古自治州农业科学研究院试验田内,常规田间管理。每份资源取叶片200 mg左右,利用天根生化科技(北京)有限公司生产的新型植物基因组DNA提取试剂盒抽提大蒜的DNA。个别未出苗资源以鳞茎作为材料,利用传统的十六烷基三甲基溴化铵(CTAB)手提法提取DNA。提取的25份大蒜DNA在140 V恒压下,用1%琼脂糖凝胶电泳检测15 min,用凝胶成像系统检测并拍照。另用核酸测定仪(NanoDrop-1000)测定质量及浓度,记录数据后,于-80 ℃保存备用。

表1 25份大蒜种质资源信息
1.2 引物设计与合成
综合参照Barboza等的研究,共设计50对引物,送生工生物工程(上海)股份有限公司进行合成。
1.3 SSR-PCR扩增体系正交试验
本着节约成本并获得最佳扩增效果的目的,试验采用总体积为10 μL的体系,引物浓度、模板DNA用量和2×PCR Mix添加量按L(4)正交表设计试验(表2),总计16次试验。扩增程序设定为94 ℃预变性3 min;94 ℃变性30 s,不同引物最佳退火温度退火45 s,72 ℃延伸90 s;30次循环的最后1次循环 72 ℃ 延伸设为10 min,4 ℃保存扩增产物。
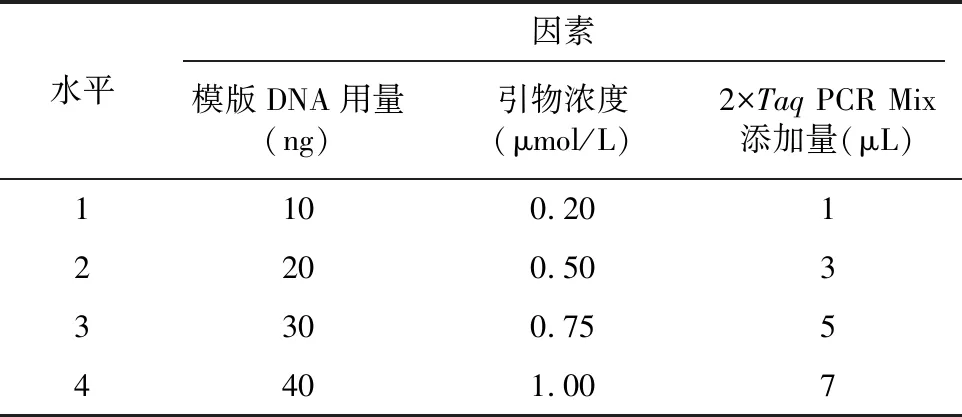
表2 SSR-PCR扩增体系正交试验设计
1.4 退火温度和循环数优化
不同引物最适退火温度()值不同,为提高扩增效果并尽可能考虑到每对引物的最适,采取引物报告单的上、下游引物退火温度的平均值设定。以SSR7为引物,结合上述扩增效果最优参数配比,对循环数进行单因素试验优化,以6份生物学性状差异较大、亲缘关系较远的大蒜模板DNA为小群体,设置梯度为20、25、30、40次循环。观察电泳图,选择扩增效果好且条带清晰的循环数。
1.5 电泳检测
采用6.0%的非变性聚丙烯酰胺凝胶检测扩增结果,电泳仪参数设置:200 V恒定电压,80 min。结束后小心拆胶,用银染法显色至条带清晰可辨,在医用胶片观察灯下拍照。参考尚小红等对扩增结果的直观分析法进行打分,打分依据:1~4分表现为清晰条带少、杂带多、重复性差、背景模糊,5~8分表现为清晰条带多、有杂带、重复性好、背景比较干净,9~12分表现为清晰条带多、无杂带、重复性好、背景清晰,13~16分表现为清晰条带多、亮度强、无杂带、重复性好、背景清晰。通过Excel表分析16个组合的均值()和极差(),从而选择最佳因素配比。
1.6 体系稳定性检测及引物筛选
以6份生物学性状差异较大、亲缘关系较远的大蒜材料为模板,利用优化后的最佳SSR-PCR反应体系和循环数,对50对SSR引物进行筛选,最终筛选出条带清晰可辨、稳定性良好的引物作为大蒜材料SSR标记多态性分析的候选引物。
2 结果与分析
2.1 DNA模板的检测
用1%琼脂糖凝胶电泳检测其中14份大蒜材料DNA的质量,具体如图1所示,可以看出,条带整齐一致、带型清晰,材料间DNA浓度较为均匀。核酸检测仪测定结果显示,所提DNA的/位于1.85~2.0之间,浓度为61~193 ng/μL。
2.2 SSR-PCR扩增体系的优化
扩增结果是PCR体系内各因素相互之间综合作用产生的,正交试验16个处理的扩增结果如图2所示,可以看出,各个因素的浓度组合不同,扩增效果表现出明显的差异。越大,说明该因素对扩增效果优劣影响越大,越大,说明该水平下的扩增效果越好。通过对结果进行评价和数据分析(表3)得出:各因素对SSR-PCR体系扩增结果的影响程度依次为模板DNA用量、引物浓度、2×PCR Mix添加量。模板DNA用量为30 ng时效果最好,引物浓度为0.75 μmol/L时效果最好;2×PCR Mix添加量为3 μL时最好。但引物浓度的k与k相差不大,且考虑到条带的清晰程度,10 μL反应体系以30 ng模版DNA、0.5 μmol/L引物、5 μL的 2×PCR Mix添加量为最佳组合。
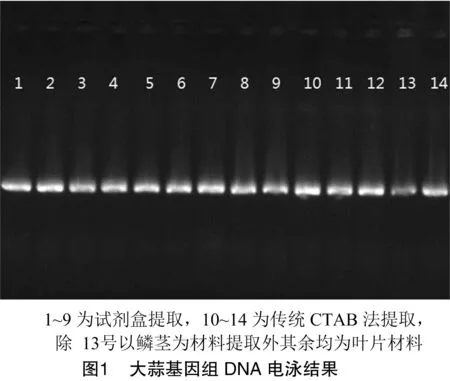

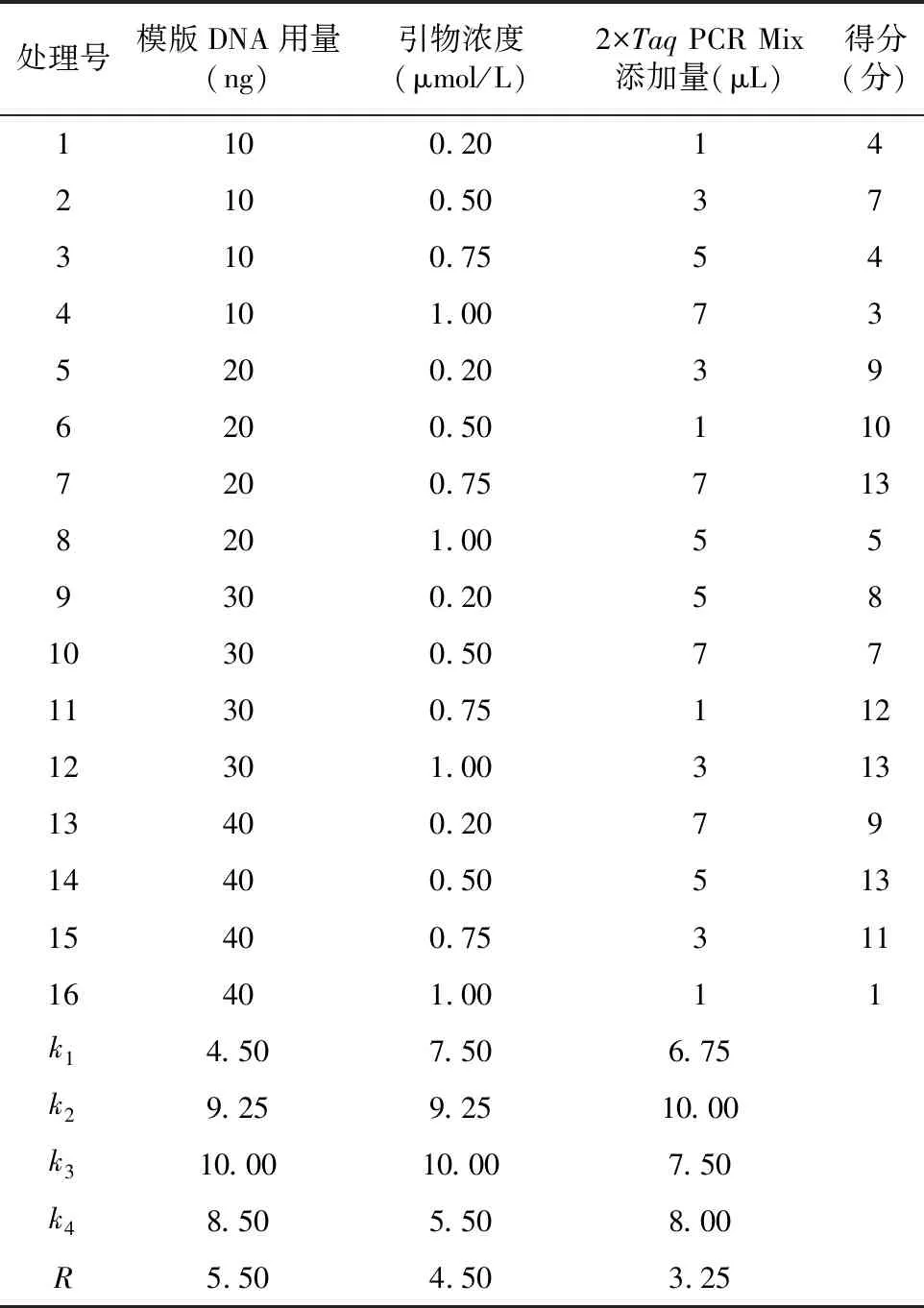
表3 建立SSR-PCR反应体系的正交试验设计表及结果
2.3 循环数的优化
当循环数为20、25次时,扩增结果谱带模糊;当循环数达到30、40次时扩增谱带清晰易辨。综合考虑扩增结果质量及总PCR反应时长,最终设定最佳循环数为30次(图3)。
2.4 引物筛选
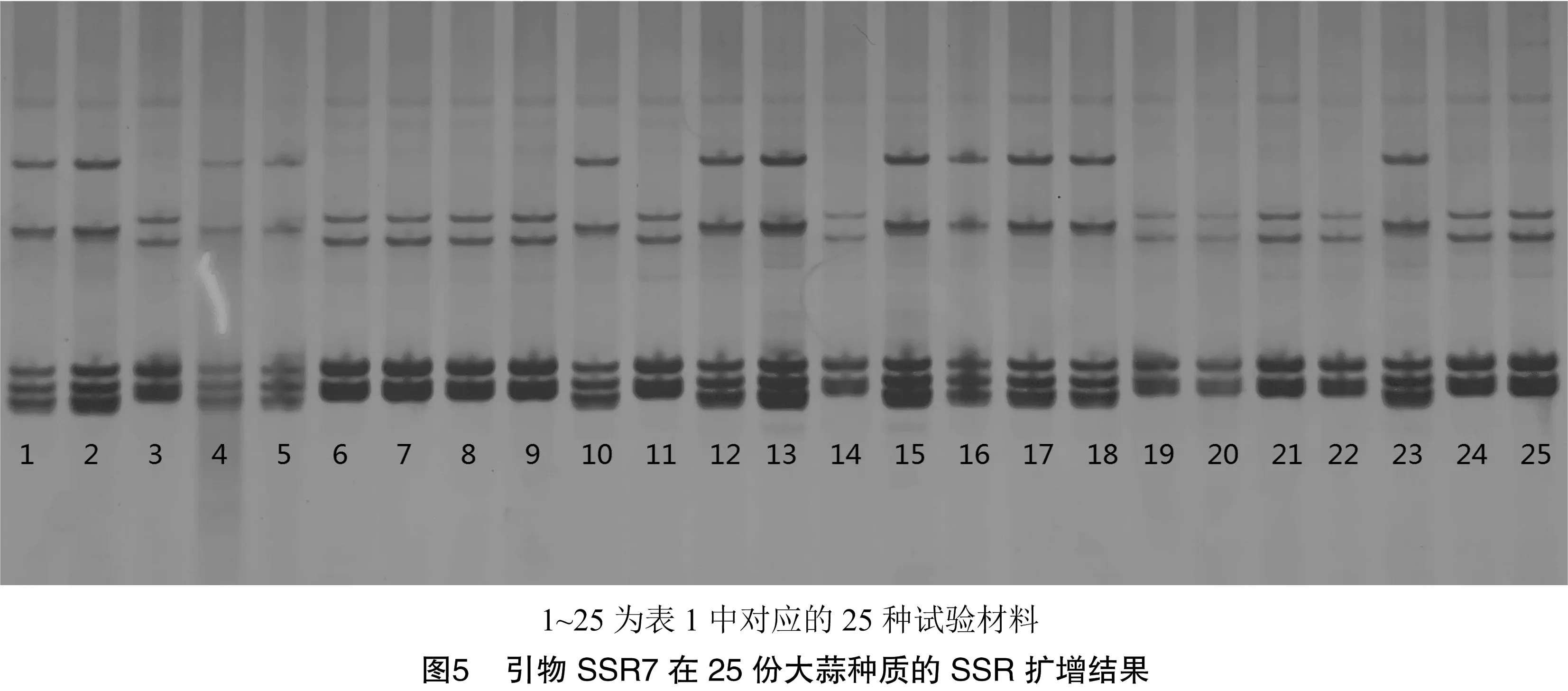
以6份生物学性状差异较大、亲缘关系较远的大蒜DNA基因为模板组成小群体筛选,从50对SSR通用引物中最终筛选出13对有效引物(图4、表4)。图5为引物SSR7在25份大蒜材料中的SSR扩增结果。
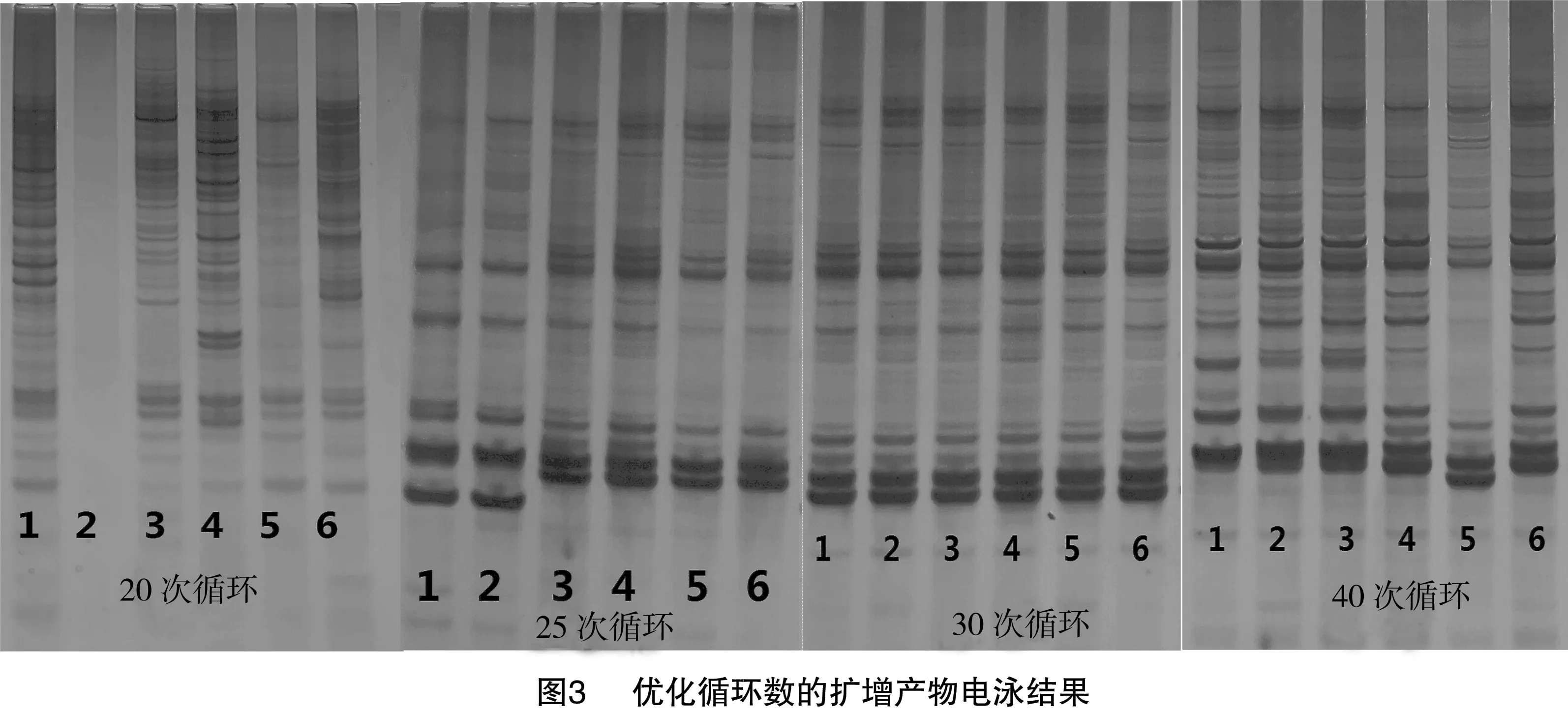
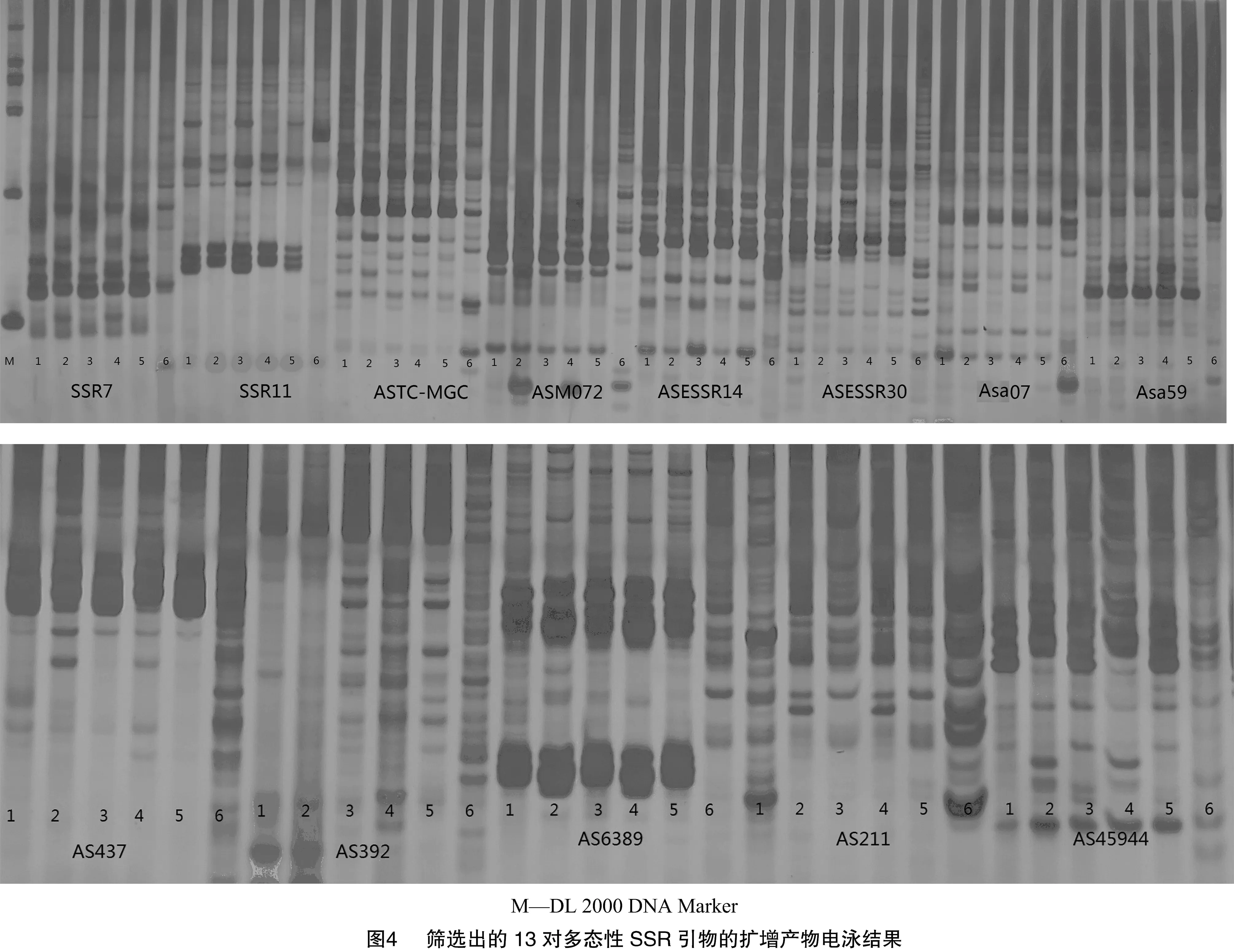

表4 筛选出的13对多态性SSR引物的序列及其最佳退火温度
3 讨论
3.1 提取DNA的琼脂糖凝胶电泳检测结果
提取高质量的模板DNA是进行SSR-PCR的前提,近年来最简单的DNA 提取方法是植物基因组DNA提取试剂盒,虽然成本较高,但操作方便快捷、DNA纯度高、操作过程毒害少,其应用越来越广泛。然而取材不同,细胞内的组成成分如多酚类化合物、多糖等会影响DNA的提取质量。大蒜鳞茎中含有比叶片更多的黏液类物质,试剂盒提取效果不如叶片,因此采取传统的CTAB 法提取,但其操作步骤繁琐费时,所用异丙醇、聚乙烯吡咯烷酮(PVP) 等有很大毒害。相较之下,试剂盒提取的DNA纯度高但浓度过低,传统CTAB法提取的DNA纯度一般但浓度很高。因此,在模板DNA试验实际的需求量小时建议使用植物基因组试剂盒提取DNA,需求量较大或者取材干扰物质多时采用传统的CTAB 法。
3.2 建立大蒜SSR-PCR体系的影响因素
建立稳定的PCR反应体系是SSR分析应用的基础,体系涉及到的诸多因子对整个反应的敏感性、特异性和产量都有较大影响。因此,筛选适合的SSR引物、建立反应体系并进一步优化体系,是前期需要开展的必备工作。有研究表明,模板DNA浓度过低会造成反应后条带不完全或者电泳结果中没有扩增产物;浓度过高会增加体系中抑制反应的成分含量,出现非特异性扩增现象。引物浓度过低时目标扩增产物的浓度过低或者出现扩增不完全现象,浓度过高则电泳后结果会出现大量引物二聚体。循环次数是SSR-PCR扩增反应的关键因素;次数设置过少,目标扩增产物量少,电泳结果不理想;次数设置过多,消耗完反应物后目标扩增产物不再增加,并会出现非特异性扩增现象。
本试验借助正交表的均衡分散性和整齐可比性,通过多因素联合优化的正交试验设计对影响大蒜DNA SSR反应的2×PCR Mix添加量、引物浓度及模板DNA用量等因子进行优化试验分析,最终得出适合大蒜 SSR-PCR 的反应体系:总体积 10 μ L、模板DNA 30.0 ng、正反引物各0.5 μmol/L、2×PCR Mix 5.0 μL,用dd HO补齐。SSR-PCR扩增程序设定为:94 ℃预变性3 min;94 ℃变性30 s,不同引物最佳退火温度退火45 s,72 ℃延伸90 s;30次循环的最后1次循环72 ℃延伸设为 10 min,4 ℃保存扩增产物。以上述最佳反应体系和扩增程序为基础,进一步在50对通用引物中筛选出高多态性、重复性良好的13对SSR有效引物,可以为大蒜的品种鉴定、遗传多样性等分子辅助研究提供理论和技术支持。

