灯盏花素通过调控LKB1/AMPK和Notch1/Jagged1通路改善高脂血症大鼠血脂水平及肝肾功能的作用机制研究*
张明昊,郭 申,杜婧雯,俎兆轩,赵 绅,张 童
(河南中医药大学医学院 郑州 450046)
高脂血症(Hyperlipidemia)是一种以血液中脂质水平升高及部分载脂蛋白水平降低为主要临床表现的代谢性疾病[1-3],这种血脂水平异常不仅会增加心脑血管疾病发生的潜在危险,还会导致肝细胞脂肪性病变、肾小球硬化及固有细胞凋亡,故肝脏、肾脏是血脂异常致损伤的主要靶器官[4-5]。西医治疗高脂血症常以他汀类药物为主,该类药物虽能够抑制HMG-CoA还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMGCR)活性和升高肝脏组织内低密度脂蛋白(Low Density Lipoprotein,LDL)受体水平,进而使机体内总胆固醇(Total Cholesterol,T-CHO)和低密度脂蛋白胆固醇(Low Density Lipoprotein Cholesterol,LDL-C)水平降低,但长期用药会损害肝、肾及肌肉功能,且停药后血脂也会升高[1]。
中医学认为“痰浊、瘀血”为高脂血症主要病机,其发病与肝、肾关系密切,祛瘀通络为其主要治疗思路[6]。灯盏花素(Scutellarin,SCU,40,5,6-三羟基黄酮-7-葡萄糖醛酸苷,分子式:C21H18O12)是一种能够活血化瘀、通脉活络、祛风除湿的黄酮类化合物,由灯盏花全枝中提取,临床上用于多种心脑血管疾病的治疗[7-8]。本课题组曾对灯盏花素的药理作用进行了深入研究,发现该药一方面可改善微循环、清除氧自由基而保护肝脏;另一方面可以降低血液粘稠度、对抗细胞脂质过氧化而保护肾脏,但其对血脂异常升高引起的肝肾损伤是否具有保护作用还未见报道。因灯盏花素活血化瘀的作用符合高脂血症“祛瘀通络”的治疗思路,且临床上已有灯盏花素治疗高脂血症患者的少量报道,故本课题组选用灯盏花素对高脂血症大鼠进行干预,以辛伐他汀为阳性对照药物,观察灯盏花素对高脂血症大鼠血脂水平及肝肾功能的影响。
灯盏花素虽能去纤降脂、保护肝肾,但其对血脂水平干预及肝肾保护机制尚不清楚。本课题组考虑到肝激酶B1(Liver kinase B1,LKB1)/单磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)通路与多种能量代谢异常疾病密切相关[9],而Notch信号受体1(Notch1)/Notch信号配体1(Jagged1)通路与多种慢性肾脏疾病密切相关[10],故本研究将从LKB1/AMPK、Notch/Jagged1两条通路的角度探究灯盏花素对高血脂症大鼠血脂水平干预及肝肾保护机制,对中医药治疗高脂血症具有一定的启示意义。本实验目的在于探究灯盏花素通过激活LKB1/AMPK通路、抑制Notch/Jagged1通路对高血脂症大鼠血脂水平干预及肝肾保护机制,为中医药防治高脂血症提供实验数据,并为高血脂症的临床治疗提供新的方向。
1 材料与方法
1.1 实验动物
8周龄清洁级雄性SD大鼠,体质量180-220 g,郑州市中原区梦飞养殖场提供,动物生产许可证号:SCXK(豫)2020-0005,动物质量合格证号:110981201100002671。大鼠饲养于河南中医药大学医学实验教学中心,动物使用许可证号:SYXK(豫)2020-0004,实验期间动物饲养环境温度为20-22℃,相对湿度为55%-60%,正常光照,大鼠自由饮水采食。
1.2 主要试剂与仪器
灯盏花素片(20 mg/片,国药准字Z20013018,批号:20210101)购自广东彼迪药业有限公司;辛伐他汀(批号:1810409,国药准字H20066196,规格:10 mg/片)购自杭州默沙东制药有限公司;高脂饲料由郑州市中原区梦飞养殖场提供;氨基甲酸乙酯(批号:20200326)购自上海山浦化工有限公司;甘油三酯(Triglyceride,TG)测定试剂盒(批号:ML003393-1)、高密度脂蛋白胆固醇(High Density Lipoprotein Cholesterol,HDL-C)测定试剂盒(批号:ML059157-1)、天门冬氨酸氨基转移酶(Aspartate Aminotransferase,AST)测定试剂盒(批号:ML059334-1)、总胆固醇(Total Cholesterol,T-CHO)测定试剂盒(批号:MLSH0502)、低密度脂蛋白胆固醇(Low Density Lipoprotein Cholesterol,LDL-C)测定试剂盒(批号:ML037144-1)、肌酐(Creatinine,Cr)测定试剂盒(批号:ML058879-1)、尿素氮(Blood Urea Nitrogen,BUN)测定试剂盒(批号:MLSH0416)、丙氨酸氨基转移酶(Alanine Aminotransferase,ALT)测定试剂盒(批号:ML037336-1)均购自上海酶联生物科技有限公司;兔链霉卵白素-生物素检测(SP)试剂盒(批号:SP-9001)、二氨基联苯胺法(Diaminobenzidine,DAB)显色试剂盒(批号:ZLI-9019)均购自北京中杉金桥生物技术有限公司;肝激酶B1(LKB1)抗体(批号:bs-3948R)、3-羟基-3-甲基戊二酸单酰辅酶A还原酶(HMGCR)抗 体(bs-5068R)、Notch信 号 受 体1(Notch1)抗体(批号:ab167441)、Notch信号配体1(Jagged1)抗体(批号:ab300561)、发状分裂相关增强子1(Hes1)抗体(批号:ab108937)均购自Abcam公司;TriQuick总RNA提取试剂(批号:R1100)、cDNA合成试剂盒(批号:G3330)、实时荧光定量PCR扩增试剂(批号:G3320)均购自武汉赛维尔生物科技有限公司。
Secura124-1CN型电子天平购自德国公司Sartorius公司;DNM-9606型酶标仪购自北京普朗新技术有限公司;Leica RM2245型石蜡切片机购自德国徕卡公司;C1650R-230V型高速冷冻离心机购自莱普特科学仪器(北京)有限公司;KH-BJ型生物组织包埋机、KH-P3型漂片仪、KH-P4烤片机购自湖北孝感阔海科技有限公司;CX23光学显微镜购自日本Olympus公司;CFX型荧光定量PCR仪购自美国Bio-rad公司。
1.3 实验方法
1.3.1 动物分组、造模及给药
取60只大鼠适应性饲养7天后,按体质量随机分为正常组(Normal)、模型组(Model)、辛伐他汀组(Simvastatin)和灯盏花素低、中、高剂量组(Breviscapine-L,-M,-H),每组10只。正常组大鼠常规饲养,饲喂普通饲料,其余各组大鼠均按10mL·kg-1腹腔注射75%蛋黄乳液(Egg Yolk Lotion),注射后大鼠禁食16 h,不禁水,16 h后饲喂高脂饲料(High Fat Feed),连续饲喂28天。辛伐他汀组和灯盏花素低、中、高剂量组在造模同时即干预给药,其中辛伐他汀组大鼠按20 mg·kg-1灌胃辛伐他汀(Simvastatin)溶液;灯盏花素低、中、高剂量组大鼠分别按6 mg·kg-1、12 mg·kg-1、24 mg·kg-1灌胃灯盏花素(Breviscapine)溶液,1次/天,连续28天。
1.3.2 标本采集
末次给药24h后,各组大鼠称重后腹腔注射氨基甲酸乙酯麻醉,注射剂量为1 g·kg-1,麻醉后采用腹主动脉取血,3000 r·min-1离心10 min,分离取血清。然后将大鼠颈椎脱臼处死,解剖取肝脏(Liver)和肾脏(Renal),去除脏器周围结蹄组织,吸尽脏器表面血液,将取出的肝脏、肾脏置于电子天平上称重、记录;再将肝脏、肾脏各分两部分,其中一部分放置于4%中性甲醛中固定;另一部分放入液氮速冻后再置于-80℃下储存备用。
1.3.3 酶联免疫(ELISA)法检测血清TG、T-CHO、LDL-C、HDL-C、ALT、AST、Cr、BUN水平
按照说明书,用ELISA法试剂盒对各组大鼠血清中TG、T-CHO、LDL-C、HDL-C、ALT、AST、Cr、BUN水平进行检测。
1.3.4 测定肝脏系数(LW/BW)、肾脏系数(RW/BW)
计算肝脏质量(Liver weight,LW)、肾脏质量(Renal weight,RW)与体质量(Body weight,BW)的比值,即肝脏系数(LW/BW)、肾脏系数(RW/BW),以此来评价肝脏、肾脏病变程度。
1.3.5 肝肾组织病理学观察
取1.3.2项下固定的肝脏和肾脏组织,经75%、85%、95%、100%乙醇(Ethanol)梯度脱水、二甲苯(Xylene)透明、固体石蜡(Paraffin Wax)包埋、4µm切片等实验过程制作病理组织切片,切片经二甲苯脱蜡、苏木素-伊红(Hematoxylin-Eosin,HE)染色,盐酸乙醇分化,75%、85%、95%、100%乙醇梯度脱水、二甲苯透明后采用中性树胶封片,光学显微镜(Light Microscope)下观察肝、肾组织病理学变化并于400倍镜下采集图像。
1.3.6 免疫组织化学(Immunohistochemistry,IHC)法检 测 肝 组 织p-AMPK、LKB1、HMGCR和 肾 组 织Notch1、Jagged1、Hes1蛋白水平
取1.3.5项下制作的肝脏、肾脏组织切片,经二甲苯脱蜡、水化后,用柠檬酸盐缓冲液(Citrate Buffer)热修复8min,待温度降至室温后切片依次用过氧化氢(H2O2)孵育10min,磷酸盐缓冲液(PBS)浸洗,山羊血清(Goat Serum)孵育30 min,然后分别滴加p-AMPK(1:1000)、LKB1(1:1000)、HMGCR(1:1000)、Notch1(1:1000)、Jagged1(1:1000)、Hes1(1:1000)抗体,4℃孵育过夜,次日切片复温至37℃后滴加生物素标记的羊抗兔IgG二抗(HRP)孵育20 min,PBS缓冲液浸洗,二氨基联苯胺(DAB)显色液显色反应10min,自来水浸洗终止。然后苏木素(Hematoxylin)复染3 min,盐酸乙醇分化,自来水再次浸洗,切片经75%、85%、95%、100%乙醇梯度脱水、二甲苯透明、中性树胶封片后于光学显微镜下观察。每只大鼠肝脏、肾脏组织切片在400倍镜下随机选取1个视野,以棕黄色为阳性染色,采用Image-Pro Plus 6.0测定每个视野中平均光密度值(Average optical density value,AOD)值进行统计分析。
1.3.7 实时荧光定量PCR(Quantitative Real-time PCR)法检测肝组织AMPK、LKB1、HMGCR和肾组织Notch1、Jagged1、Hes1 mRNA水平
根据GenBank已发表的大鼠AMPK(登录号:NM023991)、LKB1(登 录 号:NM001108069.1)、HMGCR(登录号:NM013134.2)、Notch1(登录号:NM001105721)、Jagged1(登录号:NM019147.1)、Hes1(登 录 号:NM024360.3)、GAPDH(登 录 号:NM017008.4)基因序列设计特异性引物,引物序列见表1,以上引物采用DNA序列分析软件(DNAStar)的PrimerSelect程序设计,并由上海生工生物工程有限公司合成。然后取肝脏、肾脏组织各100mg,加入1mL总RNA提取试剂(TriQuick)充分研磨匀浆后采用酚抽提法提取总RNA,经浓度及纯度检测后在20µL反应体系内逆转录合成cDNA,再以2µL cDNA为模板,加入靶基因上下游引物、Taq DNA聚合酶、dNTP于15µL反应体系内进行定量PCR扩增。反应结束后,根据扩增曲线及溶解曲线判断PCR反应特异性。所得结果以甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-Phosphate Dehydrogenase,GAPDH)为内参,用2-△△CT法计算目的基因相对水平。

表1 Real-time PCR引物序列
1.4 统计学处理
采用SPSS 24.0软件进行统计分析,所有数据以均数±标准差(xˉ±s)表示,多组间比较用单因素方差分析(One-Way ANOVA),方差齐者组间两两比较采用最小显著差异法(Least-Significant Difference,LSD)检验,方差不齐者组间两两比较采用新复极差法(Dunnett-t)检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 灯盏花素对高脂血症大鼠血脂水平的影响
与正常组比较,模型组、辛伐他汀组和灯盏花素低、中、高剂量组T-CHO、TG、LDL-C水平明显升高(P<0.05);HDL-C水平明显降低(P<0.05)。与模型组比较,辛伐他汀组和灯盏花素低、中、高剂量组T-CHO、TG、LDL-C水平明显降低(P<0.05);HDL-C水平明显升高(P<0.05)。与辛伐他汀组比较,灯盏花素低、中剂量组T-CHO水平明显升高(P<0.05);HDL-C水平明显降低(P<0.05);灯盏花素低、中、高剂量组TG、LDL-C水平明显升高(P<0.05)。与灯盏花素低剂量组比较,灯盏花素中、高剂量组T-CHO、TG水平明显降低(P<0.05);HDL-C水平明显升高(P<0.05);灯盏花素高剂量组LDL-C水平明显降低(P<0.05)(图1)。
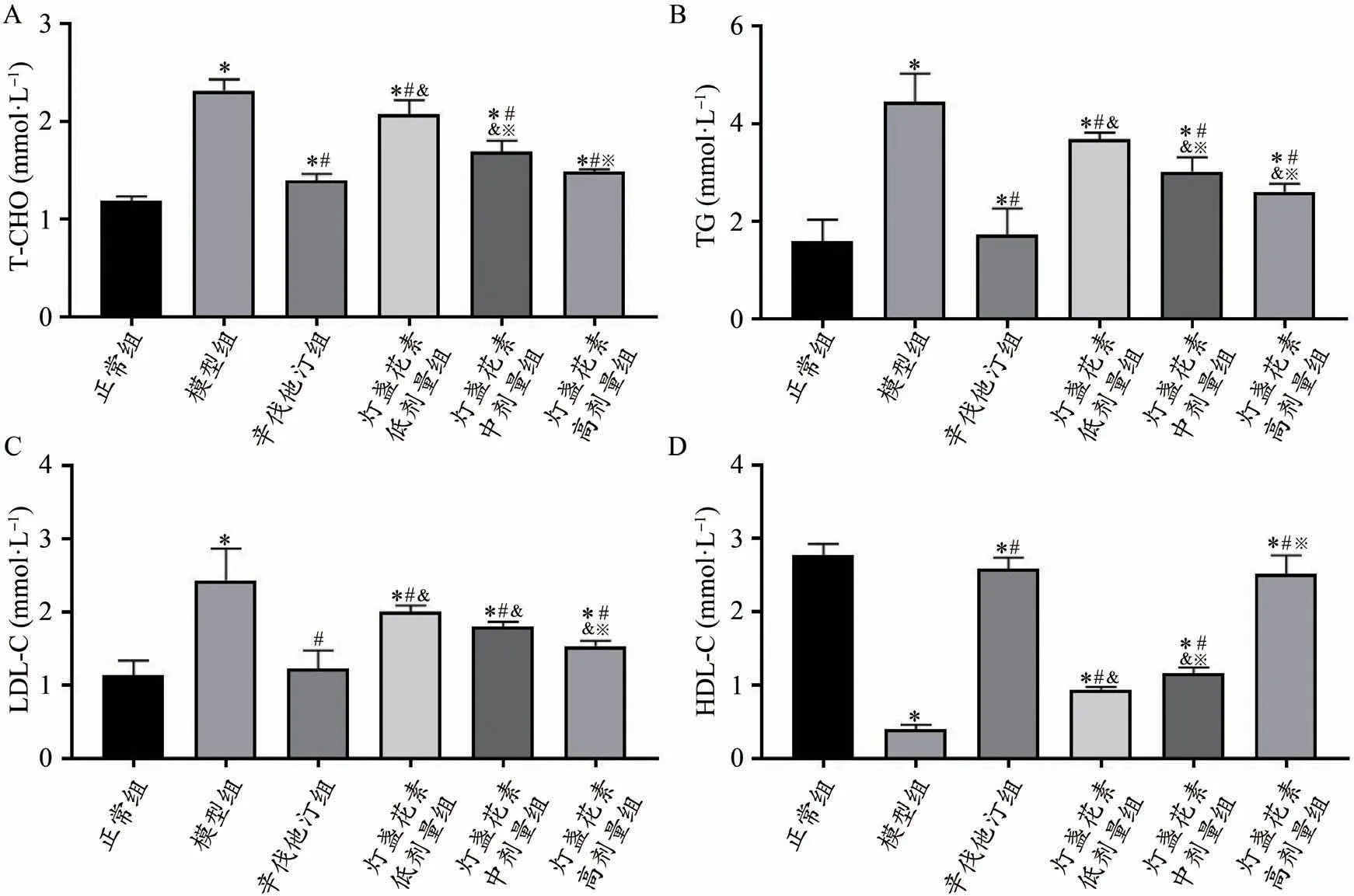
图1 灯盏花素对高脂血症大鼠血脂水平的影响(xˉ±s,n=10)
2.2 灯盏花素对高脂血症大鼠肝脏功能的影响
与正常组比较,模型组和灯盏花素低、中剂量组肝脏系数明显增加(P<0.05);模型组和灯盏花素低、中、高剂量组ALT水平明显升高(P<0.05);模型组和灯盏花素低剂量组AST水平明显升高(P<0.05)。与模型组比较,辛伐他汀组和灯盏花素低、中、高剂量组肝脏系数、ALT和AST水平明显降低(P<0.05)。与辛伐他汀组比较,灯盏花素低剂量组肝脏系数、AST水平明显升高(P<0.05);灯盏花素低、中剂量组ALT水平明显升高(P<0.05)。与灯盏花素低剂量组比较,灯盏花素高剂量组肝脏系数和ALT水平明显降低(P<0.05);灯盏花素中、高剂量组AST水平明显降低(P<0.05)(图2)。

图2 灯盏花素对高脂血症大鼠肝脏功能的影响
2.3 灯盏花素对高脂血症大鼠肾脏功能的影响
与正常组比较,模型组和灯盏花素低、中、高剂量组肾脏系数明显增加(P<0.05);BUN水平明显升高(P<0.05);模型组和灯盏花素低、中剂量组Cr水平明显升高(P<0.05)。与模型组比较,辛伐他汀组和灯盏花素低、中、高剂量组肾脏系数、Cr和BUN水平明显降低(P<0.05)。与辛伐他汀组比较,灯盏花素低、中剂量组肾脏系数和Cr水平明显升高(P<0.05);灯盏花素低、中、高剂量组BUN水平明显升高(P<0.05)。与灯盏花素低剂量组比较,灯盏花素高剂量组肾脏系数和Cr水平明显降低(P<0.05);灯盏花素中、高剂量组BUN水平明显降低(P<0.05)(图3)。

图3 灯盏花素对高脂血症大鼠肾脏功能的影响
2.4 灯盏花素对高脂血症大鼠肝肾病理的影响
HE染色结果显示,正常组大鼠肝细胞排列整齐,大小形态正常,肝小叶结构正常,未见脂肪滴;肾脏组织形态正常,肝肾组织均未见病理性变化。模型组大鼠肝细胞排列不整齐,细胞肿胀变大,细胞间分界不清晰,大量脂肪滴存在于细胞浆内;肾脏组织结构存在明显挤压,系膜基质明显增加,肾小球局部可见局灶节段性硬化,肾小管变性,且可见大量炎性细胞浸润于组织内;辛伐他汀组和灯盏花素低、中、高剂量组大鼠肝细胞形态无异常,整体排列较平整,有少量脂肪滴存在于细胞浆;肾脏组织挤压及肾小球、肾小管变性程度明显改善,炎性细胞浸润明显减轻(图4)。
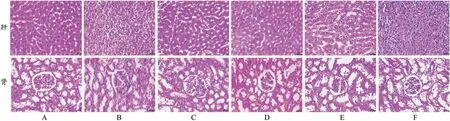
图4 灯盏花素对高脂血症大鼠肝肾病理的影响(HE,×400)
2.5 灯盏花素对高脂血症大鼠肝组织p-AMPK、LKB1、HMGCR蛋白水平的影响
免疫组化结果显示,正常组肝组织有大量p-AMPK、LKB1表达,有少量HMGCR表达。与正常组比较,模型组、辛伐他汀组和灯盏花素低、中剂量组p-AMPK水平明显降低(P<0.05),HMGCR水平明显升高(P<0.05);灯盏花素高剂量组p-AMPK水平明显升高(P<0.05),HMGCR水平明显降低(P<0.05);辛伐他汀组和灯盏花素低剂量组LKB1水平明显降低(P<0.05);灯盏花素中、高剂量组LKB1水平明显升高(P<0.05)。与模型组比较,辛伐他汀组和灯盏花素低、中、高剂量组p-AMPK、LKB1水平明显升高(P<0.05);HMGCR水平明显降低(P<0.05)。与辛伐他汀组比较,灯盏花素低、中剂量组p-AMPK水平明显降低(P<0.05),灯盏花素高剂量组p-AMPK水平明显升高(P<0.05);灯盏花素低剂量组LKB1水平明显降低(P<0.05),HMGCR水平明显升高(P<0.05);灯盏花素中、高剂量组LKB1水平明显升高(P<0.05);HMGCR水平明显降低(P<0.05)(图5)。
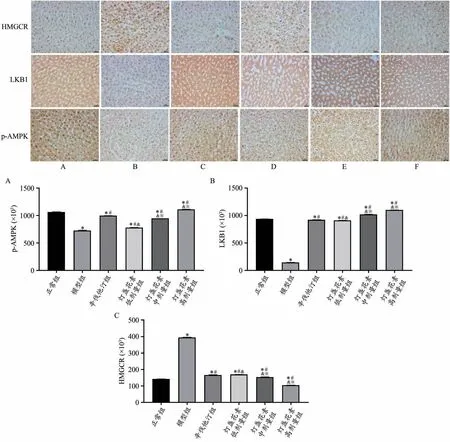
图5 灯盏花素对高脂血症大鼠肝组织p-AMPK、LKB1、HMGCR蛋白水平的影响(免疫组化,×400)
2.6 灯盏花素对高脂血症大鼠肾组织Notch1、Jagged1、Hes1蛋白水平的影响
免疫组化结果显示,正常组肾组织中有少量Notch1、Jagged1和Hes1表达。与正常组比较,模型组和灯盏花素低剂量组Notch1水平明显升高(P<0.05),辛伐他汀组和灯盏花素高剂量组Notch1水平明显降低(P<0.05);模型组、辛伐他汀组和灯盏花素低、中、高剂量组Jagged1水平明显升高(P<0.05);模型组和灯盏花素低、中、高剂量组Hes1水平明显升高(P<0.05),辛伐他汀组Hes1水平明显降低(P<0.05)。与模型组比较,辛伐他汀组和灯盏花素低、中、高剂量组Notch1、Jagged1和Hes1水平明显降低(P<0.05)。与辛伐他汀组比较,灯盏花素低、中剂量组Notch1水平明显升高(P<0.05);灯盏花素低剂量组Jagged1水平明显升高(P<0.05),灯盏花素高剂量组Jagged1水平明显降低(P<0.05);灯盏花素低、中、高剂量组Hes1水平明显升高(P<0.05)。与灯盏花素低剂量组比较,灯盏花素中、高剂量组Notch1、Jagged1和Hes1水平明显降低(P<0.05)(图6)。
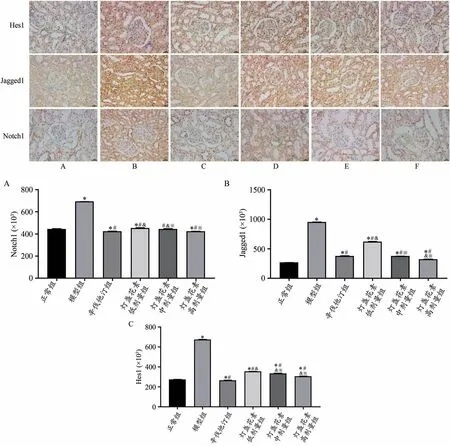
图6 灯盏花素对高脂血症大鼠肾组织Notch1、Jagged1、Hes1蛋白水平的影响(免疫组化,×400)
2.7 灯盏花素对高脂血症大鼠肝组织AMPK、LKB1、HMGCR mRNA水平的影响
Real-time PCR结果显示,与正常组比较,模型组、辛伐他汀组和灯盏花素低、中、高剂量组AMPK mRNA水平明显降低(P<0.05),HMGCR mRNA水平明显升高(P<0.05);模型组和灯盏花素低、中、高剂量组LKB1 mRNA水平明显降低(P<0.05)。与模型组比较,辛伐他汀组和灯盏花素低、中、高剂量组AMPK、LKB1 mRNA水平明显升高(P<0.05);辛伐他汀组和灯盏花素中、高剂量组HMGCR mRNA水平明显降低(P<0.05)。与辛伐他汀组比较,灯盏花素低剂量组AMPK mRNA水平明显降低(P<0.05),HMGCR mRNA水平明显升高(P<0.05);灯盏花素低、中、高剂量组LKB1 mRNA水平明显降低(P<0.05)。与灯盏花素低剂量组比较,灯盏花素中、高剂量组中、高剂量组LKB1 mRNA水平明显升高(P<0.05),HMGCR mRNA水平明显降低(P<0.05)(图7)。
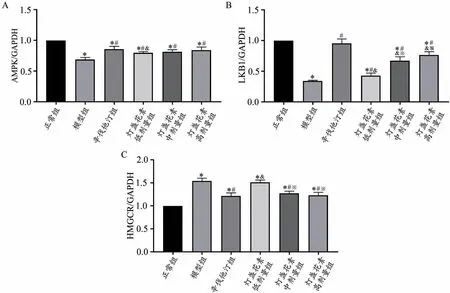
图7 灯盏花素对高脂血症大鼠肝组织AMPK、LKB1、HMGCR mRNA水平的影响
2.8 灯盏花素对高脂血症大鼠肾组织Notch1、Jagged1、Hes1 mRNA水平的影响
Real-time PCR结果显示,与正常组比较,模型组、辛伐他汀组和灯盏花素低、中、高剂量组Notch1、Jagged1、Hes1 mRNA水平明显升高。与模型组比较,辛伐他汀组和灯盏花素低、中、高剂量组Notch1、Jagged1、Hes1 mRNA水平明显降低。与辛伐他汀组比较,灯盏花素低、中剂量组Notch1 mRNA水平明显升高;灯盏花素低、中、高剂量组agged1、Hes1 mRNA水平明显升高。与灯盏花素低剂量组比较,灯盏花素中、高剂量组Notch1、Jagged1、Hes1 mRNA水平明显降低(图8)。

图8 灯盏花素对高脂血症大鼠肾组织Notch1、Jagged1、Hes1 mRNA水平的影响
3 讨论
随着社会经济的发展和生活条件的改善,高脂高糖饮食伴随不良生活习惯导致了血脂异常发病率呈逐年升高的趋势,而血脂异常升高则会引起心血管病、脑血管病及肥胖等多种相关疾病的发生,从而加重我国国民医疗负担[5,11]。血脂是血浆中T-CHO、TG及类脂的总称,其水平异常升高即高脂血症[12];LDL-C是一种脂蛋白,主要参与T-CHO从肝脏至外周组织的转运过程;HDL-C是将T-CHO从外周组织转运至肝脏代谢的一种脂蛋白[13],二者功能相互呼应,当LDL-C水平升高且HDL-C水平下降时,机体脂质代谢清除能力下降,就会引起高血脂症。在对高脂血症的病因、病理及降脂新药研究中,构建与人类病变基本相似且具有重复性的高脂血症动物模型是先决条件。本实验采用了一次性腹腔注射蛋黄乳液后饲喂高脂饲料的方法,诱导构建了大鼠高脂血症模型[14],结果发现该模型大鼠T-CHO、TG和LDL-C水平升高而HDL-C水平下降,表明造模成功。该模型在临床上与人类高脂血症特征相似,可用于高脂血症研究。
灯盏花学名为短葶飞蓬(Erigeron breviscapus),属菊科,性温,味辛、微苦,能活血通络、散寒除湿[15],而灯盏花素就是从该种植物中分离得到的黄酮类成分,具有活血化瘀、通脉活络、去纤降脂、扩张血管等功效[16],且运用此药治疗高脂血症符合“祛瘀通络”的治疗理念。辛伐他汀是一种HMG-CoA还原酶抑制剂,可以有效降低血脂水平[5]。基于以上思路,本实验选择灯盏花素为治疗药物,以辛伐他汀为阳性对照药,探讨了其对高血脂大鼠的干预作用,结果发现灯盏花素可以明显降低高血脂症大鼠血清T-CHO、TG、LDL-C水平,升高HDL-C水平,表明灯盏花素具有较好地降血脂作用。
肝脏是机体脂质代谢的主要场所,血脂异常升高会导致肝脏出现脂肪堆积,并引起肝实质细胞出现脂肪性病变,肝脏功能受损,脂质代谢过程紊乱。肝脏系数可以反映肝脏的状态,其增加时则提示肝脏可能出现了肿胀、肥大、充血、水肿、增生等病理变化。ALT和AST水平是反映肝细胞膜的稳定性的重要指标,也是临床上肝功能的判断标准,其水平升高提示肝细胞病变[17]。本实验结果发现高脂血症大鼠血清ALT、AST水平升高,肝脏系数增加,灯盏花素可以下调高脂血症大鼠血清ALT、AST水平,并使肝脏系数减小;进一步病理观察发现,高血脂症大鼠肝脏细胞呈现脂肪性病变,灯盏花素可以改善高血脂症大鼠肝脏细胞脂肪变性程度,表明灯盏花素对高血脂症大鼠肝脏功能具有保护作用。
血脂异常升高还可作为一种独立的致病因素参与肾脏疾病的发生发展过程。在高脂条件下,脂质可以黏附于肾小球内皮细胞并穿透至皮下间隙,在细胞及化学因子作用下刺激肾小球细胞外基质(Extracellular matrix,ECM)合成和分泌增加,肾小球硬化,肾脏固有细胞凋亡,从而导致肾脏结构改变,功能减退[18-19]。Cr是肌酸代谢的最终产物,由肾小管排泄;BUN是血浆中除蛋白质外的一种含氮化合物,由肾小球滤过而排出体外,二者均是临床上检测肾脏功能的重要指标,其水平升高则提示肾功能受损[20-21]。本实验结果显示高脂血症模型大鼠血清Cr和BUN水平升高,且肾脏系数增加,进一步病理检查发现该模型大鼠肾组织结构明显挤压,肾小球硬化,肾小管变性且可见大量炎性细胞浸润,提示高脂血症可造成肾脏损伤。灯盏花素可以下调高血症大鼠血清Cr、BUN水平,减小肾脏系数;改善肾脏病理变化,表明灯盏花素对高血脂症大鼠肾脏功能具有保护作用。
AMPK是一种丝氨酸/苏氨酸蛋白激酶,参与机体的能量代谢调节过程,并与多种能量代谢异常疾病密切相关[22],而LKB1-AMPK则是肝脏中主要的激活AMPK的信号通路。当细胞内AMP/ATP升高时,AMPKα亚基上Thr172位点可被LKB1磷酸化为p-AMPK而激活[23-26],p-AMPK则可以通过单磷酸腺苷活化蛋白激酶-白细胞分化抗原36(AMPK-CD36)、单磷酸腺苷活化蛋白激酶-乙酰辅酶A羧化酶(AMPKACC)、单磷酸腺苷活化蛋白激酶-羟甲基戊二酰辅酶A还原酶(AMPK-HMG-CoA)等多条通路影响肝脏脂肪酸摄入、氧化及T-CHO的合成[27]。机体内70%-80%的T-CHO在肝脏中合成,涉及多步酶催化反应,其中HMGCR是T-CHO合成过程中的限速酶,其活性降低可以减少胆固醇的合成[28-30]。本实验结果发现高脂血症大鼠肝脏组织中AMPK、p-AMPK、LKB1蛋白及mRNA水平降低,LKB1-AMPK通路被抑制,HMGCR蛋白及mRNA水平升高,T-CHO合成增加;灯盏花素可以通过上调AMPK、p-AMPK、LKB1蛋白及mRNA水平,下调HMGCR蛋白及mRNA水平来提升机体脂质代谢水平。
Notch信号通路是一条与细胞增殖、分化、凋亡有关的重要通路之一,在成熟哺乳类动物和人体内很少表达,但在多种肾脏疾病中表达水平升高[31]。以Notch1-4、DⅡ1-3、Jag1-2及Hey、Hes为代表的Notch信号受体、配体及胞内效应器共同参与了肾脏发育与肾血管形成过程[32-33],其中Notch1/Jagged1通路的异常激活与多种肾脏疾病的发生发展过程有关。已有研究证实体外诱导大鼠肾小管上皮细胞高表达后可使其胞质中Notch1片段大量积累,从而进一步激活Notch通路以介导肾损伤过程;而Notch1在上皮细胞的异常表达也能诱导肾小管间质纤维化过程[34-36]。本实验结果发现高脂血症大鼠肾脏组织中Notch1、Jagged1和Hes1蛋白及mRNA水平升高,Notch通路被异常激活,用灯盏花素干预后Notch1、Jagged1和Hes1蛋白及mRNA水平降低,Notch通路被阻断,由血脂异常升高引起的肾脏损伤进程得到了干预和延缓,这与肾损伤病理变化一致。
本实验的小结如下:①灯盏花素可以明显降低高血脂症大鼠血清T-CHO、TG、LDL-C水平,升高HDLC水平,表明灯盏花素具有较好地降血脂作用。②灯盏花素可以改善高血脂症大鼠肝脏细胞脂肪变性程度,表明灯盏花素对高血脂症大鼠肝脏功能具有保护作用。③灯盏花素可以下调高血症大鼠血清Cr、BUN水平,减小肾脏系数;改善肾脏病理变化,表明灯盏花素对高血脂症大鼠肾脏功能具有保护作用。④灯盏花素可通过激活LKB1/AMPK通路,抑制HMGCR水平来发挥其提升脂质代谢水平及抑制T-CHO合成的作用。⑤灯盏花素可通过抑制Notch1/Jagged1通路来延缓由血脂异常升高引起的肾脏损伤进程。⑥6 mg·kg-1和12 mg·kg-1剂量的灯盏花素降血脂及对肝肾的保护作用均弱于辛伐他汀,24 mg·kg-1剂量的灯盏花素降血脂及对肝肾的保护作用与辛伐他汀相仿。以上观点均为灯盏花素在高脂血症治疗领域的首次提出,具有较高的研究价值。
辨证论治是中医精髓所在,高血脂症临床治疗也要审证求因,做到药证相对。与他汀类药物比较,灯盏花素祛邪之力较强,对气滞血瘀型与痰浊阻遏型高脂血症的疗效较好,且在保护肝肾方面与传统西药作用相当,适合于长期用药。由于中药的治疗作用存在多靶点、多通路共同作用的特点,故深入揭示灯盏花素降血脂及肝肾保护作用的机制将是本课题组以后的研究方向。

