龙胆泻肝汤通过H1R/TRPV1、PAR-2/TRPV1和P38MAPK通路干预湿疹大鼠的作用机制研究*
张明昊,薛鹏坤,赵盈盈,高一盈,董文霞,
马伟洋1,王 珍1,张 超3**
(1.河南中医药大学医学院 郑州 450046;2.河南中医药大学药学院 郑州 450046;3.河南中医药大学研究生院 郑州 450046)
湿疹(atopic dermatitis,AD)是一种常见的炎症性皮肤病,临床上具有皮损对称分布、剧烈瘙痒、反复发作等特点[1],发病率逐年升高。湿疹病因复杂,目前多认为是在机体内部因素如免疫功能异常、神经与精神功能障碍等基础上,综合外部因素共同作用的结果[2]。目前西医常以糖皮质激素类药物外用行局部治疗,或使用H1受体拮抗药行全身治疗,较为严重者还需要使用糖皮质激素等免疫抑制剂来进行免疫治疗。这些药物虽能在短期内缓解症状,但难以有效治愈湿疹,且易出现停药后“反跳”现象及不良反应,比如H1受体拮抗药可以抑制Ⅰ型变态反应,但对于湿疹这种迟发型超敏反应也只能是起到缓解瘙痒的作用;糖皮质激素虽能抑制迟发型超敏反应,但长期使用时无论是局部还是全身用药都会出现明显的副作用[3-4]。
鉴于H1受体拮抗药和糖皮质激素在临床上的使用局限性,本课题组从中医中药角度出发来研究湿疹的治疗方法和药物。湿疹属“浸淫疮”范畴,中医学认为其主要病机是禀赋不耐,湿热内蕴,外感风邪等致风、湿、热邪相搏,浸淫肌肤而发[5],在中医辨证上多属风热型,以清肝胆、利湿热为主要治疗思路。龙胆泻肝汤能清泻肝胆实火、清利肝胆湿热[6],具有调节免疫、镇痛、抗炎、抗过敏、抗病毒及病原微生物和抗氧化等多种药理作用,故用其治疗湿疹符合中医治疗理念。本课题组曾对龙胆泻肝汤在湿疹的临床治疗方面进行了调研,发现该方疗效较好,但缺乏实验室研究数据和相应机制的探讨。
考虑到止痒和抗炎是治疗湿疹的两个基本思路,且中药具有多功效、多靶点的特点,因此本课题组将在龙胆泻肝汤对大鼠湿疹模型干预效果的基础上,从组胺受体H1(Histamine H1 receptor,H1R)/瞬时感受器电位受体1(Transient receptor potential cation channel subfamily vanilloid receptor 1,TRPV1)、蛋白酶激活受体2(Proteinase activated receptor 2,PAR2)/瞬时感受器电位受体1(Transient receptor potential cation channel subfamily vanilloid receptor 1,TRPV1)和丝裂原活化蛋白激酶P38MAPK(P38 mitogen activated protein kinase)三条信号通路的角度探究龙胆泻肝汤对大鼠湿疹模型的干预机制,对中医药治疗湿疹具有一定的启示意义。本实验目的在于探究龙胆泻肝汤通过抑制H1R/TRPV1、PAR-2/TRPV1和P38MAPK通路对湿疹大鼠的干预机制,为中医药防治湿疹提供实验数据,并为湿疹的临床治疗提供新的方向。
1 材料与方法
1.1 试验药物
龙胆泻肝汤(由龙胆草15 g,黄芩10 g,栀子15 g,泽泻15 g,车前子15 g,当归10 g,地黄15 g,柴胡10 g,牡丹皮15 g,夏枯草20 g组成)购自郑州真心大药房有限公司,经河南中医药大学药学院董诚明教授鉴定为正品,以上药物常规煎煮,浓缩为1.26 g·mL-1的药液。氯雷他定片(Loratadine)购自上海海尼药业有限公司(规格:10 mg/片,批号:2003014)。
1.2 动物
健康8周龄SD大鼠60只,雄性,体质量200±20 g,购于郑州市惠济区华兴实验动物养殖场,动物生产许可证号:SCXK(豫)2019-0002,所有大鼠饲养于河南中医药大学医学机能实验室,实验单位使用许可证号:SYXK(豫)2020-0004,环境温度为20-22℃,相对湿度为55%-60%,正常光照,大鼠自由饮水采食。本实验得到了河南中医药大学动物伦理委员会的批准(批准号:DWLL20200017)。
1.3 试剂
2,4-二硝基氯苯(DNCB)(上海麦克林生化科技有限公司,批号:C10261168);丙酮、二甲苯、甲醛、无水乙醇(烟台市双双化工有限公司,批号:20140816、20191201、20170201、20200101);苏木素染色液、伊红染色液(上海源叶生物科技有限公司,批号:R20572、R24045);兔链霉卵白素-生物素检测(SP)试剂盒、二氨基联苯胺法(DAB)显色试剂盒(北京中杉金桥生物技术有限公司,批号:SP-9001、ZLI-9018);组胺受体H1(H1R)抗体、蛋白酶激活受体2(PAR-2)抗体、瞬时感受器电位受体1(TRPV1)抗体、丝裂原活化蛋白激酶(P38 MAPK)抗体、磷酸化丝裂原活化蛋白激酶(phospho-P38 MAPK)抗体(北京博奥森生物技术有限公 司,批 号:bs-6663R、bs-1178R、bs-23926R、bs-0637R、bs-0637R);β-肌动蛋白(β-actin)抗体、RIPA裂解液(RIPA Lysis Buffer)、磷酸化蛋白酶抑制剂、BCA蛋白定量检测试剂盒、聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶制备试剂盒、显影定影试剂、ECL化学发光检测试剂盒、辣根过氧化物酶(HRP)标记山羊抗兔二抗(武汉塞维尔生物科技有限公司,批号:GB12001、G2002、G2007、G2026、G2003、G2019、G2014、GB23303)。
1.4 仪器
Secura124-1CN型电子天平(德国公司Sartorius公司);DNM-9606型酶标仪(北京普朗新技术有限公司);RM2235石蜡切片机(德国Leica公司);C1650R-230V型高速冷冻离心机(莱普特科学仪器(北京)有限公司);YD-6D型组织包埋机、YD-A型组织摊片机、YD-B型组织烤片机(金华市科迪仪器设备有限公司);CX23光学显微镜(日本奥林巴斯公司);BV-2型垂直电泳仪、BT-2型转印电泳仪、MX-F型涡旋混合器(武汉赛维尔生物科技有限公司);iBright凝胶成像系统(赛默飞世尔科技公司)。
1.5 方法
1.5.1 湿疹大鼠模型的建立与分组
取60只大鼠按体质量随机分为正常组、模型组、氯雷他定组和龙胆泻肝汤低、中、高剂量组,每组10只。正常组常规饲养,其余各组大鼠选取腹部及背部2 cm×2 cm皮肤面积,脱毛裸露,用微量移液器吸取DNCB-丙酮橄榄油溶液(4:1)100µL于大鼠腹部脱毛区均匀涂抹致敏,1次/天,连续2天。5天后再以0.5%DNCB-丙酮橄榄油溶液100µL于大鼠腹部脱毛区均匀涂抹激发;同时以1% DNCB-丙酮橄榄油溶液5µL于大鼠右耳内外侧耳面均匀涂抹激发,1次/3天,持续15天。氯雷他定组和龙胆泻肝汤低、中、高剂量组大鼠于实验第3天即干预给药。根据人鼠换算公式S大鼠/200g=0.018×S人/70kg,得龙胆泻肝汤剂量为2.52 g/200 g/大鼠(140 g/70 kg/人),即12.6 g·kg-1。故龙胆泻肝汤中剂量组大鼠按12.6 g·kg-1灌胃龙胆泻肝汤水煎液;龙胆泻肝汤低、高剂量组大鼠分别按6.3 g·kg-1(中剂量的0.5倍)、25.2 g·kg-1(中剂量的2倍)灌胃龙胆泻肝汤水煎液;氯雷他定组大鼠按1 mg·kg-1(相当于成人临床剂量的10倍)灌胃氯雷他定溶液;正常组和模型组均灌胃等量蒸馏水,1次/天,连续15天。末次给药24 h后,观察各组大鼠背部皮肤外观情况,然后颈椎脱臼处死,用手术剪沿耳基线剪下左右双耳,于左右耳中部同一位置打孔并取圆形耳片;然后解剖取背部脱毛区皮肤组织,生理盐水冲洗后将组织一分为二,其中一份放置于4%中性甲醛固定;另一份用液氮速冻后置于-80℃下储存备用。
1.5.2 一般情况观察与湿疹严重度评分
观察各组大鼠背部皮肤外观情况并采集图像。大鼠背部皮肤湿疹严重度评分依据赵辨报道的“湿疹面积及严重度指数”(Eczema area and severity index,EASI)评分法[7],略作改动,仅以干预前后出现的红斑、水肿症状变化来判断药物干预情况,合计总分。具体评分标准如下,红斑:无0分,轻微1分,中度2分,中重度3分,重度4分;红肿:无0分,轻度1分,中度2分,中重度3分,重度4分。综合评分为红斑、水肿评分综合。
1.5.3 耳肿胀度和耳肿胀抑制率测定
将圆形耳片置于电子天平上精确称重,并按下列公式计算耳肿胀度和耳肿胀抑制率。

1.5.4 皮肤组织病理学观察
取1.5.1项下固定的皮肤组织,经梯度酒精脱水、二甲苯透明、石蜡包埋、5µm切片等过程制作病理切片,切片经二甲苯脱蜡、苏木素-伊红(Hematoxylin-Eosin,HE)染色,盐酸乙醇分化,梯度酒精脱水、二甲苯透明、中性树胶封片后,光学显微镜下观察皮肤组织病理学变化并于400倍镜下采集图像。大鼠背部皮肤病变程度以Fukuda等提出的组织病理学评分方法为依据[8],略作改动,仅以表皮损伤、增厚、过度角化、真皮水肿及炎症等5个程度进行评分。具体评分标准如下,表皮损伤程度:相对正常0,轻度1,中度2,中度到显著3,显著4;角化过度:相对正常0,轻度1,中度2,中度到显著3,显著4:表皮厚度:相对正常0,轻度1,中度2,中度到显著3,显著4;真皮水肿:相对正常0,轻度1,中度2,中度到显著3,显著4;炎症程度:相对正常0,轻度1,中度2,中度到显著3,显著4。综合评分为表皮损伤、增厚、过度角化、真皮水肿及炎症程度评分的总和。
1.5.5 免疫组化(Immunohistochemistry,IHC)法检测皮肤组织H1R、PAR-2和TRPV1蛋白水平
取1.5.4项下制作的皮肤组织切片,经二甲苯脱蜡、水化后,用柠檬酸盐缓冲液热修复8min,待温度降至室温后切片依次用H2O2孵育10 min,PBS浸洗,山羊血清孵育30min,然后分别滴加H1R(1:100)、PAR-2(1:100)、TRPV1(1:100)抗体,4℃孵育过夜,次日切片复温至37℃后滴加生物素标记的羊抗兔二抗孵育20 min,PBS浸洗,DAB显色10min,自来水冲洗终止。然后苏木素复染3 min,盐酸乙醇分化,自来水再次冲洗,切片经乙醇梯度脱水、二甲苯透明、中性树胶封片后镜检。每只大鼠皮肤组织切片在400倍镜下随机选取1个视野,以棕黄色为阳性染色,采用Image-Pro Plus 6.0测定每个视野中平均光密度值(Average optical density value,AOD)值进行统计分析。
1.5.6 蛋白质印迹(Western blotting,WB)法检测皮肤组织P38 MAPK、phospho-P38 MAPK(p-P38MAPK)蛋白水平
取1.5.1项下冻存的皮肤组织,匀浆后提取总蛋白,十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分离,转模,P38MAPK(1:1000),p-P38MAPK(1:1000)抗体4℃孵育过夜,TBST漂洗3次,每次5 min;二抗稀释后室温孵育30 min,TBST漂洗3次,每次5min。以β-actin为内参,ECL试剂盒显影成像,采用Image J软件测定条带灰度值,通过比较目标条带p-P38MAPK/P38MAPK灰度值比值来分析P38MAPK磷酸化水平。
1.5.7 统计方法
采用SPSS 22.0软件进行统计分析,计量资料以均数±标准差(xˉ±s)表示,多组间比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用最小显著性差异法(LSD)检验,方差不齐者采用Dennett’s检验;计数资料用百分率表示,采用卡方检验,以P<0.05表示差异具有统计学意义。实验流程图见图1。

图1 实验流程图
2 结果
2.1 龙胆泻肝汤对大鼠耳肿胀度的影响
与正常组比较,模型组大鼠耳肿胀度显著增加(P<0.05);与模型组比较,氯雷他定组和龙胆泻肝汤低、中、高剂量组大鼠耳肿胀度显著减少(P<0.05),耳肿胀抑制率显著增加(P<0.05);与氯雷他定组比较,龙胆泻肝汤低剂量组大鼠耳肿胀度显著增加(P<0.05),耳肿胀抑制率显著减小(P<0.05);与龙胆泻肝汤低剂量组比较,龙胆泻肝汤中、高剂量组大鼠耳肿胀度显著减少(P<0.05),耳肿胀抑制率显著增加(P<0.05)(表1)。

表1 龙胆泻肝汤对大鼠耳肿胀度的影响(xˉ±s,n=10)
2.2 龙胆泻肝汤对大鼠背部皮肤外观及组织形态学的影响
正常组大鼠存活状况较好,皮肤平滑、完好,未见任何异常;模型组大鼠背部造模区皮肤出现红肿、丘疹和水疱,与皮肤溃烂、渗出等湿疹表现一致;龙胆泻肝汤低、中、高剂量组和氯雷他定组大鼠背部造模区皮肤肿胀,其表面溃烂和渗透情况均有所减轻,丘疹和水疱不同程度消失,皮肤较模型组更平滑。与正常组比较,模型组大鼠皮肤EASI评分显著增加(P<0.05);与模型组比较,氯雷他定组和龙胆泻肝汤低、中、高剂量组大鼠皮肤EASI评分显著减小(P<0.05);与氯雷他定组比较,龙胆泻肝汤低剂量组大鼠皮肤EASI评分显著增加(P<0.05);与龙胆泻肝汤低剂量组比较,龙胆泻肝汤中、高剂量组大鼠皮肤EASI评分显著减小(P<0.05)。HE染色结果显示,模型组大鼠背部皮肤表皮厚度较正常组显著增加,并呈现网状及海绵样水肿,毛囊口处亦可见有角栓;真皮层血管轻度扩张,充血;氯雷他定组大鼠背部皮肤表皮有轻度增厚,未出现泡沫状水肿和空泡;龙胆泻肝汤低、中、高剂量组大鼠背部皮肤表皮轻度增厚,并伴有轻度海绵样肿胀。与正常组比较,模型组大鼠皮肤组织病理评分显著增加(P<0.05);与模型组比较,氯雷他定组和龙胆泻肝汤低、中、高剂量组大鼠皮肤组织病理评分显著减小(P<0.05);与氯雷他定组比较,龙胆泻肝汤低、中剂量组大鼠皮肤组织病理评分显著增加(P<0.05);与龙胆泻肝汤低剂量组比较,龙胆泻肝汤中、高剂量组大鼠皮肤组织病理评分显著减小(P<0.05)(图2-图3、表2)。
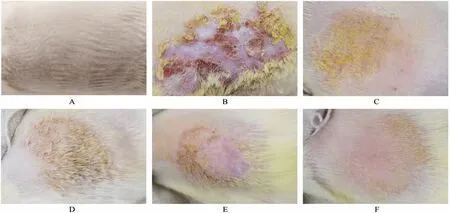
图2 龙胆泻肝汤对大鼠背部皮肤外观的影响
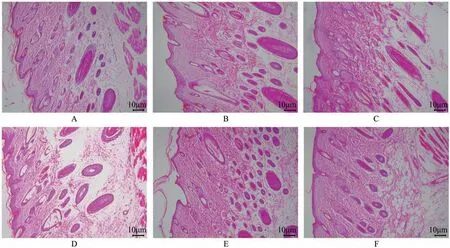
图3 龙胆泻肝汤对大鼠背部皮肤组织形态学的影响(HE,×400)

表2 龙胆泻肝汤对大鼠背部皮肤EASI及病理评分的影响(xˉ±s,n=10)
2.4 龙胆泻肝汤对大鼠皮肤组织H1R、PAR-2、TRPV1蛋白水平的影响
免疫组化结果显示,正常组皮肤组织中有少量H1R、PAR-2、TRPV1表达。与正常组比较,模型组皮肤组织中有大量H1R、PAR-2、TRPV1表达,AOD值均显著增加(P<0.05);与模型组比较,氯他雷定组和龙胆泻肝汤低、中、高剂量组皮肤组织有少量H1R、PAR-2、TRPV1表达,AOD值均显著减小(P<0.05);与氯他雷定组比较,龙胆泻肝汤低、中剂量组皮肤组织有大量H1R、PAR-2、TRPV1表达,AOD值均显著增加(P<0.05);与龙胆泻肝汤低剂量组比较,龙胆泻肝汤高剂量组皮肤组织有少量H1R、PAR-2、TRPV1表达,AOD值均显著减小(P<0.05)(图4、表3)。
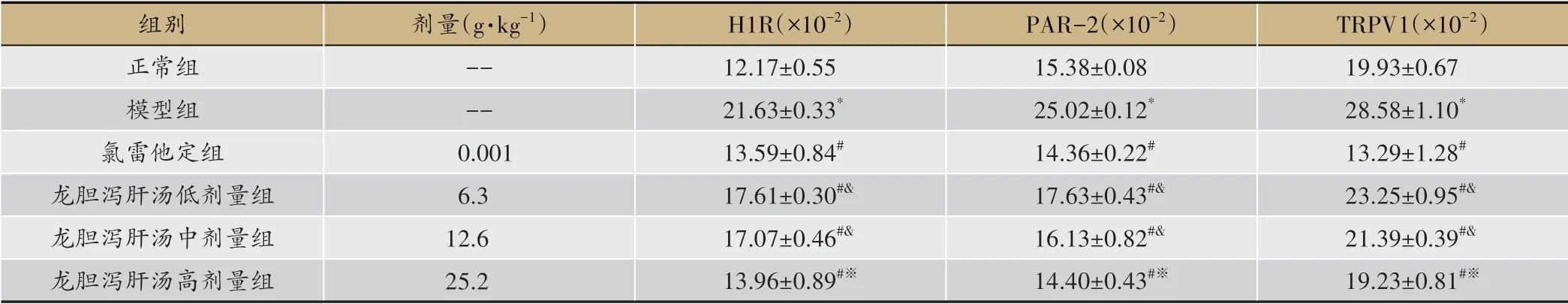
表3 龙胆泻肝汤对大鼠皮肤组织H1R、PAR-2、TRPV1蛋白免疫组化AOD值的影响(xˉ±s,n=10)

图4 龙胆泻肝汤对大鼠皮肤组织H1R、PAR-2、TRPV1蛋白水平的影响(免疫组化,×400)
2.5 龙胆泻肝汤对大鼠皮肤组织P38MAPK、p-P38MAPK蛋白水平的影响
WB结果显示,与正常组比较,模型组皮肤组织p-P38MAPK/P38MAPK比值显著增加(P<0.05),氯雷他定组和龙胆泻肝汤低、中、高剂量组皮肤组织p-P38MAPK/P38MAPK比值显著减小(P<0.05);与模型组比较,氯雷他定组和龙胆泻肝汤低、中、高剂量组皮肤组织p-P38MAPK/P38MAPK比值显著减小(P<0.05)。与氯雷他定组比较,龙胆泻肝汤中、高剂量组皮肤组织p-P38MAPK/P38MAPK比值显著减小(P<0.05)。与龙胆泻肝汤低剂量组比较,龙胆泻肝汤中、高剂量组皮肤组织p-P38MAPK/P38MAPK比值显著减小(P<0.05)(图5、表4)。
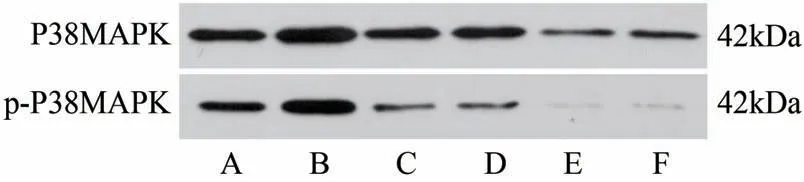
图5 龙胆泻肝汤对大鼠皮肤组织P38MAPK、p-P38MAPK蛋白水平的影响(WB)
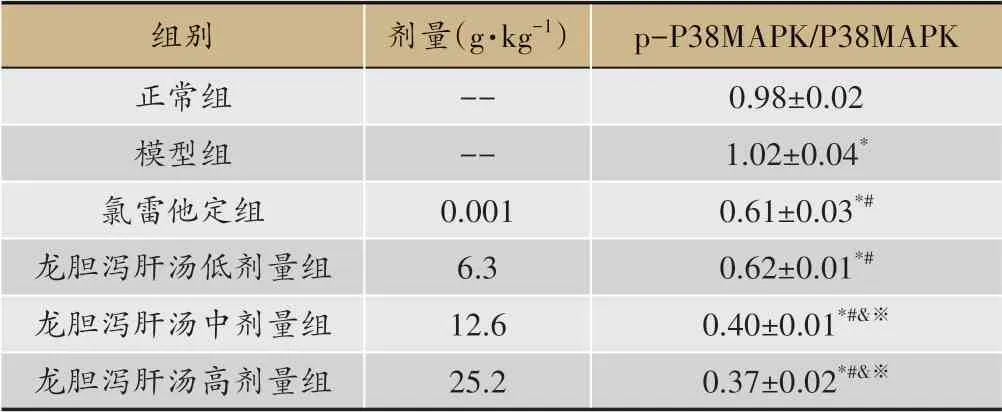
表4 龙胆泻肝汤对大鼠皮肤组织p-P38MAPK/P38MAPK比值的影响(xˉ±s,n=10)
3 讨论
湿疹是一种慢性过敏性皮肤病[9],以红肿、瘙痒、剥皮、皮肤增厚等为主要特征。本研究应用高浓度DNCB涂抹腹部致敏,低浓度DNCB涂抹背部、耳部激发的方式复制了大鼠湿疹模型,结果发现湿疹大鼠耳部肿胀,皮肤表皮增厚、角化,有大量炎性细胞浸润于皮肤真皮层,表明造模成功。该模型背部及耳廓局部病理特征与人类湿疹相似,是一种评价药物疗效的理想动物模型。
龙胆泻肝汤是临床上清肝胆实火,降肝胆湿热的常用方剂,方中龙胆草、黄芩、栀子性凉,可清湿热,泻实火;泽泻、木通、车前子利湿解毒;生地清热凉血;当归滋养阴血以柔肝;柴胡疏之;甘草性味甘、平,清热解毒,可调和诸药,益气和中[10]。氯雷他定属抗组胺类药品,被机体快速吸收后可以阻止组胺与H1受体结合,抑制机体内炎症介质的释放,以达到缓解病状的作用[11]。因氯雷他定为当前临床治疗湿疹的常用药物之一,故本研究以此药为阳性对照来考察龙胆泻肝汤对湿疹大鼠的干预作用,结果显示龙胆泻肝汤和氯雷他定均能降低湿疹大鼠耳肿胀度,并不同程度地减轻皮肤组织海绵样水肿及炎性细胞浸润程度,且12.6 g·kg-1和25.2 g·kg-1剂量的龙胆泻肝汤的干预程度与氯雷他定相当,表明了龙胆泻肝汤对湿疹大鼠具有较好地干预作用。
机体痒觉的出现由组胺依赖和非组胺依赖的两条痒信号通路共同参与,其中组胺依赖的痒信号通路由机械刺激不敏感的无髓鞘C-纤维(Mechanicallyinsensitive C-fibers,CMi)介导;非组胺依赖的痒信号通路由机械热敏感的C-纤维(Mechano-heat-sensitive C fibers,CMHs)介导[12]。在组胺激活的痒信号通路中,H1R发挥重要作用,H1R通过激活磷脂酶C(Phospholipase C,PLC)和磷脂酶A2(Phospholipase A2,PLA2),进一步激活下游TRPV1通道[13]。二酰基甘油(Diacylglycerol,DAG)作为PLC的水解产物还可结合TRPV1的辣椒素位点,从而将TRPV1通道激活[14-15]。非组胺依赖的痒信号通路中PAR2是最先鉴定和激活的受体分子,然后PAR2依次激活PLC和下游的蛋白激酶C,从而使TRPV1介导的离子内流增加;PAR2还可以通过激活蛋白激酶A来增加TRPV1活性[16],而激活的TRPV1可以激活细胞因子,参与痒觉调节。本研究结果显示湿疹大鼠背部皮肤组织中H1R、PAR-2、TRPV1蛋白表达水平升高,提示湿疹瘙痒的产生与H1R、PAR-2/TRPV1信号通路的上调有关,而龙胆泻肝汤和氯雷他定均可以抑制H1R、PAR-2、TRPV1蛋白的表达,从而发挥抗瘙痒的作用,且25.2 g·kg-1剂量的龙胆泻肝汤对H1R、PAR-2/TRPV1信号通路的抑制作用与氯雷他定相当。
P38MAPK信号通路是一种重要的信号转导通路,该信号通路在真核生物的进化中相对保守,参与细胞分化、细胞凋亡及炎症等进程[17-18]。该通路由典型的三级由促分裂原活化的蛋白激酶激酶(Mitogenactivated protein kinase kinase,MAPKK)、促分裂原活化的蛋白激酶激酶激酶(Mitogen-activated protein kinase kinase kinase,MAPKKK)及P38MAPK组 成。MAPKKK首先磷酸化激活MAPKK,活化的MAPKK接着磷酸化激活P38MAPK,活化的P38MAPK激活下游因子[19-20]。P38MAPK在去磷酸化状态下无生物学活性,只有在磷酸化状态(p-P38MAPK)才能与底物结合,从而引起一系列病理变化[21-24]。本实验结果显示湿疹发生时p-P38MAPK/P38MAPK比值增加,表明P38MAPK磷酸化水平升高,而龙胆泻肝汤则可以降低P38MAPK磷酸化水平,下调P38MAPK信号通路,从而发挥抗炎作用,且12.6 g·kg-1和25.2 g·kg-1剂量的龙胆泻肝汤对P38MAPK信号通路的抑制作用均强于氯雷他定。
本实验小结如下:①龙胆泻肝汤能够降低湿疹大鼠耳肿胀程度,减轻皮肤组织海绵样水肿及炎性细胞浸润程度,表明了龙胆泻肝汤对湿疹大鼠具有较好地治疗作用。②湿疹大鼠背部皮肤组织中H1R、PAR-2、TRPV1蛋白表达水平升高,提示湿疹瘙痒的产生与H1R、PAR-2/TRPV1信号通路的上调有关,而龙胆泻肝汤可以抑制H1R、PAR-2、TRPV1蛋白的表达,从而发挥抗瘙痒的作用。③湿疹的发生与P38MAPK的磷酸化水平相关,而龙胆泻肝汤则可以降低P38MAPK磷酸化水平,下调P38MAPK信号通路,从而发挥抗炎作用。④6.3g·kg-1剂量的龙胆泻肝汤对湿疹的干预作用弱于氯雷他定,12.6 g·kg-1和25.2 g·kg-1剂量的龙胆泻肝汤对湿疹的干预作用与氯雷他定相仿。以上观点为龙胆泻肝汤在湿疹治疗领域的深入开发利用提供了实验依据。
辨证论治是中医精髓所在,湿疹临床治疗也要审证求因,做到药证相对。与H1受体拮抗药和糖皮质激素比较,龙胆泻肝汤可针对湿疹病症辨证调体,除湿去热,对湿疹的治疗效果显著,且在止痒、抗炎两个层面均优于传统西药,但由于方药组成复杂,难以明确其止痒和抗炎的有效成分,亦或是多种成分共同作用,故为防治湿疹寻找更精准有效的中医药疗法将是本课题组以后的研究方向。

