一步法制备烯丙基糖苷研究
刘文清
(河北科技大学化学与制药工程学院,河北石家庄 050018)
烯丙基是一位“多才多艺”的明星官能团,其结构中的双键,可发生多种化学反应:如环氧化、双羟基化、环加成、巯烯点击化学等(如图1所示)。众所周知,复杂多糖的结构改造往往始于其基本组成砌块如单糖或二糖的化学修饰,而其中还原端烯丙基化是合成多种新型糖缀合物的重要步骤[1-2]。因此,烯丙基糖苷在糖化学合成中扮演着重要角色[3-4]。

图1 烯丙基在化学合成中的多样性
文献报道的烯丙基糖苷的合成方法按反应机理的不同分为2大类(如图2所示),第1大类方法是通过氧鎓离子发生端位碳上亲核加成的糖基化反应,有3种合成方式。其一,是未被保护的糖在酸催化下直接与醇反应生成相应的糖苷,即Fischer糖基化反应。通常情况下,反应以醇为溶剂,加热回流,一般得到吡喃糖苷、呋喃糖苷以及少量开环产物的混合物。常用的酸催化剂有CF3SO3H,CF3COOH或H+型磺酸树脂等质子酸[5-9],也有使用BF3·Et2O等路易酸的报道[10]。这种方法的缺点是,反应常局限于低沸点的醇,并且反应受端基效应的影响,主要生成α-吡喃糖苷[11-13]。其二,是被保护基保护的卤代糖,其端基的溴或氯在重金属盐(Ag2CO3或HgO)作用下活化,与醇反应生成相应的糖苷,即Koenigs-Knorr糖基化。该方法通过C-2酯基的邻基参与效应,可选择性得到1,2-trans-糖苷,尤其是获取Fischer反应难以得到的β吡喃糖苷[14]。但这种方法的不足之处在于,反应步骤较长,总收率只有44%~65%[15]。其三,是全酰基保护的糖,其端位乙酸酯在路易斯酸(如BF3·Et2O,TMSOTf或FeCl3)作用下活化,通过C-2相邻酯基的参与,与醇反应生成1,2-trans-糖苷[16-17],即Helferich糖基化反应。该方法一般适用于结构简单的糖,反应收率较高[18-20]。第2大类方法是端基O-发生亲核取代的烷基化反应,以不加保护基的糖为起始原料,烯丙基溴为烷基化试剂,在NaH碱性条件下,可得到β异构体为主的烯丙基糖苷[21]。该方法条件温和,操作简便,路线相对较短。但反应使用高沸点溶剂,导致后处理纯化困难,常需增加一步乙酰化来提纯产物,给操作带来不便。
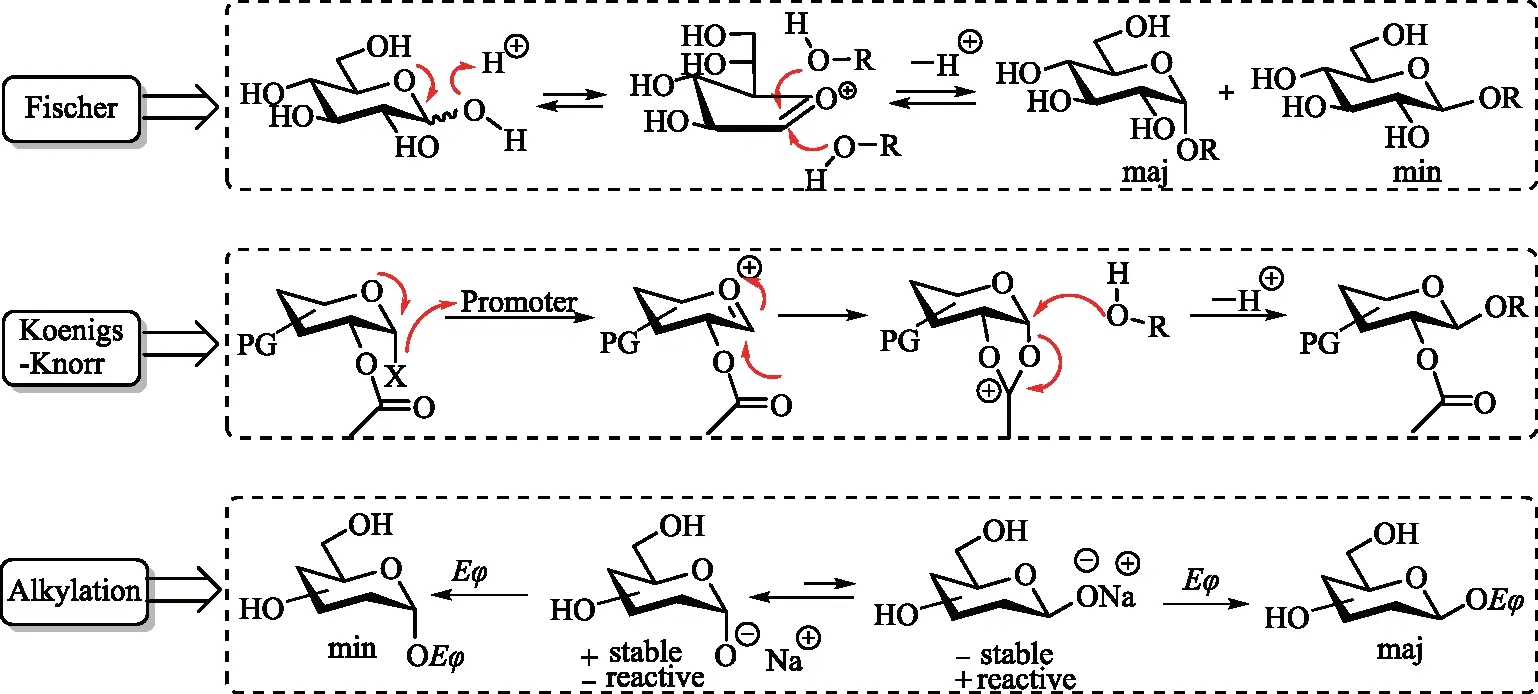
图2 烯丙基糖苷的合成机理
为了解决烯丙基糖苷现有合成方法步骤较长、后处理困难等问题,可以从2方面入手进行研究。一方面,采用更加有优势的端基O-烷基化的合成方法,根据端位半缩醛羟基的pKa值小于其他羟基pKa值,从而在碱作用下可以选择性地得到目标化合物;另一方面,考虑到糖易溶于水的特性,摒弃高沸点的有机溶剂,而选择水为反应溶剂,从而提高溶解度,促进反应高效进行,并且简化后处理纯化过程。
本研究设计以不加保护基团的糖为起始物,以水为溶剂,在碱性条件下,以烯丙基溴为烷基化试剂,经一步反应得到烯丙基糖苷目标化合物。常见的不加保护基的单糖或二糖,商品廉价易得,水为反应溶剂更加绿色环保,尽管反应为非均相体系,但通过增大搅拌速度,可促进反应进行。在碱性环境中,反应主要生成以动力学控制的β异构体产物。该合成方法基于糖端位O-烷基化的反应机制,从反应选择性、溶解度和后处理纯化等方面综合考虑,通过一步法实现路线短、反应高效、后处理简单的目标,反应如图3所示。

图3 烷基化反应合成烯丙基糖苷
1 实验部分
1.1 主要仪器与试剂
341型旋光仪(美国珀金埃尔默公司提供),Bruker AV-400型核磁共振仪(瑞士布鲁克公司提供),MicrOTOF-Q高分辨质谱仪(瑞士布鲁克公司提供)。
烯丙基溴、D-葡萄糖、D-半乳糖、D-乳糖、D-纤维二糖、N-乙酰基D-葡萄糖胺,均购自阿拉丁试剂有限公司;其他试剂由天津市永大化学试剂有限公司提供。
1.2 实验方法
在烯丙基糖苷的制备过程中,按照投料量为n(糖)∶n(烯丙基溴)∶n(NaOH) = 1∶2∶1.25反应,以水为反应溶剂,糖的浓度为0.18 mol/L。首先将烯丙基溴加入到一定量糖的水溶液中,再缓慢滴加NaOH溶液(c=1.1 mol/L),0.5 h滴毕,室温反应约8 h。采用TLC(展开剂V(乙酸乙酯)∶V(甲醇)=7∶3)监测反应进程。反应液用有机溶剂(乙酸乙酯或正己烷)萃取除去过量的烯丙基溴,水相减压浓缩后干燥,经重结晶(醇类溶剂)或柱层析纯化(洗脱剂V(乙酸乙酯)∶V(甲醇)=8∶2~5∶5)得到目标化合物。
1.2.1 烯丙基β-D-吡喃葡萄糖苷的制备

1.2.2 烯丙基β-D-吡喃半乳糖苷的制备

1.2.3 烯丙基2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖苷的制备

1.2.4 烯丙基β-D-吡喃葡萄糖基-(1→4)-β-D-吡喃葡萄糖苷的制备

1.2.5 烯丙基β-D-吡喃半乳糖基-(1→4)-β-D-吡喃葡萄糖苷的制备

2 结果与讨论
2.1 碱的种类选择
以纤维二糖的烯丙基化反应考查了碱的种类对反应的影响,如表1所示。选取Cs2CO3,Bu4NOH,LiOH,KOH和NaOH 5种碱,以反应收率和2种异构体的比例来分析实验结果。

表1 碱的种类对反应收率的影响
由表1实验结果可知,加入Cs2CO3反应不发生;以LiOH为碱的反应收率最高,β异构体的比例也最大;反应中加入NaOH的收率略低于LiOH,而β∶α的比例与之相当。
通常,在端位烷基化反应中,主要得到反应活性更高的平伏键异构体产物(β吡喃糖)。SCHMIDT课题组的ZHU等[22]报道指出Na+对于反应的立体选择性至关重要,这归因于Na+可与端位烷氧负离子发生螯合作用,从而有助于促进其β异构体的形成。相反,若反应中加入冠醚,则螯合作用消失,此时反应更倾向于生成稳定性更高的α异构体产物。这一现象在VAUZEILLES等[21]和LUBINEAU等[23]均有报道。
因此,从反应成本、产物收率及选择性角度综合考虑,最终选择NaOH为该反应的碱。
2.2 碱的用量选择
以纤维二糖的烯丙基化反应来考查NaOH的用量影响,选取1.05,1.25,1.50,3.00 mmol这4种投料量,以反应收率来分析实验结果,见表2。
由表2可知,NaOH用量在1.05 mmol时,反应的起始原料较多,反应时间较长,反应进行不完全;当使用量增大到3.00 mmol时,反应原料基本消失,但反应产生了更多的副产物。因此,选择在NaOH用量为1.25 mmol时进行反应,收率较高。

表2 碱的用量对反应收率的影响
在优化碱的用量实验中,同步通过TLC观察反应时间对反应结果的影响。结果显示,随着反应时间延长,反应进行程度越大,但超过8 h,副产物逐渐增多,因此,最终确定反应时间为8 h。
2.3 后处理优化
由于反应是在水相中进行,产物又溶于水,为寻找高效简便的后处理方式,尝试以下3种方法(见表3)。

表3 反应的后处理方法优化
3 结 语
以探索更加高效简便的烯丙基糖苷合成方法为研究目标,通过分析糖端位O-烷基化的反应机理,从反应的区域选择性、溶解度和后处理纯化等方面进行方法设计和条件优化。反应的区域选择性方面:根据端位半缩醛羟基的pKa值小于其他羟基pKa值,采用氢氧化钠这一廉价易得的碱,选择性得到以β异构体为主的端位烯丙基糖苷。溶解度方面:考虑糖易溶于水的特性,选择水为反应溶剂更加绿色环保,提高溶解度,促进反应高效进行。后处理纯化方面:使用低毒的乙酸乙酯萃取过量的烯丙基溴,再经减压浓缩、干燥后,经重结晶或柱层析纯化,操作简单易行。通过反应条件优化,确定了n(糖)∶n(烯丙基溴)∶n(氢氧化钠)=1∶2∶1.25,室温反应8 h,合成了5种烯丙基糖苷目标化合物,反应收率在72%~90%,实现了一步法快速高效制备烯丙基糖苷的目标(见表4)。

表4 烯丙基糖苷反应结果
完成了水相中一步法制备烯丙基糖苷的研究工作,相较于传统的Fisher或Koenigs-Knorr等糖基化反应,该方法条件温和,操作简便,高效快捷,为进一步构建结构复杂的糖缀合物提供了一种新的合成思路。未来还需要针对该方法的后处理过程开展深入研究,重点优化重结晶等适合工业化的分离提纯方式,不断提升其工业应用价值。

