一测多评法同时测定外用金黄散提取物中7种成分的含量
肖新玉,杨小燕,施文婷,张兰兰
(1.佛山市南海区人民医院,广东 佛山 528225;2.广东一方制药有限公司,广东 佛山 528225)
外用金黄散是佛山市南海区人民医院根据中医药理论为基础,由多年临床经验总结而成的有效方剂,基础方源于明代陈实功所著《外科正宗》,由大黄、黄柏、姜黄、白芷、天花粉、生天南星、苍术、厚朴、陈皮、甘草十味药组成,具有清热燥湿、活血化瘀、消肿止痛、收湿敛疮的功效,临床上主要用于痛风性关节炎、急性乳腺炎、急性阑尾炎等的治疗[1-2]。外用金黄散在原方基础上增加了乳香、冰片等四味药材,增强了活血化瘀、消肿生肌的功效。目前,关于金黄散的研究较多集中于提取工艺和药理作用方面[3-6];2020年版《中国药典》规定如意金黄散的定量指标为姜黄素、小檗碱、芦荟大黄素、大黄酸、大黄素、大黄酚、和大黄素甲醚7种,采用3种色谱方法,较为复杂[7];姚远等[8]采用超高效液相色谱-质谱联用(UPLC-MS)法同时测定如意金黄散中12种成分,所需对照品种类较多,检测成本较高。
一测多评法(quantitative analysis of multicomponents by single-marker,QAMS)借助相对校正因子,只需测定一个成分(内标物),可实现对多个有效成分的定量分析,在提高检测效率的同时降低了检测成本,已在中药质量控制方面得到广泛应用[9]。QAMS法在建立过程中,需要通过测定内标物与其他待测成分的峰面积和浓度,计算内标物与其他待测成分的相对校正因子,相对校正因子是实现QAMS法的关键参数,所以在建立该方法时相对校正因子的取值标准选择尤为重要。此外,计算值与外标法实测值之间的相似程度还与选定的内标物与其他待测成分间化学结构和理化性质的差异关系密切[10]。本研究通过建立一测多评法,以芦荟大黄素为内标物,同时测定外用金黄散提取物中甘草苷、橙皮苷、甘草酸、大黄酸、欧前胡素和大黄素甲醚的含量,以期为外用金黄散提取物的质量控制及后续研究提供参考。
1 仪器与试药
1.1 仪器
Thermo U3000型高效液相色谱仪(美国赛默飞公司);Waters Arc型高效液相色谱仪(美国沃特世公司);Milli-Q Direct型超纯水系统(德国默克公司);XP26型百万分之一天平、ME204E型万分之一天平(瑞士梅特勒-托利多仪器有限公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
甘草苷(批号:111610-201908,纯度为95.0%)、橙皮苷(批号:110721-202019,纯度为95.3%)、甘草酸铵(批号:110731-202021,纯度为96.2%)、芦荟大黄素(批号:110795-201710,纯度为98.3%)、大黄酸(批号:110757-201607,纯度为99.3%)、欧前胡素(批号:110826-201918,纯度为99.0%)、大黄素甲醚(批号:110758-201817,纯度为99.2%)对照品均购自中国食品药品检定研究院;乙腈、甲醇为色谱纯(德国默克公司);磷酸为色谱纯(天津市科密欧化学试剂有限公司);其他试剂为分析纯。9批外用金黄散提取物(编号:S1~S9)由广东一方制药有限公司制备。
2 方法与结果
2.1 色谱条件[11]
色谱柱:Waters Xbridge C18柱(250 mm×4.6 mm,5.0 μm);流动相:乙腈(A)-0.1%磷酸溶液(B)梯度洗脱(0~16 min,19%~24%A;16~20 min,24%~30%A;20~30 min,30%~46%A;30~42 min,46%~55%A;42~60 min,55%~62%A;60~65 min,62%~19%A;65~70 min,19%A;);检测波长:280 nm(0~20 min,甘草苷、橙皮苷)、254 nm(20.01~70 min,甘草酸、芦荟大黄素、大黄酸、欧前胡素、大黄素甲醚);柱温:30℃;进样量:10 μL;流速:1.0 mL/min。
2.2 对照品溶液的制备
分别取甘草苷、橙皮苷、甘草酸铵、芦荟大黄素、大黄酸、欧前胡素、大黄素甲醚对照品适量,精密称定,加甲醇定容,制成质量浓度分别为92.598 6、77.334 8、65.154 6、72.999 8、85.880 0、64.184 6、66.844 8 μg/mL的混合对照品储备液(甘草酸质量=甘草酸铵质量/1.0207)。
2.3 供试品溶液的制备
取外用金黄散提取物约0.4 g,精密称定,置50 mL具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定质量,超声处理(功率250 W,频率40 kHz)30 min,取出,放冷后再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.4 方法学考察
2.4.1 专属性试验分别精密吸取对照品、供试品、阴性样品溶液,按“2.1”项下色谱条件进样测定,结果见图1。可见,各成分色谱峰均具有良好的分离度,与对照品色谱峰保留时间一致,并且未在相应阴性样品中检测出,表明该方法专属性良好。
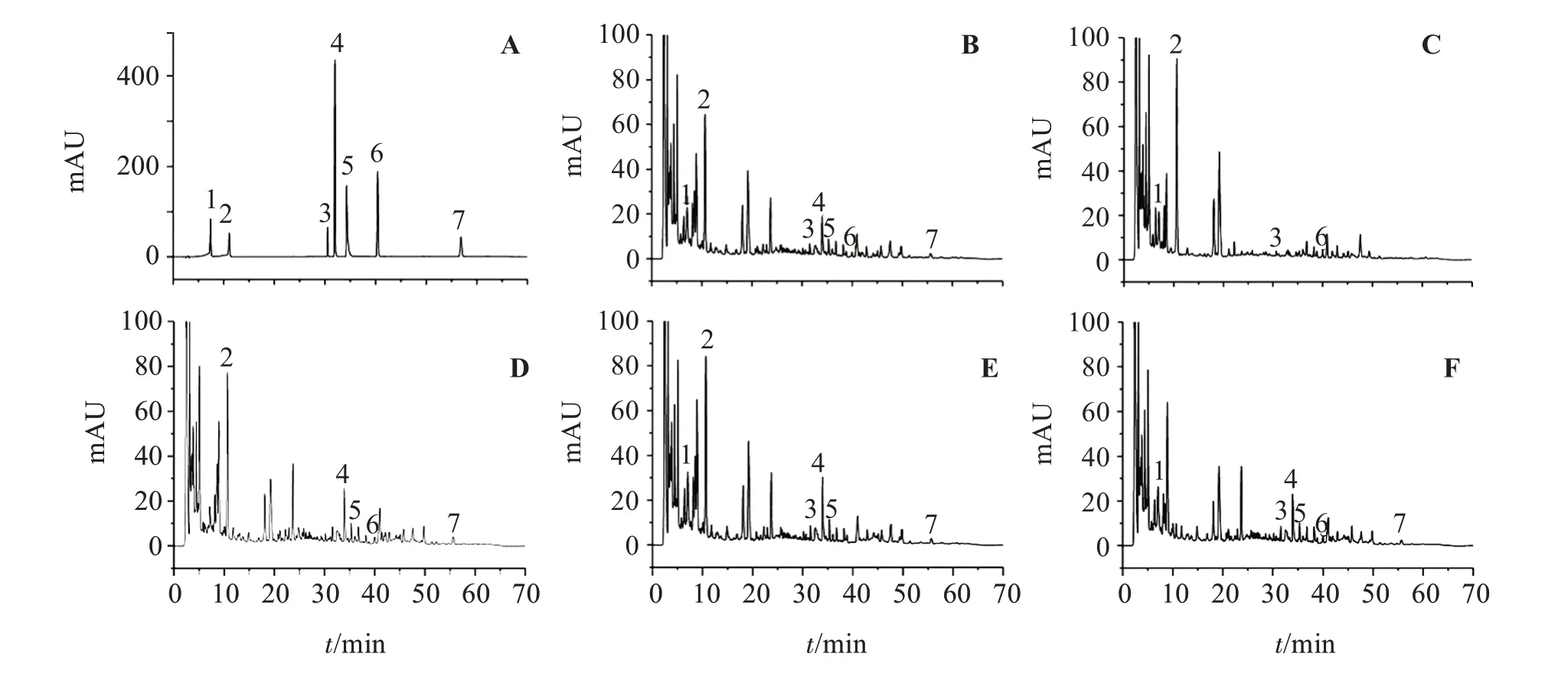
图1 专属性试验HPLC色谱图Figure 1 HPLC chromatogram of specificity test
2.4.2 线性关系考察分别精密吸取“2.2”项下混合对照品溶液,加甲醇稀释制成系列浓度的混合对照品溶液,按“2.1”项下色谱条件进样测定,记录甘草苷、橙皮苷、甘草酸、芦荟大黄素、大黄酸、欧前胡素、大黄素甲醚的峰面积。以对照品溶液质量浓度为横坐标(x),峰面积为纵坐标(y)进行线性回归,结果见表1,表明各成分在各自质量浓度范围内均呈良好的线性关系。
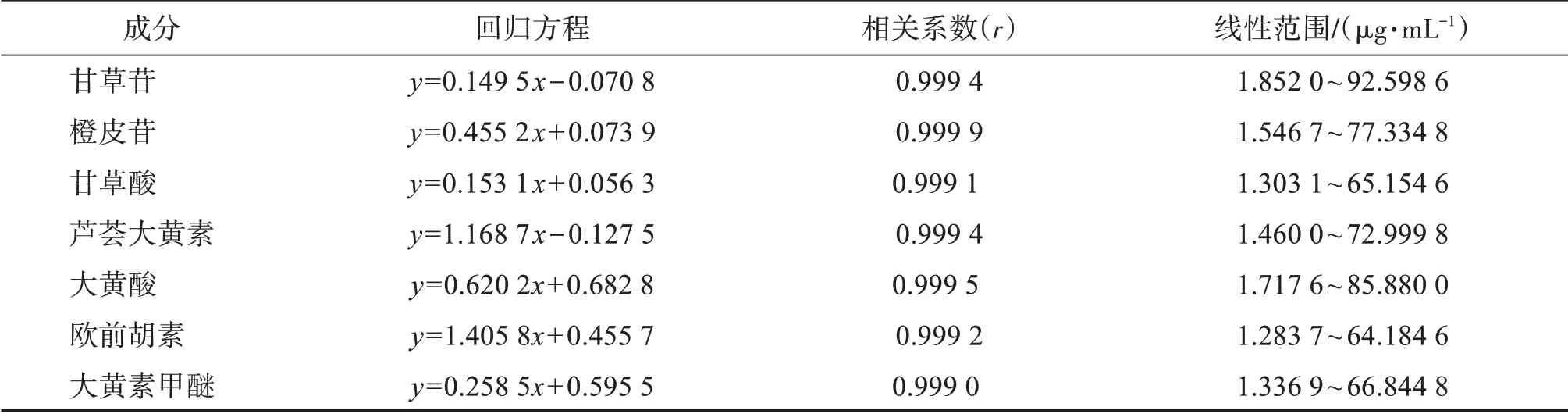
表1 线性关系考察结果Table 1 Results of linear relationship investigation
2.4.3 精密度试验精密吸取“2.2”项下混合对照品溶液,按“2.1”项下色谱条件连续进样6次,计算得各色谱峰峰面积的RSD均小于3%,表明仪器精密度良好。
2.4.4 重复性试验取外用金黄散提取物(编号:S1),精密称定,按“2.3”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进样测定,计算得各色谱峰峰面积的RSD均小于3%,表明方法重复性良好。
2.4.5 稳定性试验取外用金黄散提取物(编号:S1),精密称定,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件分别于制备0、2、4、8、12、24 h后进样测定,计算得各色谱峰峰面积的RSD均小于3%,表明供试品溶液在24 h内稳定性良好。
2.4.6 加样回收率试验取同一批次已知成分含量的外用金黄散提取物共9份,分为3组,每份取约0.2 g,精密称定后置于锥形瓶中,分别按低、中、高浓度精密加入混合对照品溶液适量,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,记录峰面积,计算加样回收率及RSD,结果见表2。结果显示,各成分的平均加样回收率分别是:甘草苷101.6%(RSD=1.81%)、橙皮苷99.8%(RSD=2.44%)、甘草酸99.3%(RSD=1.90%)、芦荟大黄素97.7%(RSD=2.42%)、大黄酸97.7%(RSD=2.91%)、欧前胡素101.0%(RSD=3.30%)和大黄素甲醚99.1%(RSD=1.60%),表明该方法准确度良好。
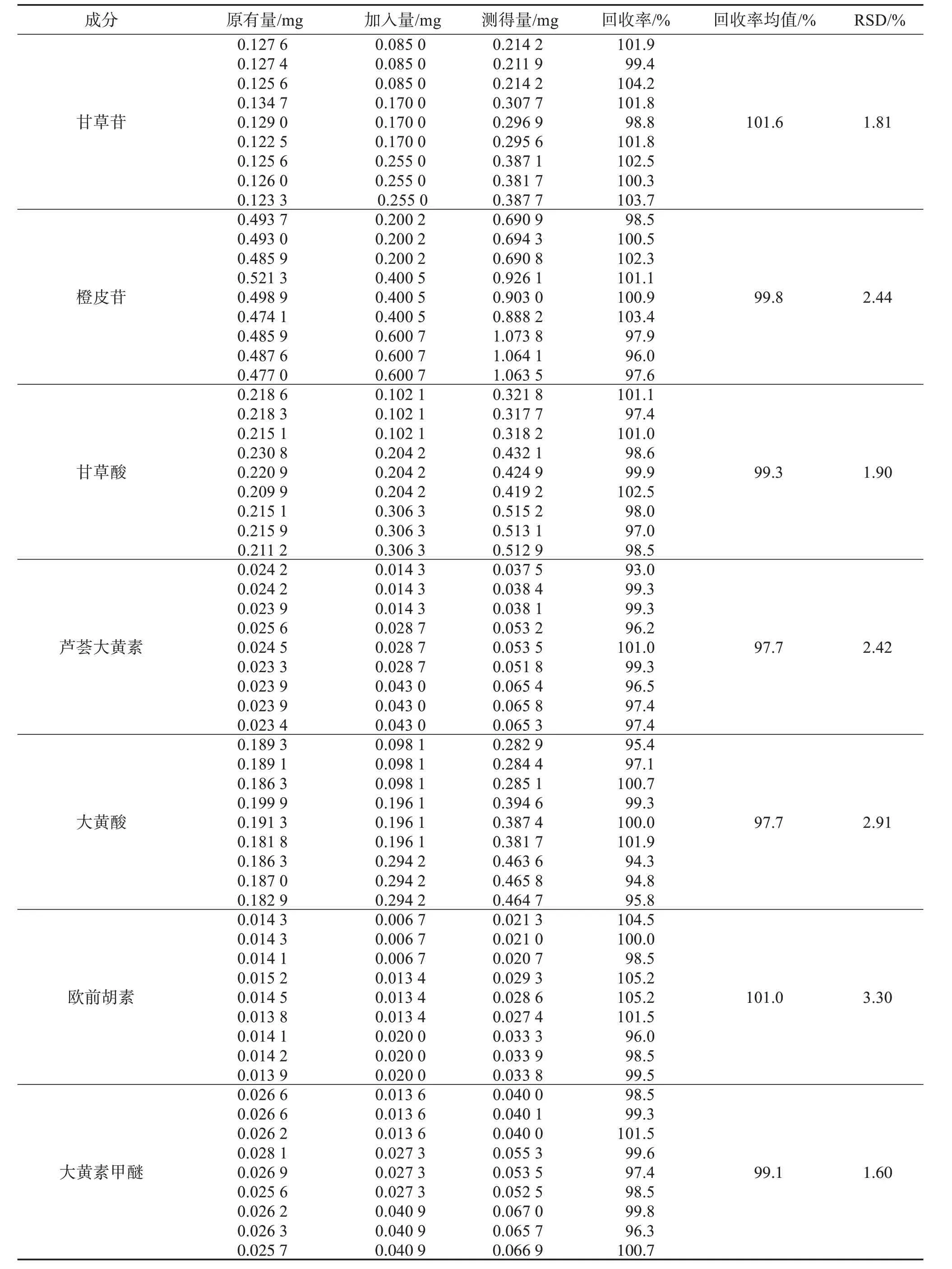
表2 外用金黄散提取物中7种成分的加样回收率试验结果Table 2 Test results of sample addition recovery rate of 7 components in Jinhuang powder for external use
2.5 相对校正因子的确定[12-13]
精密吸取“2.4.2”项下混合对照品溶液,按“2.1”项下色谱条件进样测定,以芦荟大黄素为内标物,计算其他6种成分的相对校正因子(fs/k),公式为fs/k=fs/fk=(As×Ck)/(Ak×Cs),其中As为内标物峰面积,Cs为内标物质量浓度,Ak为待测成分峰面积,Ck为待测成分质量浓度,结果见表3。
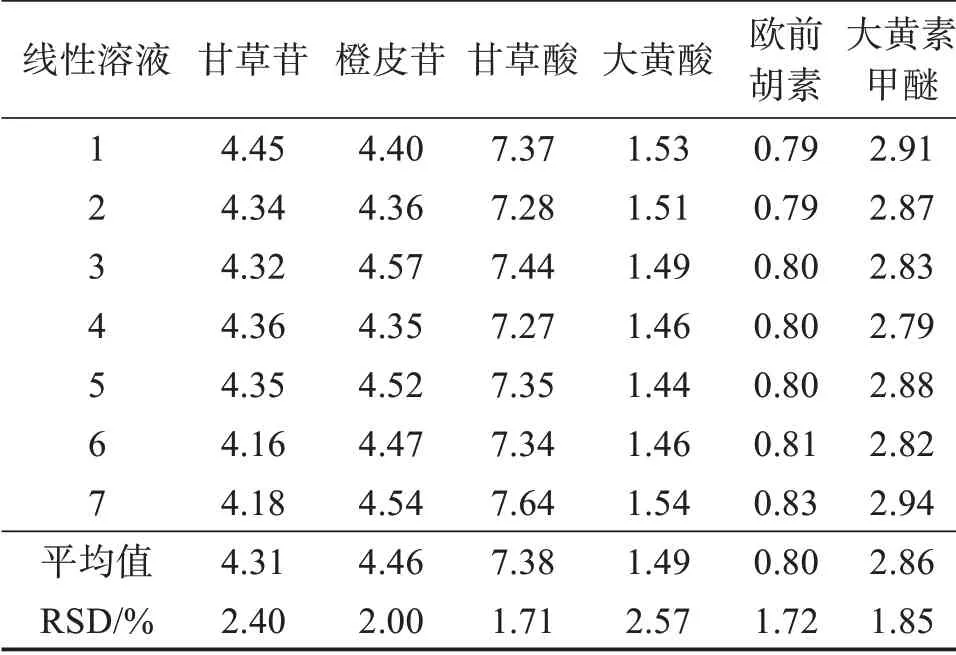
表3 不同浓度对照品溶液中各成分的相对校正因子Table 3 Relative correction factors of various constituents of different concentration of standard sample solution(n=7)
2.6 耐用性和系统适应性研究
2.6.1 不同色谱系统及色谱柱对相对校正因子的影响[14]以芦荟大黄素为内标物,考察其他6种成分在Waters Arc型、Thermo U3000型2种高效液相色谱系统,以及Waters Xbridge C18(250 mm×4.6 μm,5 μm)、YMC Triart C18(250 mm×4.6 μm,5 μm)、Agilent ZORBAX Extend-C18(250 mm×4.6 μm,5 μm)3种色谱柱下的相对校正因子,结果见表4。可见,各成分的RSD均小于3%,表明不同色谱系统和色谱柱对各成分相对校正因子无显著影响。

表4 不同色谱系统、色谱柱下各成分的相对校正因子Table 4 Effects of different instruments and columns on relative correction factors
2.6.2 不同柱温对相对校正因子的影响[14]采用Thermo U3000型高效液相色谱仪、Waters Xbridge C18色谱柱,考察柱温25、30、35℃对各成分相对校正因子的影响,结果见表5。可见,不同柱温条件下各成分的RSD均小于3%,表明柱温对各成分相对校正因子无显著影响。
表5 不同柱温下各成分的相对校正因子Table 5 Effects of different column temperatures on relative correction factors
2.6.3 不同流速对相对校正因子的影响[14]采用Thermo U3000型高效液相色谱仪、Waters Xbridge C18色谱柱,考察流速0.8、1.0、1.2 mL/min对各成分相对校正因子的影响,结果见表6。可见,不同流速条件下各成分的RSD均小于3%,表明不同流速对各成分相对校正因子无显著影响。

表6 不同流速下各成分的相对校正因子Table 6 Effects of different flow rates on relative correction factors
2.6.4 不同进样体积对相对校正因子的影响[14]采用Thermo U3000型高效液相色谱仪、Waters Xbridge C18色谱柱,考察进样体积2、4、6、8、10、15 μL对各成分相对校正因子的影响,结果见表7。可见,各成分的RSD均小于3%,表明进样体积的波动对各成分相对校正因子无显著影响。
表7 不同进样体积下各成分的相对校正因子Table 7 Effects of different injection volume on relative correction factors
2.7 待测成分色谱峰的定位[15]
在QAMS的应用中,目前常用的色谱峰定位方法有相对保留值法、保留时间差法、时间校正法、对照提取物法等。本研究采用相对保留时间进行待测组分色谱峰的定位,以芦荟大黄素为内标物,考察其他6成分在Thermo U3000型和Waters Arc型2种高效液相色谱系统,以及3根不同厂家的色谱柱(Waters Xbridge C18、Agilent ZORBAX Extend-C18、YMC Triart C18)的相对保留时间,结果见表8。可见,各成分的RSD均小于3%,表明采用相对保留值法对待测成分的定位是可行的。
表8 不同色谱系统、色谱柱下各成分的相对保留时间Table 8 Effects of different instruments and columns on relative retention time
2.8 一测多评法与外标法测定结果比较
取9批外用金黄散提取物适量,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,分别采用外标法和一测多评法测定各成分质量分数,利用SPSS 20.0软件对两组检测结果进行Pearson相关系数(r)分析,结果见表9。可见,2种方法的含量测定结果基本一致,相关系数r均为1.000。甘草苷、橙皮苷、甘草酸、大黄酸、欧前胡素、大黄素甲醚的相对标准偏差范围分别为2.86%~3.60%、0.83%~1.04%、0.15~3.10%、0.74%~3.86%、0.23%~4.03%、0.02%~4.02%,均小于5.0%,表明2种方法计算结果无明显差异。
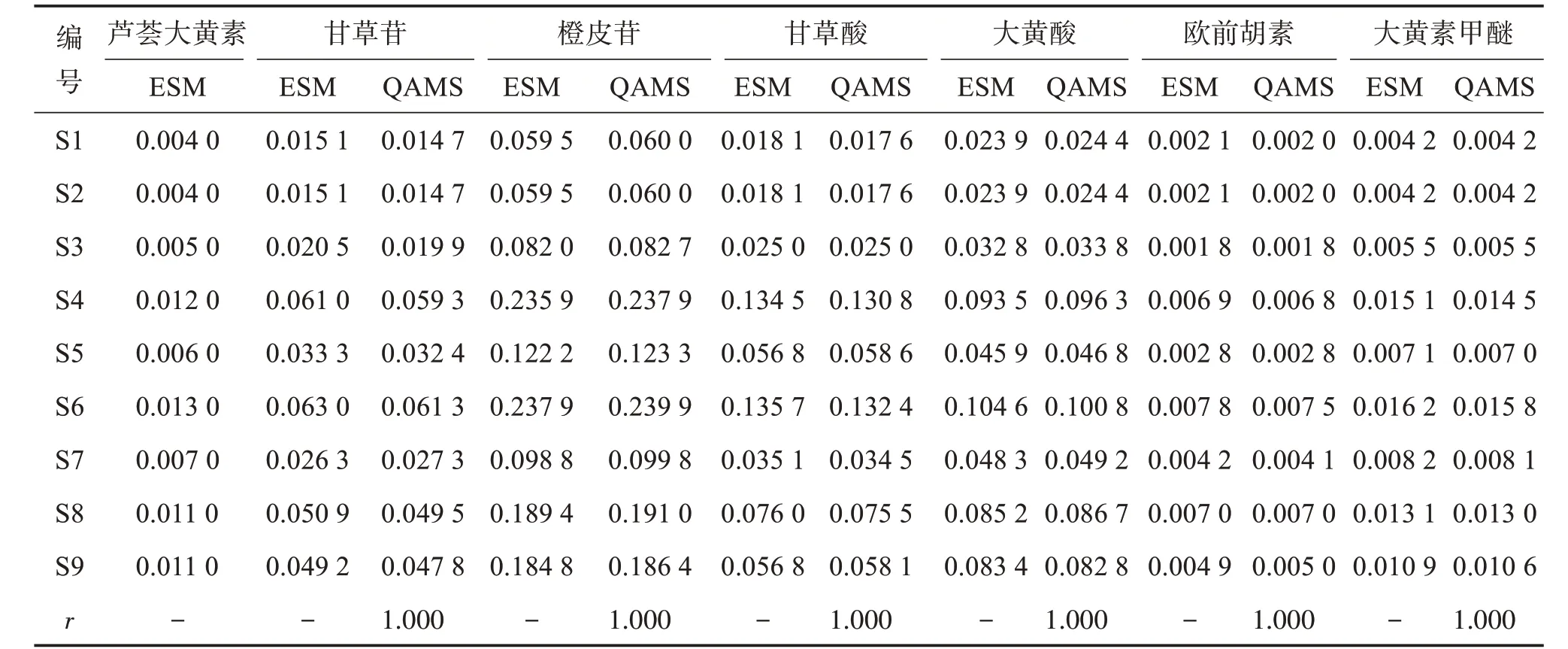
表9 外标法与一测多评法测定结果比较Table 9 Comparison of results obtained by external standard method and QAMS method(n=3) w/%
3 讨论
目前,中药化学标准品的数量和种类仍不能满足质量检测的需要,实际应用中常采用分别测定有效成分含量的方法来控制中药及其制剂的质量,检测效率较低,检测成本偏高。一测多评法利用中药中各成分间的相对校正因子同时测定多个有效成分,实现了在对照品缺乏的情况下进行中药多成分的质量控制,显著降低了检测成本,提高了工作效率,对于中药及其制剂的研究与开发具有重要意义[16]。
外用金黄散处方中君药为苦寒解毒药,如大黄、黄柏;臣药为燥湿化痰行气的天南星、陈皮、厚朴和破血行气药姜黄;使药为辛温祛风燥湿、消肿止痛药,如白芷[17]。其药理活性涉及到的化学成分有芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、橙皮苷、甘草酸、欧前胡素等,这些化学成分可通过多种途径发挥协同作用,因此,采用多指标进行药品质量控制意义重大[18]。
本研究通过建立QAMS法同时测定外用金黄散提取物中甘草苷、橙皮苷、甘草酸、大黄酸、欧前胡素、大黄素甲醚的含量,该方法与外标法所测得的含量无显著差异,说明建立的相对校正因子可靠可行,可达到1个对照品同时测定7个成分含量的目的,同时可降低多组分质量控制的检测成本,可为外用金黄散提取物质量标准的建立提供参考。

