大理地区某规模化乳牛场致犊牛腹泻的病原分析
周玉照 张小苗* 杨晓伟 张以芳
(1.大理农林职业技术学院 云南 大理 671003;2.鹤庆县现代农业庄园有限公司 云南 鹤庆 671500;3.云南农业大学动物医学院 昆明 650201)
随着生活水平不断提高,人们对乳制品和肉制品的需求量越来越大,牛群的健康就变得尤其重要,但目前犊牛腹泻发病率高达90%,患牛病死率高达50%以上,腹泻对犊牛的生长发育以及成活等都有很大影响[1]。因此,探究导致犊牛严重腹泻的病因,对于临床上防治该病具有重要的指导意义。大量研究发现,产毒素性大肠杆菌、沙门氏菌、轮状病毒、冠状病毒、牛病毒性腹泻病毒、隐孢子虫以及球虫等感染均可引起犊牛腹泻,而且临床上常呈现两种以上病原混合感染[2]。肠致病性大肠杆菌引起的初生犊牛腹泻及败血症,其发病率和病死率最高,是造成初生犊牛死亡的主要原因,占影响犊牛健康的首位。牛病毒性腹泻病毒(BVDV)、牛冠状病毒(BCV)、牛轮状病毒(BRV)是引起犊牛传染性腹泻的主要病毒,犊牛感染后导致免疫功能下降,引起严重腹泻、脱水造成大批死亡,其中又以感染牛病毒性腹泻病毒的发病率最高,危害最大[3]。根据病毒基因组核苷酸序列的差异,BVDV又可分为I和II两种基因型,不同基因型又可进一步分为不同基因亚型[4]。分子流行病学研究发现,国内目前流行的BVDV毒株主要以BVDV-1b和BVDV-1m两种基因亚型为主[5]。本试验对从大理地区某乳牛场采集的样品进行细菌分离培养、生化试验、动物致病性试验、菌毛基因和毒力基因检测、药敏试验、牛轮状病毒、牛冠状病毒、牛病毒性腹泻病毒PCR检测及核苷酸序列分析,以期为大理地区某乳牛场找出引起该次犊牛腹泻的病因,为该病的防治提供科学依据。
1 材料与方法
1.1 样品来源2020年12月,从大理地区某乳牛场分别采集成年牛直肠棉拭子28份、腹泻犊牛直肠棉拭子26份、氧化塘粪样2份、分离后粪样2份、垫料2份、全血11份,共71份样品。
1.2 材料 普通肉汤、伊红美蓝琼脂、麦康凯琼脂、HE琼脂、革兰氏染色液、生化鉴定管、药敏片、细菌DNA提取试剂盒、DNA胶回收试剂盒、Magen RNA提取试剂盒、大肠杆菌DH5α、pMDl9-T载体、DNA Marker DL 2000均购自宝生物工程(大连)有限公司;小白鼠由本实验室饲养。
1.3 细菌分离培养 分别将犊牛和成年牛直肠棉拭子、氧化塘粪样、分离后粪样、垫料接种于普通肉汤,37℃培养18 h,革兰氏染色镜检。将镜检有G-杆菌的培养液分别划线于伊红美蓝琼脂、麦康凯琼脂、HE琼脂,37℃培养18 h后,挑可疑菌落进行革兰氏染色,镜检后,选择优势菌落接种于普通肉汤纯培养,并命名为菌液1~菌液6。
1.4 生化试验 取纯培养普通肉汤菌液分别加入到生化鉴定管中,37℃培养24~72 h后观察并记录结果。
1.5 动物致病性试验 取21只健康小白鼠,随机分成7组,每组3只,1~6试验组小鼠分别腹腔注射犊牛A和B直肠棉拭子、成年牛A和B直肠棉拭子、分离后粪样、垫料的纯培养菌液各1 mL,空白对照组注射1 mL生理盐水。接种后观察小白鼠发病和死亡情况,连续观察7 d,并对发病和死亡的小白鼠进行细菌分离鉴定。
1.6 菌毛基因和毒力基因检测 应用Primer Premier5.0软件分别设计致病性大肠杆菌(K99)C83912菌毛基因、EAST1和ETT2毒力基因3对引物。引物序列为C83912-F:5'-CGCGGATCCAATACAGGTACTATTAA-3',C83912-R:5'-CCGCTCGAGTTACATATAAGTGACT-3';EAST1-F:5'-ATGCCATCAACACAGTATATC-3',EAST1-R:5'-TCAGGTCGCGAGTGACGG-3';ETT2-F:5'-TACTAATGCCATATAGCCCCATAA-3',ETT2-R:5'-CTACGCTTTTAACAAACGATTGAT-3'。引物由生工生物(上海)工程股份有限公司合成。
按照细菌DNA提取试剂盒操作说明,对分离纯培养的菌液提取DNA,利用PCR分别扩增C83912菌毛基因、EAST1和ETT2毒力基因片段,PCR反应体系(30 μL):Ex Taq 0.5 μL,10×Ex Taq Buffer 3 μL,上游引物0.5 μL,下游引物0.5 μL,dNTP 2.5 μL,DNA 2 μL,ddH2O 21 μL。PCR反应条件:95℃预变性5 min,94℃变性40 s,55℃退火50 s,72℃延伸2 min,35个循环,72℃延伸8 min。扩增产物经0.8%琼脂糖凝胶电泳鉴定。
1.7 药敏试验 使用浓度梯度稀释活菌计数法,统计纯培养菌液含菌数为1.5×108个/mL。取菌液均匀涂布于琼脂平板上,用镊子将药敏纸片平放在平板上,并轻压使其紧贴平板表面,每个平板贴6张药敏纸片,两纸片相距23 mm,纸片与平板边缘不小于15 mm,贴好纸片的平板于37℃培养24~72 h后,观察并测量抑菌圈直径,根据《抗微生物药物敏感性试验执行标准》判定结果[6]。
1.8 牛轮状病毒、冠状病毒、病毒性腹泻病毒PCR检测 应用Primer Premier5.0软件分别设计牛轮状病毒、牛冠状病毒、牛病毒性腹泻病毒3对引物。引物 序 列 为BRV VP6-F:5'-ATGGATGTCCTGTATTCCTT-3',BRV VP-R:5'-ATGTATGTATGGACGAAATG-3';BCV-F:5'-ATACCCCGGCTGACATTCTCG-3',BCV-R:5'- CTCTTCTGGCGGGGCTTATTCA-3';BVDV-F:5'-ATGGACACGAAAGAAGAA-3',BVDV-R:5'-ATTATTTCAAGTCACAA-3'。按照RNA提取试剂盒操作说明,提取RNA,利用PCR分别扩增目的片段。
1.9 牛病毒性腹泻病毒核苷酸序列分析 将PCR产物纯化后送生工生物(上海)工程股份有限公司进行测序。利用BLAST将测序获得的BVDV核苷酸序列与Gen Bank数据库中的典型菌株进行同源性比对分析。
2 结果与分析
2.1 细菌分离培养结果 将镜检疑似为大肠杆菌的纯培养菌液分别接种于麦康凯培养基、伊红美蓝培养基、HE培养基,放于37℃恒温培养箱中培养过夜。在麦康凯培养基上菌落呈粉红色(见图1 A-1),在HE培养基中菌落呈黄色(见图1 A-2),在伊红美蓝培养基上菌落呈黑色带金属光泽(见图1 A-3),初步确定为大肠杆菌。 统计后显示在犊牛直肠棉拭子、分离后粪样、垫料中大肠杆菌检出率均为100%,而成年牛直肠棉拭子大肠杆菌检出率为92.86%,氧化塘粪样大肠杆菌检出率为0%,大肠杆菌总检出率为93.33%(见表1)。
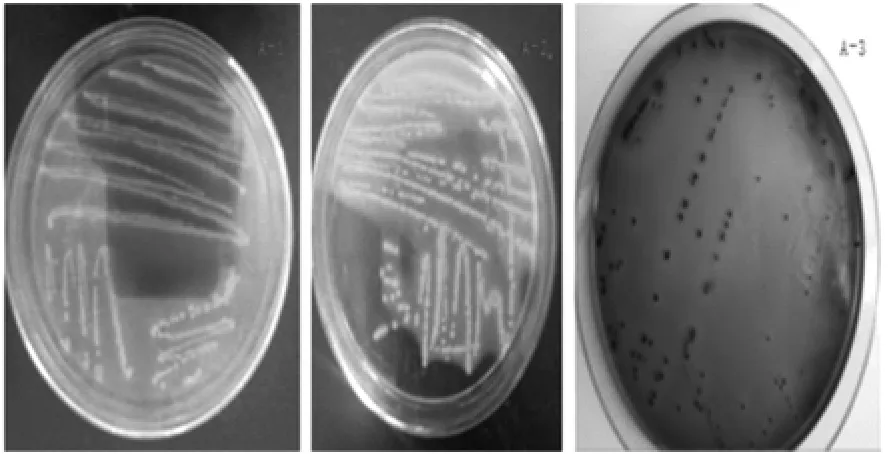
图1 细菌鉴别培养结果

表1 不同样品大肠杆菌检出结果
2.2 生化试验结果 取纯培养菌液分别加入到葡萄糖、蔗糖、阿拉伯糖、山梨醇、木糖、麦芽糖、尿素、乳糖、甘露醇、鼠李糖、水杨素、七叶苷、肌醇等生化鉴定管中,在37℃恒温培养箱中培养24~72 h后,结果表明分离到的病原为致病性大肠杆菌(见表2)。

表2 生化试验结果
2.3 动物致病性试验结果 由表3可知,3组和4组的小白鼠全存活,说明在成年牛直肠棉拭子纯培养菌液无致病性,而在犊牛直肠棉拭子、分离后粪样、垫料中分离到的纯培养菌液都具有很强的致病性。将死亡的小白鼠肝脏进行细菌分离培养,结果为致病性大肠杆菌。
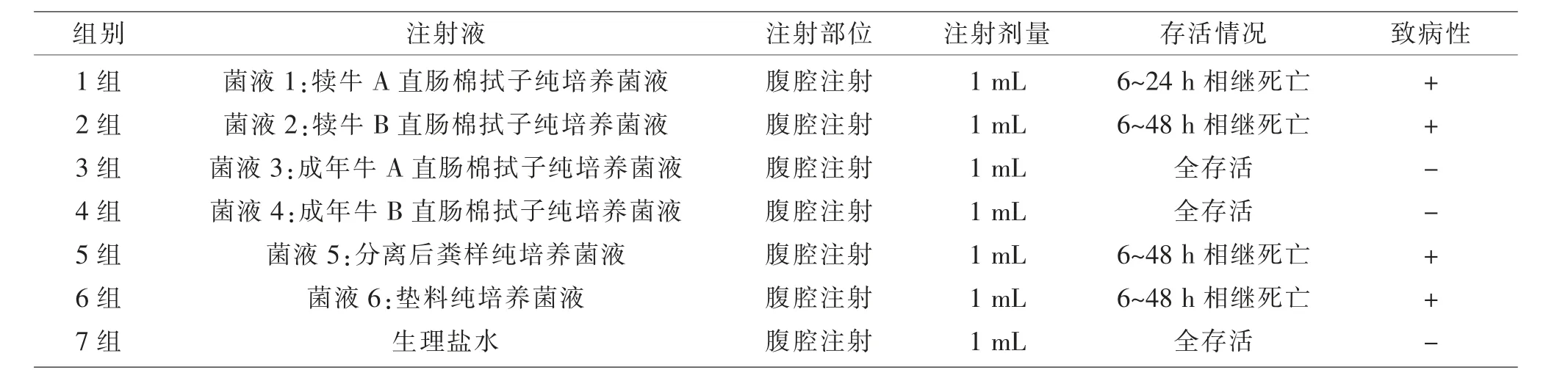
表3 动物致病性试验结果
2.4 菌毛基因和毒力基因检测结果 用引物分别对1、2、5、6组菌液提取的DNA进行K99 C83912菌毛基因、EAST1和ETT2毒力基因片段PCR扩增。结果均获得大小约445 bp的ETT2毒力基因和498 bp的C83912菌毛基因目的条带,与预期结果相符(见图2)。说明分离到的病原菌为致病性大肠杆菌K99。
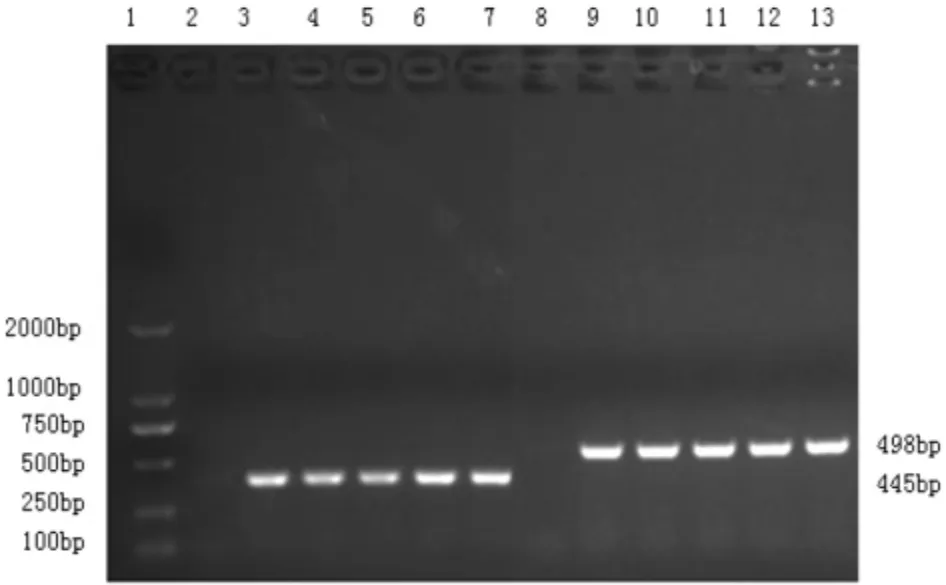
图2 ETT2毒力基因和C83912菌毛基因PCR扩增结果
2.5 药敏试验结果 纯培养菌液对10种药物的药敏试验结果显示,在犊牛直肠分离到的致病性大肠杆菌对青霉素耐药,对阿莫西林克拉维酸、头孢噻吩、头孢氨苄、头孢曲松、卡那霉素、庆大霉素、诺氟沙星、磺胺嘧啶、氟苯尼考药物都敏感;在分离后粪样和垫料分离到的致病性大肠杆菌对10种药物都敏感。
2.6 牛轮状病毒、冠状病毒、病毒性腹泻病毒PCR检测结果 用引物分别对BRV VP6基因、BCV和BVDV目的片段进行PCR扩增。结果在成年牛血样中获得大小约298 bp的BVDV目的条带,与预期结果相符(见图3),而犊牛血样均为阴性。说明该乳牛场存在牛病毒性腹泻病毒感染。
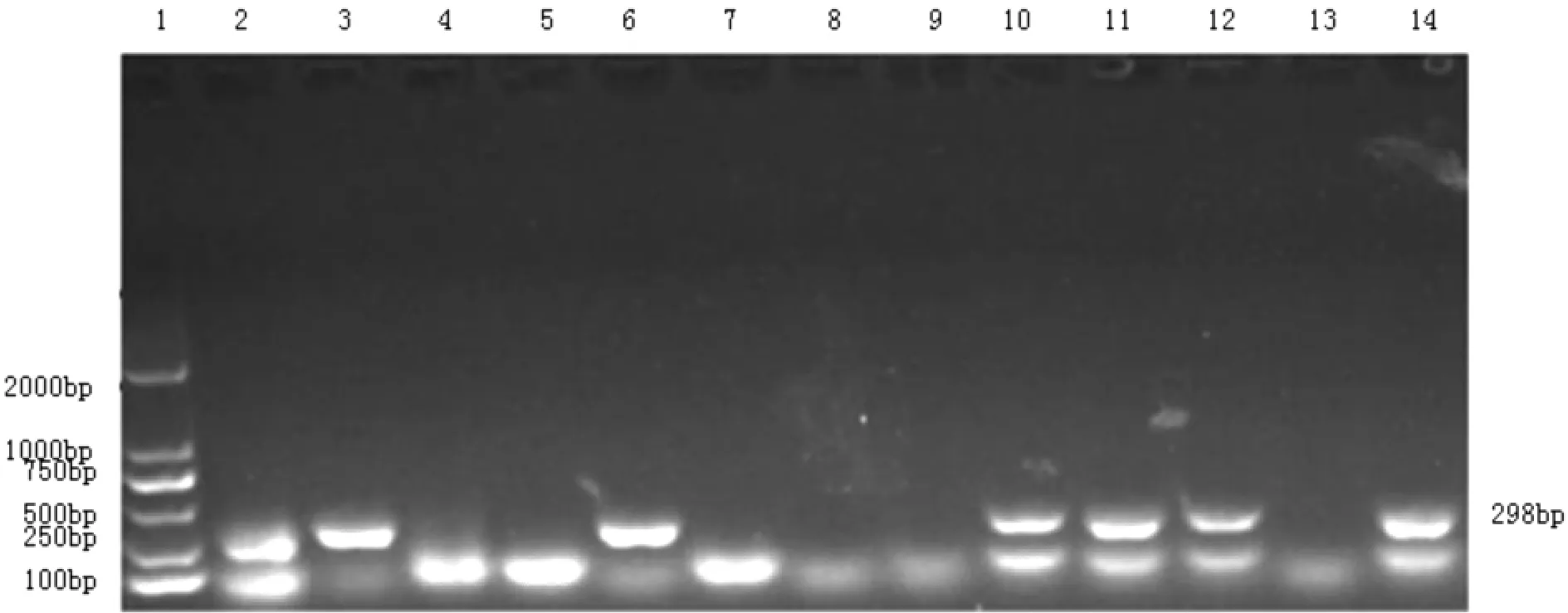
图3 BVDV PCR扩增结果
2.7 牛病毒性腹泻病毒核苷酸序列分析与遗传进化分析结果 将上述PCR产物进行纯化后测序,将其命名为DL BVDV。利用MegAlign软件将测序获得的序列与Gen Bank数据库中的BVDV-1、BVDV-2、BVDV-3序列进行同源性比对分析。结果显示获得的DL BVDV序列与16个BVDV-1毒株序 列 同 源 性 为69.7%~99.1%,与BVDV-1b MR10899毒株序列同源性为99.1%,与BVDV-2 LN01毒株序列同源性为76.6%,与BVDV-3 Italy-10-1毒株序列同源性为74.7%(见图4)。DL BVDV的遗传进化与BVDV-1 FBS-C1、BVDV-1 TR85、BVDV-1b MR10899属于同一分支,亲缘关系近,而与其它不在同分支,亲缘关系远(见图5)。说明获得的DL BVDV属于BVDV-1b亚型。

图4 DL BVDV序列同源性比对分析
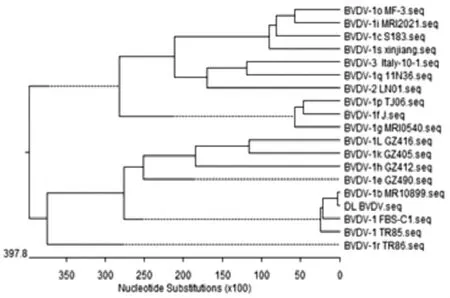
图5 DL BVDV序列遗传进化分析
3 讨 论
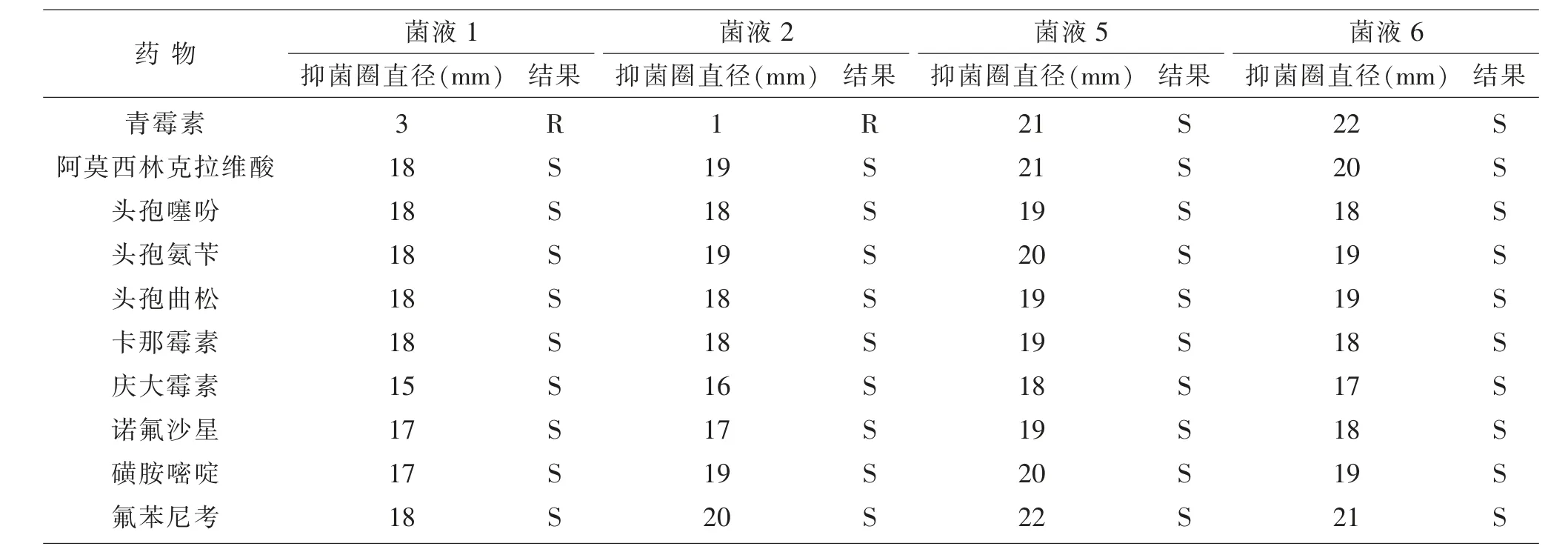
表4 致病性大肠杆菌药敏试验结果
犊牛腹泻是由细菌(大肠杆菌K99、沙门氏菌)、病毒(BVDV、BRV、BCV)等病原及营养、环境、饲养管理等诸多因素引起的一种疾病的总称。产肠毒素大肠杆菌和BVDV是导致犊牛剧烈腹泻甚至死亡的主要病原,而且康复后犊牛的生产性能也常常受到影响,已经成为影响乳牛业健康发展的主要难题[7]。报道显示,我国分离鉴定的BVDV毒株以BVDV1型为主,BVDV2型毒株流行区域较少,但近些年来,出现了越来越多关于我国牛群或猪群感染BVDV2型的报道[8]。目前BVDV-1已有22个基因亚型(1a-1v),其中亚洲主要流行1m、1n、1o、1p、1q、1u和1v等7个亚型,而国内主要流行1b和1m亚型[9]。自20世纪80年代以来,我国四川、甘肃、宁夏、新疆、青海、内蒙古、山东、河南等20多个省市在牛、牦牛、绵羊、鹿等动物中均有感染该病毒的报道[10]。BVDV在世界范围内广泛流行,欧美等养牛业发达国家均有检出,牛群中抗体阳性率达50%~89%。美国主要流行的是BVDV-1a、BVDV-1b和BVDV-2a,欧洲许多国家主要流行BVDV-1a、BVDV-1b、BVDV-1d、BVDV-1e和BVDV-1f,日本和韩国主要流行BVDV-1b,澳大利亚则主要流行BVDV-1c[11]。
本试验对从大理地区某乳牛场采集的11份全血进行BVDV、BRV、BCV检测,结果BRV和BCV均为阴性,而成年牛BVDV为阳性,犊牛BVDV为阴性;阳性样品经测序分析,结果与16个BVDV-1毒株序列同源性为69.7%~99.1%,与BVDV-1b MR10899毒株序列同源性为99.1%,与BVDV-2 LN01毒株序列同源性为76.6%,与BVDV-3 Italy-10-1毒株序列同源性为74.7%;且遗传进化与BVDV-1 FBS-C1、BVDV-1 TR85、BVDV-1b MR10899属于同一分支,亲缘关系近,而与其它不在同分支,亲缘关系远,属于BVDV-1b亚型。说明大理地区存在牛BVDV感染。同时,考虑到细菌感染也会引起犊牛腹泻,试验还对采集的60份样品(成年牛直肠棉拭子、腹泻犊牛直肠棉拭子、氧化塘粪样、分离后粪样、垫料)进行细菌分离、生化试验、动物致病性试验、菌毛基因和毒力基因检测、药敏试验,结果在腹泻犊牛直肠棉拭子、分离后粪样、垫料中分离到4个致病力很强的大肠杆菌,且都携带ETT2毒力基因和C83912(K99)菌毛基因;在犊牛直肠分离到的致病性大肠杆菌对青霉素耐药,对阿莫西林克拉维酸、头孢噻吩、头孢氨苄、头孢曲松、卡那霉素、庆大霉素、诺氟沙星、磺胺嘧啶、氟苯尼考药物都敏感;在分离后粪样和垫料中分离到的致病性大肠杆菌对10种药物都敏感。
目前对于大肠杆菌病的治疗还是以抗生素类药物为主,但随着抗生素的不当使用,大肠杆菌耐药谱和耐药水平不断提高,有报道在犊牛上分离的大肠杆菌多重耐药情况十分严重,导致临床治疗大肠杆菌所致犊牛腹泻过程中,很多时候抗生素类药物达不到很好的治疗效果[12]。2019年石凯元等[13]在犊牛腹泻样品中分离到的大肠杆菌对头孢哌酮、头孢唑林、米诺环素、头孢曲松4种抗生素敏感;对头孢呋辛和头孢他啶2种抗生素中度敏感;对头孢氨苄、哌拉西林、红霉素、万古霉素、强力霉素、青霉素、氨苄西林、羧苄西林、麦迪霉素、环丙沙星、链霉素、丁胺卡那霉素、头孢拉定、庆大霉素、卡那霉素、苯唑西林、复方新诺明、诺氟沙星、奥复酸、四环素、多西环素、林可霉素等22种抗菌药物产生耐药性。本试验的药敏试验结果与其相比较,发现引起犊牛腹泻的致病性大肠杆菌对头孢类抗生素普遍敏感,而对青霉素不敏感。
4 结 论
大理地区某乳牛场存在BVDV-1b亚型流行。因在犊牛血样中未测出BVDV,所以,导致该次犊牛严重腹泻的主要病原为致病性大肠杆菌K99。致病性大肠杆菌K99对头孢类抗生素普遍敏感,而对青霉素不敏感。

