国内外质控差异可能对多组分抗生素注射剂一致性评价产生的影响
马步芳 王立新 张培培 姚尚辰 常艳
(中国食品药品检定研究院,北京 102629)
根据《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)等有关规定,为加快推进仿制药一致性评价工作,国家药品监督管理局于2020年5月12日发布《开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》(2020年第62号)标志着化学药品注射剂仿制药质量和疗效一致性评价工作正式实施。抗生素药物在注射剂中占有较大比例[1]。按抗生素组分构成特点可分为单组分和多组分抗生素两个大类。中国药典2020版二部中已收载的多组分抗生素注射剂包括:注射用替考拉宁、硫酸庆大霉素注射液B等[2]。对于单组分抗生素注射剂一致性评价的策略已有文献报道[3-5],但对于多组分抗生素注射剂的一致性评价又该如何开展?在已颁布的《化学药品注射剂仿制药质量和疗效一致性评价技术要求》中,并未对“多组分”提出具体要求。根据既往仿制药一致性评价经验,在质量研究与控制技术要求方面需参考相关技术指导原则以及国内外药典的收载要求,特别是原研或参比制剂所在国药典中的质控项目和限度规定。但当国内外药典对于多组分抗生素的质控存在明显差异,特别是在组分和有关物质控制的限度上存较大分歧时,这种差异或分歧又会对此类抗生素注射剂一致性评价产生哪些影响?本文尝试以替考拉宁品种为例展开讨论。
替考拉宁是一种糖肽类多组分抗生素,其组分可分为A2组和A3组。A2组包括A2-1组、A2-2、A2-3组、A2-4、A2-5组和A2-6组;其中,A2-1组包括主要组分A2-1,以及RS3(A2-1a)和RS4(A2-1b)两个小组分;A2-3组和A2-5组分别包括主要组分A2-3和A2-5,A2-6组包括2个亲脂性较大的类似物RS1和RS2[6-7]。A3组包括主要组分A3-1,该化合物是A2的去酰基葡萄糖胺产物[8]。替考拉宁各主要组分化学结构见图1。在临床应用中,5个主要组分A2-1至A2-5的抗菌活性与药代动力学特性相对差异较小,A3-1组分及4个小组分RS1至RS4的体外活性与A2组的5个主要组分并无显著性差异[9-10]。此外,A2组和A3组中还存在多个结构、活性和毒性均未知的微量组分。

图1 替考拉宁各主要组分化学结构Fig.1 Chemical structure of main components of teicoplanin
对于发酵类的多组分抗生素,产品中各组分的比例与菌种和发酵工艺有关,由于菌种、培养基组成、发酵时间、发酵温度以及提取工艺等多种因素的影响,组分比例差异不可避免[11]。这种差异可能与临床用药的疗效和毒副反应的发生率直接相关[12],故需制定合理的质控标准对各组分含量及有关物质进行控制,以保证用药的安全性和有效性。欧洲药典(EP)、英国药典(BP)、日本药典(JP)、中国药典(ChP)中收载了替考拉宁品种,各国药典均在控制效价活性含量的同时采用HPLC法对其组分及有关物质进行质控。经比较,各国标准中:液相色谱条件基本一致,各组分和有关物质计算方法完全相同,均采用相对比例作为质控指标,但对各组分和有关物质的控制限度却存在较大差异[13-16]。
在国内,替考拉宁和注射用替考拉宁分别有3个和5个生产批号。根据国家药品监督管理局药品审评中心2019年6月3日发布的《化学仿制药参比制剂目录(第二十二批)》,注射用替考拉宁的参比制剂为其原研赛诺菲(Sanofi S.p.A)公司生产的他格适(Targocid),规格为200mg。国产仿制注射用替考拉宁包含0.2 g和0.4 g两个规格涉及3个生产厂家。本文以市场流通环节获取的注射用替考拉宁参比制剂、国内3个不同厂家生产的仿制药以及2批次替考拉宁国家标准品作为研究对象展开讨论。
1 材料与方法
1.1 主要仪器及试剂
仪器 Waters e2695液相色谱仪;Waters 2998 Photodiode Array Detector。
试剂 无水磷酸二氢钠、氢氧化钠均为分析纯;乙腈为色谱纯;水为超纯水。
1.2 供试品
赛诺菲安万特SANOFI(参比制剂)提供替考拉宁注射用粉针(200mg)样品3批(批号:A8681、A8682、A8683);国产企业提供替考拉宁原料药共8批,标记为A厂(批号:2121-170901、2121-180501、2121-180502),B厂(批号:YTN1810401、YTN1811401),C厂(批号:306T181214A、306T181215A、306T181216A);中国食品药品检定研究院提供替考拉宁国家标准品2批(批号:130374-201002、130374-201903)
1.3 溶液配制
分别取各厂家替考拉宁注射用粉针和原料药以及国家标准品各适量,以水溶解并稀释成含替考拉宁约2 mg/mL的溶液,作为供试品溶液。
灵敏度溶液:取供试品溶液适量,以水稀释成含替考拉宁约0.01 mg/mL的溶液,作为灵敏度溶液。
1.4 色谱条件与系统适用性试验
采用EP10.0中的色谱条件,洗脱方法见表1;色谱柱为X Bridge Shield RP18 5 μm,4.6 mm×250 mm。取供试品溶液和灵敏度溶液各20 μL,注入液相色谱仪,记录色谱图。供试品溶液中A2-4峰与A2-5峰之间的分离度不小于1.0;灵敏度溶液中A2-2峰的信噪比不小于40。

表1 梯度洗脱方法Tab.1 Gradient elution method
1.5 组分及有关物质测定
取供试品溶液20 μL,注入液相色谱仪,记录色谱图。各组分/有关物质的位置描述(相对于A2-2组分峰的相对保留时间,RRT)及含量计算公式详见表2和公式1~2。A2-2组分峰的保留时间约为18 min。
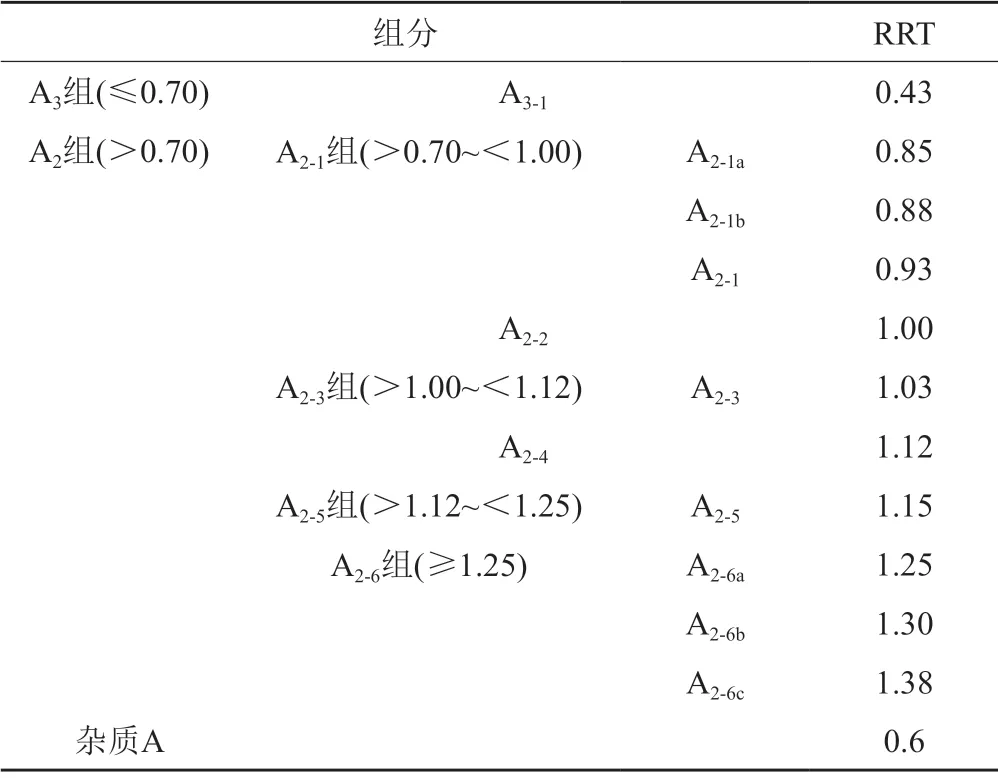
表2 各组分/有关物质的相对保留时间Tab.2 Relative retention time of teicoplanin components/related substances
公式1:
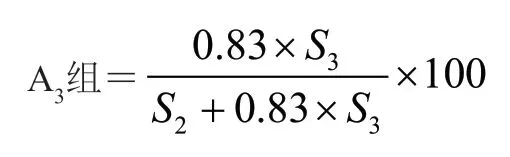
公式2:
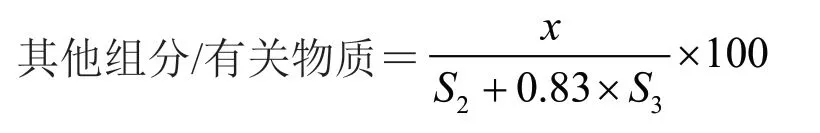
式中S2为A2组峰面积之和;S3为A3组峰面积之和;x为某一组分/有关物质的峰面积。
2 结果与讨论
2.1 测定结果
2.1.1 各国药典对替考拉宁组分和有关物质控制要求比较
各国药典自首次收载起[17-20],对替考拉宁组分/有关物质测定的色谱条件和含量计算方法保持一致,但对于受控组分及其质控限度存在差异(表3):日本药典和中国药典保持一致,并沿用至今[13-14],期间未进行任何修订;欧洲药典和英国药典保持一致,在EP9.8版[21]/BP2020[15]版中作了较大幅度的修订,沿用至今(EP10.0版[16]),修订后版本与JP17和ChP2020版之间存在较大差异。关键差异可以概述为两点:首先,受控组分不同;第二,限度规定方式和数值不同。JP17/ChP2020、EP7.0/BP2010和EP9.8/BP2020规定的受控组分数量分别为3个、8个和13个。除A2-2外,EP7.0/BP2010对各受控组分的限度规定方式与JP17/ChP2020一致,均为规定含量上限或下限,仅在数值上有差异;EP9.8/BP2020对除A2-6组之外的所有受控组分含量上下限均有明确的数值规定。与JP17/ChP2020和EP7.0/BP2010相比,EP9.8/BP2020增加了“有关物质”这一质控项。此外,EP/BP对杂质A的含量有限度规定,而JP17/ChP2020无此质控项。各药典标准对受控组分间相对比例的规定允许波动的范围由大到小依次为:JP17/ChP2020>EP7.0/BP2010>EP9.8/BP2020。
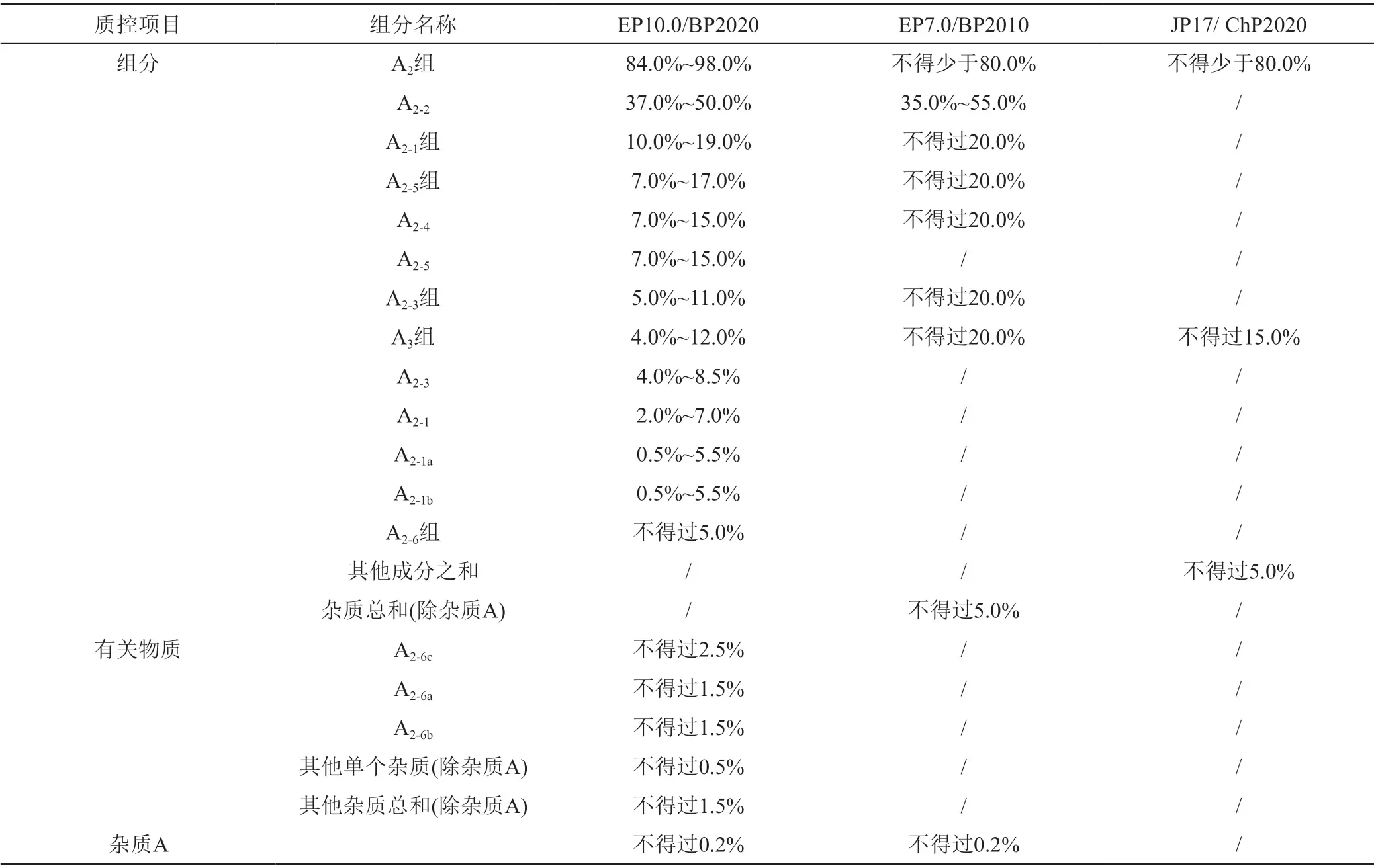
表3 各国药典对替考拉宁组分/有关物质的质控限度Tab.3 Control limits of teicoplanin components and related substances in different pharmacopoeias
2.1.2 不同来源替考拉宁组分/有关物质的测定结果
测定结果(表4)具有以下两个特点:第一,同一来源内部,同一组分/有关物质的含量在不同批次间存在波动,波动差异由大到小排序:国家标准品>A厂家>B厂家>C厂家>参比制剂,其中参比制剂同一组分/有关物质的含量在不同批次间相对稳定;第二,不同来源样品中各组分构成的相对比例间存在显著性差异,典型色谱图详见图2,各主要组分/有关物质含量比较的示意图如图3所示。

图2 不同来源的替考拉宁产品的典型色谱图Fig.2 Typical chromatograms of teicoplanin products from different sources
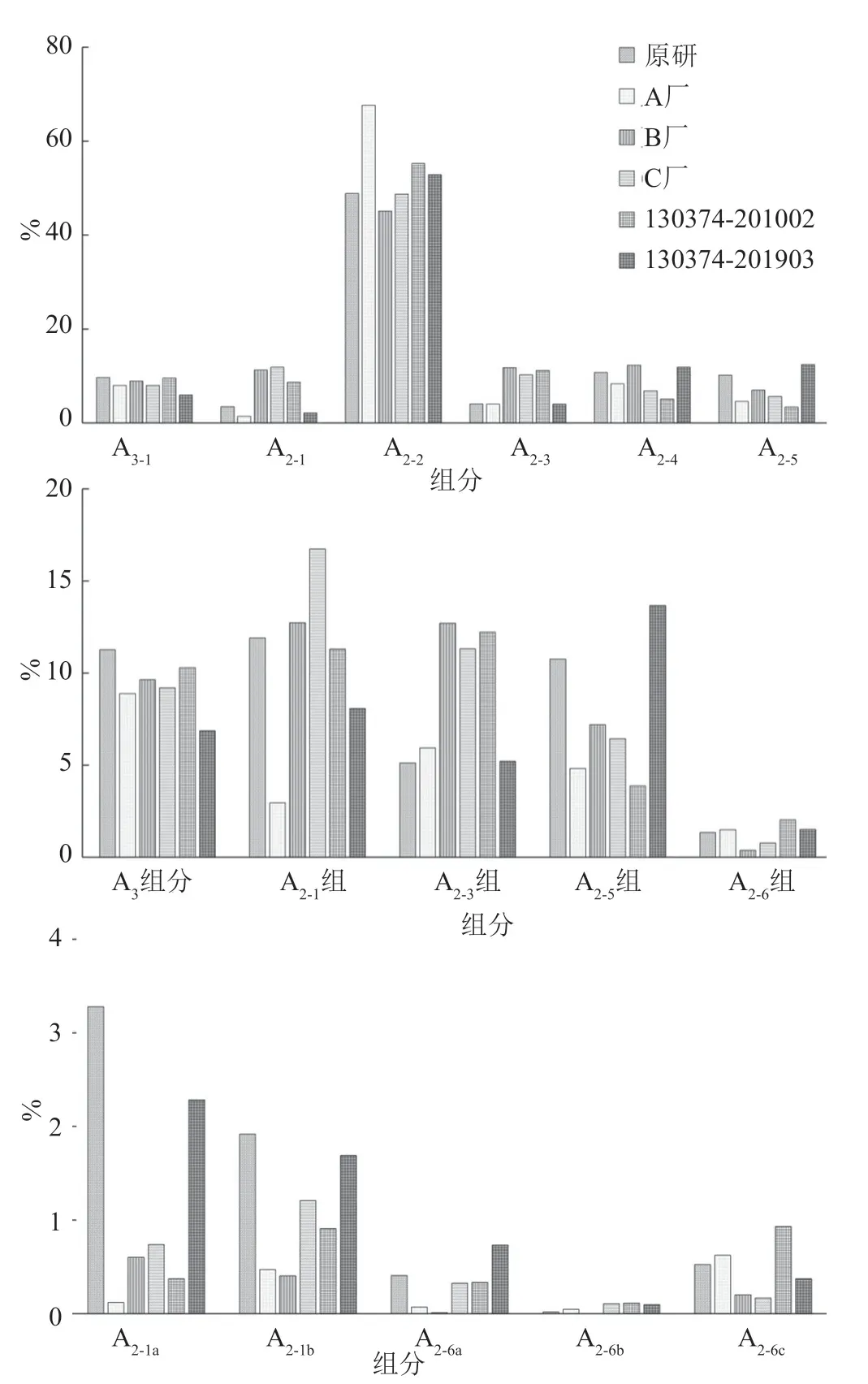
图3 不同来源的替考拉宁产品的组分含量比较示意图Fig.3 Comparison diagram of component content of teicoplanin products from different sources
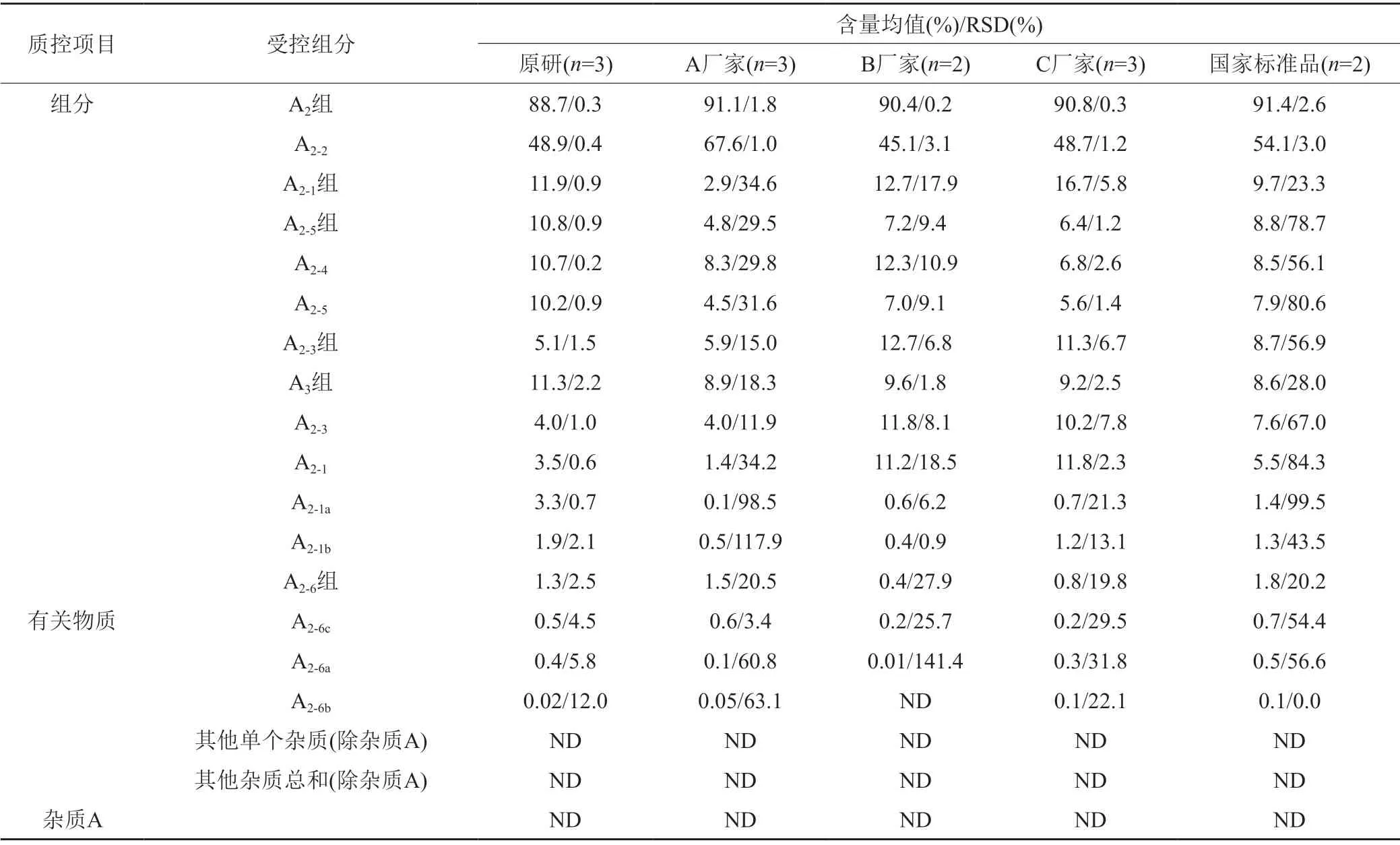
表4 不同来源的替考拉宁组分和有关物质含量Tab.4 Teicoplanin components and related substances content from different sources
根据各国药典中对替考拉宁及其有关物质的质控限度规定:全部样品均可符合JP17/ChP2020的限度要求;除A厂家的3批样品外,其他样品均可符合EP7.0/BP2010的限度要求;仅参比制剂的全部批次样品可符合EP10.0/BP2020的限度要求。
2.2 国内外质控差异可能对多组分抗生素注射剂一致性评价产生的影响
理想的一致性评价首先需选择参比制剂。鉴于在人用药品注册技术要求国际协调会议(ICH)成员国上市的原研药物通常均通过了严格的临床试验,且处方明确,工艺相对稳定,因此,常作为参比制剂的首选[4]。但对于多组分抗生素而言,国产仿制产品的组分构成及其相对比例是否均须与参比制剂保持高度一致?
据文献报道,在日本上市的注射用万古霉素和替考拉宁仿制药,其在实际治疗中抗菌活性较原研产品分别低约14.6%和17.3%[22]。通过进一步研究,可能导致国产仿制注射用万古霉素较原研制剂活性偏低的原因有以下两个方面:一方面是原研制剂的装量通常较国产制剂的装量约高13%[23];另一方面,万古霉素虽为单组分抗生素,但其来源于生物发酵,产品中的小组分/杂质可以与万古霉素B竞争结合万古霉素靶位,导致疗效降低[24],而国产注射用盐酸万古霉素中万古霉素B的含量较原研产品约低2%~3%[23]。目前,影响注射用替考拉宁临床疗效的原因尚未见相关文献报道。但对于多组分抗生素如庆大霉素和替考拉宁等,不同的组分对特定致病菌可能表现出不同的抗菌活性[25-26]。已有文献报道,当采用某一特定评价模型时,若仿制药与参比制剂的组分构成及其相对比例间存在差异时,可能导致表现出不同的抗感染效果[27],虽然其提示在对特定的患者治疗时候,可能出现疗效不一致的现象,但这种差异可能在治疗其他致病菌的感染时呈现出完全不同的治疗效果[4]。鉴于多组分抗生素的组分差异客观存在的事实基础,在对此类品种开展一致性评价过程中,应尽量明确各组分的毒/活性特点,并关注各组分对临床耐药菌的有效性,更为全面、客观地对仿制药和参比制剂在实际临床疗效/安全性间的差异进行评价,而并非在组分构成及其相对比例上追求与参比制剂保持绝对一致。ChP2015年版在修订硫酸庆大霉素及其注射液标准时便体现出了这一思路[28],ChP2015并不鼓励通过提高C1a组分(理论效价最高的组分)的比例来提高产品的效价,而是希望通过对无效组分/杂质的控制,提高总组分的含量来提高产品的效价[25]。对于替考拉宁品种而言,从实现临床疗效一致性角度出发,在评价过程中建议重点关注:除结构已明确的有效组分外,是否还存在有其他结构未知的有效组分,特别是对于临床耐药菌有效的其他组分;此外,现有A2组中5个主要组分(A2-1~A2-5)间的相对比例变化是否会引起临床疗效的显著变化,如存在显著差异,则应在保证疗效一致的前提下尽量明确相对比例间可接受的变化范围等。
除合理评估国产仿制药与参比制剂疗效/安全性的一致性外,如何保证产品质量的持续一致性是另一需要完善的关键性问题。基于质量源于设计(quality by design,QbD)理念,通常目标产品的质量可通过产品的关键质量属性(critical quality attributes,CQAs)进行表征[29-30]。在一致性评价过程中,不仅应理解参比制剂的CQAs,还需明确参比制剂生产过程中涉及的关键原辅料属性(critical material attributes,CMAs)和关键工艺参数(critical process parameters,CPPs),建立CMAs、CPPs和产品CQAs的关系,通过精准控制进而达到控制成品质量的目的[4]。根据此评价思路,就目前国产仿制注射用替考拉宁而言需要关注以下两点。第一,各国产厂家样品中不仅存在各组分/有关物质的构成及其相对比例与参比制剂间存在显著性差异的情况,关键问题在于同一厂家内部不同批次间同一组分/有关物质的含量存在较大波动,提示:国产仿制注射用替考拉宁的CPPs与参比制剂存在差异的同时,各国产厂对各自现有CPPs的控制精准度亦与参比制剂存在显著差距。第二,在处方上,部分国产注射用替考拉宁与参比制剂存在差异。参比制剂处方中含有约10%氯化钠,部分国产注射用替考拉宁处方中并未明确标注含有氯化钠成分,据ChP2020版中注射用替考拉宁中氯化钠的含量规定为“不得过5.0%”,与替考拉宁原料项下保持一致[14],提示,制剂中氯化钠来源为原料生产工艺引入而非制剂处方添加。在用法上,除常规静脉滴注或肌注外,仅参比制剂提供3~5min静脉推注的使用方式。保证其可直接静脉推注给药的前提正是参比制剂处方中含有约10%氯化钠,使其按规定方法溶解后形成等渗溶液。此外,据文献报道,等渗溶液在临床中的应用,特别是对于儿童患者、正接受手术的低钠血症患者或在重症加护病房(ICU)中的患者使用时更为安全[31-34]。建议在一致性评价过程中关注两者在处方和用法上的差异。
3 结论
受诸多因素影响,多组分抗生素品种在组分/有关物质构成及其相对比例间不可避免的存在差异。建议在此类品种仿制药一致性评价过程中应尽量明确:各组分的毒/活性特点,并关注各组分对临床耐药菌的有效性;各主要组分相对比例间的变化与临床疗效的相关性;关键原辅料属性、关键工艺参数与关键质量属性间的相互关系,以及其对产品质量持续可控产生的影响等。

