慢肾康宁对肾间质纤维化大鼠的影响*
张 静 孙升云 葛茂功 朱诗平 冯伟峰
肾间质纤维化(Renal Interstitial Fibrosis,RIF)指在各种致病因子如炎症、损伤、药物等的作用下,细胞外基质(Extracellular Matrix,ECM)大量堆积,RIF是导致肾小球硬化和小管间质纤维化的关键因素[1],它是各种原因导致肾脏疾病进展到慢性肾脏病的共同途径和主要病理基础。研究发现,转化生长因子-β1(Transforming Growth Factor-β1,TGF-β1)/Smads信号转导通路是致纤维化的关键路径[2]。慢肾康宁是在临床上用来治疗慢性肾衰的经验方,取得了较好的临床疗效。本实验应用腺嘌呤诱导的以肾间质纤维化为主要病理表现的慢性肾脏病大鼠模型观察慢肾康宁对实验动物肾脏病理形态学、Smad2、P-smad2及SARA蛋白表达的影响,探讨慢肾康宁保护肾脏功能的作用机制,为临床应用提供分子生物学理论依据。
1 材料与方法
1.1 一般材料
1.1.1 实验动物选用健康、雄性Wistar大鼠60只(体质量160~200 g,清洁级,由南方医科大学动物中心提供,动物合格证号scxk粤2006-004)。
1.1.2 主要试剂Smad2、P-smad2抗体由Cell Signaling Technology公司提供,SARA抗体由Epitomic公司提供。
1.1.3 实验用药慢肾康宁使用颗粒剂由黄芪30 g,党参15 g,麦冬12 g,淫羊藿20 g,生地黄12 g,丹参10 g,大黄9 g,山萸肉 9 g,茯苓15 g,海螵蛸15 g组成。该药由三九医药有限公司生产,购于暨南大学附属第一医院。上药按比例称取后,每日冲服。氯沙坦钾片(科素亚,100 mg /片)由杭州默沙东制药有限公司提供(批号:H20000371)。
1.2 方法
1.2.1 动物模型和分组动物随机分为正常组,模型组(给予同等量生理盐水经口灌服),氯沙坦组,慢肾康宁高剂量组、中剂量组、低剂量组,每组10只。根据大鼠的用药量(mg/kg)= 临床常用量(mg/kg)×老鼠等效面积系数(6.25)。以此公式结果为中剂量,按15 g/(kg·d)给药。低剂量为中剂量的一半[7.5 g/(kg·d)],高剂量为中剂量的2倍[30 g/(kg·d)]。氯沙坦给予10 mg/(kg·d)经口灌服。共给药21 d。
1.2.2 标本收集治疗21 d结束后称量各组大鼠体质量,当天用代谢笼收集大鼠24 h尿液,记录24 h尿量。第22天于采用戊巴比妥钠45 mg/kg腹腔注射麻醉大鼠,腹主动脉采集血液,同时迅速取双侧肾脏组织,取左侧肾脏以4%多聚甲醛固定进行病理学观察;另留取部分置于-80 ℃冰箱保存,进行蛋白的提取、测定。
1.3 实验方法
1.3.1 生化指标的测定检测血肌酐(Scr)、尿素氮(BUN), 24 h尿微量蛋白(24 h MTP)取样送暨南大学附属第一医院检验科测定。
1.3.2 病理学染色肾组织经4%多聚甲醛固定、脱水,石蜡包埋制成切片,进行HE染色及Masson染色。
1.3.3 Smad2 P-smad2及SARA蛋白分析取-80 ℃保存的肾组织100~150 mg,经RIPA蛋白裂解液成匀浆,4 ℃,12 000 g离心2 min,取上清液。采用BCA蛋白检测试剂盒测定蛋白浓度,每泳道上取变性的蛋白各10 μl/孔,蛋白质经10%或8%SDS-PAGE垂直凝胶进行电泳。恒压下将蛋白转移至PVDF膜上,5%脱脂奶粉37 ℃封闭2 h或4 ℃过夜,一抗4 ℃过夜,二抗37 ℃ 孵育2 h。每步骤后均经TBST漂洗,10 min×3次。最后加ECL发光试剂,杂交信号在Imagetool图像分析系统中进行吸光度分析。

2 结果
2.1 肾脏组织HE染色情况HE染色在正常组大鼠肾脏皮质、髓质皆正常,组织结构无明显病理变化。模型组大鼠肾脏组织内见大量肾小管上皮细胞凋亡、坏死,部分肾小管扩张;肾间质与肾小管界限不清,肾间质内有大量纤维组织增生、肉芽形成,并有大量炎症细胞浸润;肾间质、肾小管内有大量褐色结晶物沉积;病变肾小球有不同程度的硬化、萎缩,甚至坏死,部分肾小球呈代偿性扩张。慢肾康宁各剂量组肾组织内也可见炎症细胞浸润、间质纤维化,肾小管萎缩、坏死、扩张,肾小管及间质内有褐色结晶物沉积等改变,但程度轻于模型组。见图1。
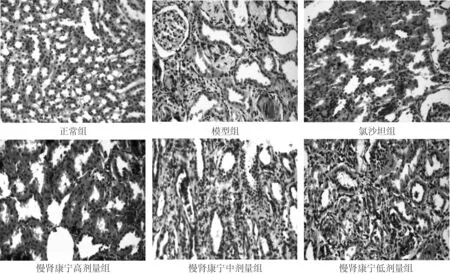
图1 慢肾康宁对RIF大鼠肾组织病理学变化的影响 (HE染色,×200)
2.2 肾脏组织Masson染色情况正常组肾组织皮质、髓质皆正常,肾小球、肾小管无结构改变,肾间质结构无异常改变,个别间质含有少量的胶原纤维。模型组:肾间质面积明显增大,小管萎缩或扩张情况明显,肾小球及肾间质有明显的胶原纤维聚集,棕黄色结晶颗粒占据整个肾小管,肾小球中亦有较多沉积。与模型组相比,慢肾康宁各剂量组间质纤维化均有不同程度的减轻,肾小管萎缩或扩张情况不同程度好转,肾间质的面积明显缩小,棕黄色颗粒在肾小球、肾小管沉积明显减少;慢肾康宁高剂量组间质纤维化改变与氯沙坦组接近。见图2。
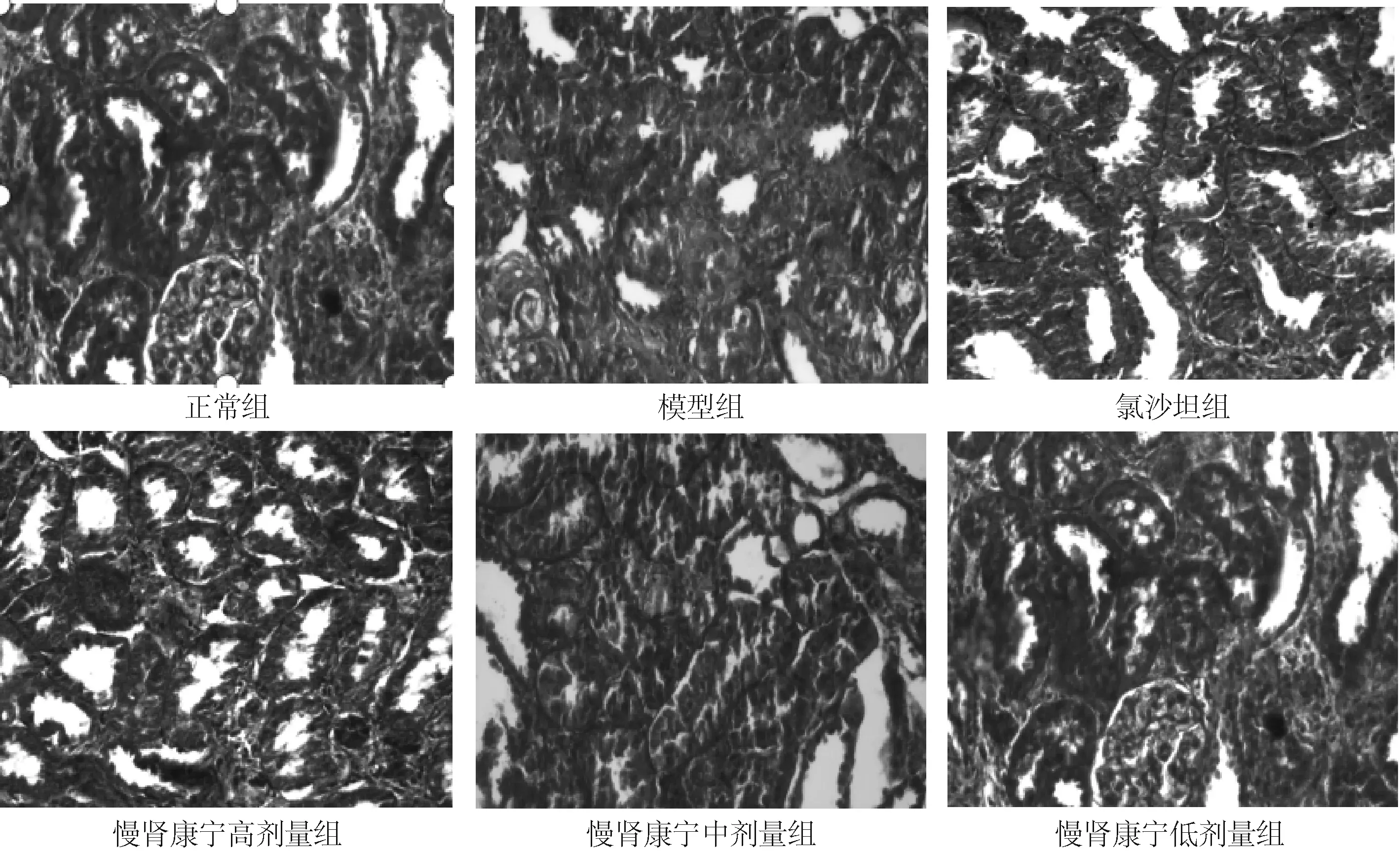
图2 慢肾康宁对RIF大鼠肾组织病理学变化的影响 (Masson染色,×200)
2.3 慢肾康宁对RIF大鼠血Scr BUN 24 h MTP及eGFR影响模型组Scr、BUN和24 h MTP都明显高于正常组(P<0.05);慢肾康宁高剂量组、中剂量组、低剂量组及氯沙坦组Scr、BUN和24 h MTP都明显低于模型组(P<0.05);其中,慢肾康宁高剂量组与氯沙坦组Scr、BUN和24 h MTP差异均无统计学意义(P>0.05),说明慢肾康宁和氯沙坦在降低Scr、BUN和24 h MTP的疗效相当。 见表1。

表1 慢肾康宁对RIF大鼠血Scr BUN 24 h MTP eGFR的影响 (只,
2.4 慢肾康宁对RIF大鼠肾脏组织Smad2 P-smad2及SARA蛋白相对表达量影响模型组大鼠肾脏Smad2、P-smad2蛋白表达水平均升高,与正常组相比差异有统计学意义(P<0.05);慢肾康宁高剂量组、中剂量组和氯沙坦组Smad2蛋白表达较模型组降低(P<0.01);低剂量组与模型组比较,差异无统计学意义。慢肾康宁高剂量组、中剂量组、低剂量组和氯沙坦组P-smad2蛋白表达较模型组显著降低(P<0.01)。模型组SARA蛋白表达较正常肾组织显著升高(P<0.01);慢肾康宁高剂量组、中剂量组和氯沙坦组SARA蛋白表达较模型组增加(P<0.01);低剂量组与模型组比较,差异无统计学意义。见表2,图3~图5。
表2 慢肾康宁对RIF大鼠肾脏组织Smad2 P-smad2及SARA蛋白表达影响

图3 慢肾康宁对RIF大鼠肾脏组织Smad2蛋白表达的影响
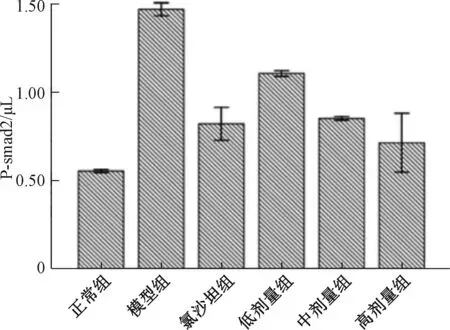
图4 慢肾康宁对RIF大鼠肾脏组织P-smad2蛋白表达的影响
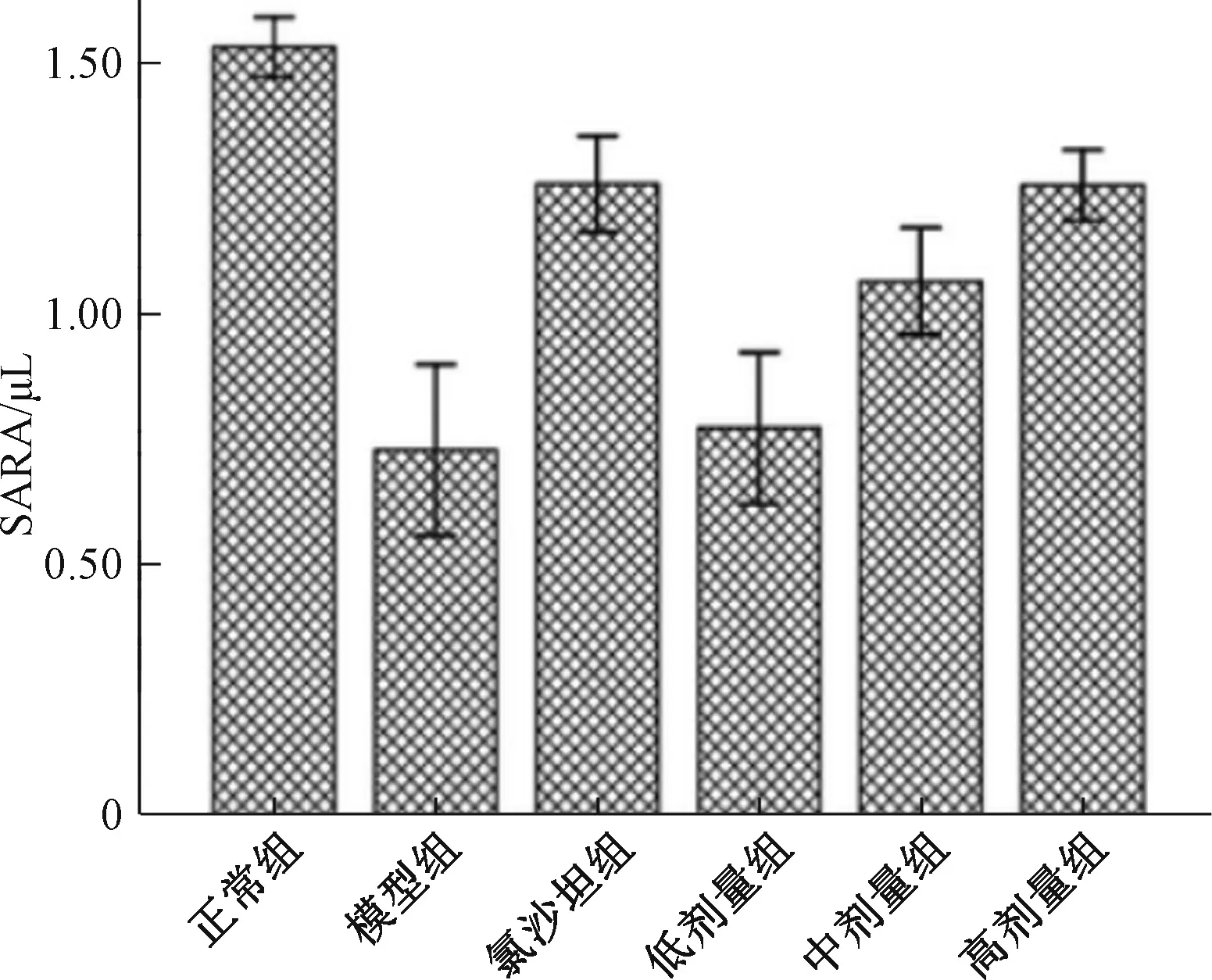
图5 慢肾康宁对RIF大鼠肾脏组织SARA蛋白表达的影响
3 讨论
研究证实,慢性肾病患者人数在世界范围内已达 6.975 亿,中国患病人数占18.97%,达到了1.323 亿人[3],但是对于大多数已经进入终末期肾病的慢性肾病患者,透析和肾移植是惟一选择,据统计,6%的患者在等待移植中即已死亡,能接受肾移植的患者只有25%[4]。肾间质纤维化是各种慢性肾脏病(Chronic Kidney Disease,CKD)进展到终末期肾脏病(End Stage Renal Disease,ESRD)的共同表现和病理基础,这一观点已得到专家一致认可[5]。阻断肾小管上皮细胞向间充质细胞转分化(Tubular Epithelial To Mesenchymal Transition,TEMT) 可以有效延缓慢性肾脏病的肾间质纤维化进程[6],下调TGF-β1/ Smad信号传导通路,可以有效减少细胞外基质的积聚[7-9]。
根据慢性肾脏病的临床表现及发病特点,可归属于中医水肿、癃闭、关格等范畴。病机特点为本虚标实,正不胜邪,本虚以脾肾两虚为主,标实以湿浊、痰浊、水毒为主。慢肾康宁中以黄芪、淫羊藿、山萸肉益气补肾,肾气、肾阳充盛则气化固摄功能可复,津液代谢正常;丹参、生地黄益肾、活血凉血祛瘀,改善血液循环;麦冬归肺经,助黄芪以益肺祛痰湿以益元阳;山药益气养阴,平补三焦,大黄通腑降浊,既防党参、黄芪、淫羊藿等补药壅滞,又佐众滋补药之温。全方攻补兼施,标本同治,共奏益气补肾,活血养血,通腑泻浊之功效[10]。前期的动物实验表明慢肾康宁可以改善CKD大鼠的一般形态,降低尿蛋白,减少Scr、BUN、24 h MTP,减轻大鼠肾脏组织病理损伤,保护肾功能,延缓肾损害进程,其具体作用机制尚待进一步研究[11]。
Smad2作为TGF-β1在细胞内特有的作用底物介导了信号由细胞膜进入细胞核,Smad2/3蛋白的磷酸化代表了TGF-β/Smad信号传导通路的激活[12],抑制P-Smad2/3的表达可减缓RIF进程[13]。SARA与Smad2和Smad3的磷酸化有关[14],在Smad2/Smad3和TGF-β受体之间起到桥梁作用,靶向SARA可以调控TGF-β的靶效应,从而具有潜在的治疗价值[15]。已有研究证实[16],SARA通过调节肾小管上皮细胞Smad2和Smad3的激活来调节高糖诱导的EMT和ECM排泄,以此推论SARA可能在EMT前状态下成为潜在的新型靶标,以改善在慢性肾脏疾病中发现的肾纤维化。
本实验选用阳性对照药物氯沙坦,能减少蛋白尿,阻断肾间质纤维化的发生和发展,改善慢性肾脏病的预后,是目前临床上运用明确有效的降压保肾药物[17,18]。前期的研究显示[19]:氯沙坦具有使Smad7 mRNA的表达增加,干预了TGF-β1/Smads信号通路的传递,延缓了肾间质纤维化的进展。
本实验观察到,在正常肾组织,Smad2和P-smad2蛋白呈低水平表达,在模型组中的表达均增加,提示Smad2蛋白参与了肾脏纤维化的过程;各治疗组的Smad2和P-smad2蛋白的表达低于模型组,提示药物治疗能降低Smad2和P-smad2蛋白的表达。SARA蛋白在正常肾组织高水平表达,在肾间质纤维化模型大鼠肾组织中的表达均减少,各治疗组的SARA蛋白的表达高于模型组。由此可以推测,慢肾康宁可能是通过降低Smad2和P-smad2蛋白及升高SARA蛋白的表达,抑制TGF-β/Smad信号传导通路,减少ECM的进行性积聚,从而延缓肾纤维化进程。

