中药中马兜铃酸快速检测及分离技术研究进展
邵 鑫,张 月,郑雁雪,王圆圆,魏金霞,李遇伯
·综 述·
中药中马兜铃酸快速检测及分离技术研究进展
邵 鑫,张 月,郑雁雪,王圆圆,魏金霞*,李遇伯*
天津中医药大学中药学院,天津 301617
马兜铃酸是一类广泛存在于马兜铃属及细辛属植物中的硝基菲羧酸类化合物,因其具有不可逆转的肾毒性,2000年6月,美国食品药品监督管理局下令停止进口、制造和销售含有马兜铃酸的原料及药品。随后,世界各国和地区纷纷暂停了含马兜铃酸药物的使用。但目前,一些含有低剂量马兜铃酸的药物仍在我国临床上广泛应用,鉴于马兜铃酸的不良反应,为保障临床用药安全和人民生命安全,对其进行风险评估具有重要意义。因此,对近年来马兜铃酸快速检测和分离技术的原理、应用、优势与不足进行总结,以期为含马兜铃酸的中药及其制剂的风险控制及安全使用提供科学依据。
中药;马兜铃酸;快速检测;分离;吸附剂
马兜铃酸属于硝基菲羧酸类化合物,广泛存在于马兜铃属和细辛属植物中,如马兜铃、细辛等[1-3]。马兜铃科中药在传统中医学领域有着悠久的应用历史,被广泛用作消炎剂、抗癌剂、镇痛剂和利尿剂[4]。然而,20世纪90年代初比利时减肥药事件报道后,摄入含马兜铃酸中药引起肾功能衰竭的事件时有报道,马兜铃酸再一次被推到了舆论的风口浪尖[5-7]。在此情况下,国内外学者对马兜铃酸进行了充分研究,证实马兜铃酸具有肾毒性和致癌性,与肾功能衰竭有关[8]。其中,马兜铃酸I作为马兜铃酸最具代表性的成分,毒性最强,且几乎存在于所有的马兜铃科中药中。由于马兜铃酸的不良反应,一时之间,英国、美国、澳大利亚、日本和西班牙等国相继对含马兜铃酸的中药及其相关产品实行无限期禁用,整个中医药行业都受到严重波及。2003年,我国禁止了含高剂量马兜铃酸传统中药的使用[9-10],但目前市场上仍存在马兜铃属和细辛属中药及其制剂。据不完全统计,已上市的含马兜铃酸的中药材及中成药有300多种,其中《中国药典》2020年版收载的中药材和中成药有55种。为加强对含马兜铃酸中药材及中成药的风险评估,降低其对人体的危害,本文主要对近年来马兜铃酸快速检测及分离技术的原理、应用及优势与不足进行总结,为相关中药材及中成药中马兜铃酸的分析提供参考,并为相关中药及制剂的风险控制及安全使用提供科学依据。
1 马兜铃酸快速检测方法
1.1 经典的检测方法
目前针对马兜铃酸的检测分析方法大多依赖于紫外分光光度法、色谱法和色谱-质谱联用法[11-13]。作为经典的检测分析方法,紫外分光光度法是通过测定待测物的吸光度对其含量进行测定的一种光谱法,具有操作简单、分析速度快的优点,但由于该方法选择性差,因此在复杂样品检测领域应用中具有一定的局限性[14]。
由于紫外分光光度法不具有分离能力,选择性差,因此,在此基础上发展了同时具有分离和分析能力的色谱法。常用于马兜铃酸检测的色谱法包括薄层色谱法和高效液相色谱法。薄层色谱法作为一种简单而经济的方法被广泛用于化学和生物成分的定性分析,由于在固定相和流动相之间的亲和力不同而具有不同移动速率的分析物在薄层色谱板上分离,喷以显色剂或在紫外灯下可以检测到形成的斑点[15]。高效液相色谱法被认为是检测方法中常用的色谱方法,通常用于分离不同类型的化合物,具有出色的分离能力[16]。其主要限制是便携性和基于基质效应、样品类型、样品制备和校准选择的实际问题。因此,需要更先进的检测分析方法。
随着质谱技术的不断发展,液相色谱与质谱联用技术的应用日益广泛。高效液相色谱-质谱联用法是由具有高效分离能力的液相色谱和具有定性能力的质谱结合的一种用于化合物定性和定量的重要分析方法,具有操作简单、高效灵敏、准确可靠等优点,因此被用于解析化合物分子结构或样品的定性定量分析[17]。马兜铃酸经典检测方法的利弊见表1。
表1 马兜铃酸经典检测方法的特点
Table 1 Characteristics of traditional detection methods for aristolochic acids
检测方法优势不足 紫外可见分光光度法分析速度快、操作简单、应用范围广适用于微量分析、待测物浓度不能过高、选择性差 薄层色谱耗时少、设备简单、成本低、可同时处理多个样品、操作方便样品易受空气湿度和温度影响、准确度差、灵敏度和精密度较低 高效液相色谱高灵敏度、重现性好、选择性好、准确度高、易于重现设备昂贵、成本高、故障排除困难、耗时长、溶剂消耗多、需要专业人员操作 高效液相色谱-质谱联用高通量、灵敏度高、准确度高、选择性好仪器设备昂贵、需要专业人员操作、灵敏度依赖于电离技术、耗时长
1.2 新型的快速检测方法
鉴于经典的检测方法预处理步骤复杂和检测耗时较长,因此,快速检测方法作为一种监管手段,成为加强相关中药材及其制剂风险评估的重要步骤,可有效降低临床安全问题的出现。近年来,具有快速检测、简单的预处理以及更好的灵敏度和选择性等显著优势的马兜铃酸快速检测方法发展迅速,主要包括荧光传感器法、酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)、胶体金免疫色谱法(colloidal gold immunochromatography assay,CGICA)和近红外光谱法(near-infrared spectroscopy,NIRS)。
1.2.1 荧光传感器法
(1)概述及检测原理:荧光传感器是一种由荧光基团、识别元件和连接基团构成,将化学信号按一定规律转换成光信号输出的化学传感器装置(图1)。其检测原理为荧光猝灭机制,涉及光致电子转移机制、荧光共振能量转移机制、内滤效应及聚集诱导猝灭机制。其中,金纳米粒子、共轭聚合物、光子晶体、石墨烯、纳米材料和量子点是用于荧光传感器的主要荧光材料[18]。

图1 荧光传感器示意图
(2)应用:目前,一些学者对荧光传感器在马兜铃酸快速检测领域中的应用进行了广泛研究。Wu等[19]使用溶菌酶功能化的金纳米团簇(Lys-AuNCs)作为探针检测马兜铃酸I,检测可在几秒内完成,回收率为117.49%,结果准确,同时对马兜铃酸I的检测具有良好的选择性。此外,在紫外灯照射下,Lys-AuNCs制备的纸基传感器可肉眼直接、快速、特异性检测马兜铃酸I。因此,纸基荧光传感器为中药中马兜铃酸I检测提供了一种便携式且简单的方法。Liu等[20]设计合成了一种新型共轭聚合物[聚(2,5-二(聚乙二醇氧丁酸酯)-1,4-苯乙炔-ALT-1,4-苯乙炔),PPE-OB-PEG]作为荧光传感器,用于马兜铃酸I的检测。结果PPE-OB-PEG的荧光强度随马兜铃酸I浓度的升高而降低,且与马兜铃酸I相互作用在20 s内达到平衡,对马兜铃酸I检测具有较高的选择性。在马兜铃酸I浓度为1.00×10−7~8.00×10−5μmol/L时,PPE-OB-PEG的荧光强度与马兜铃酸I的浓度呈线性关系。PPE-OB-PEG荧光传感器应用于龙胆泻肝丸等中成药中马兜铃酸I的检测,结果准确,证明其在中药中马兜铃酸I快速检测领域具有巨大潜力。李灿鹏等[21]申请的专利公开了一种检测马兜铃酸I的荧光传感器(CQDs-OVA@AuNCs),其应用荧光猝灭的方法对马兜铃酸I进行定量检测。该专利申请的发明点在于克服了现有马兜铃酸I检测技术过于复杂、检测速度慢及对马兜铃酸I识别性较低的缺陷。
(3)潜在的优势与不足:荧光传感器与马兜铃酸的经典光谱分析方法相比,具有多方面的优势,如荧光传感器具有灵敏度高、选择性高、响应快速、成本低和操作简单等优点[22-24]。但同时也存在一些局限性,大多数荧光传感器在进行检测分析时必须依赖于荧光分光光度计。另外,共轭聚合物作为荧光材料在空气中暴露于紫外-可见光下不稳定,进而导致无法准确进行分析检测。
1.2.2 ELISA
(1)概述及检测原理:ELISA是一种免疫学分析方法,基于酶的特异性抗原-抗体识别和高效的生物催化特性,将酶与抗体或抗原结合,催化底物显色转化为可见的颜色信号,将其通过酶标仪分析转换成相应的数字信号,实现对待测物的定量检测分析[25-26]。ELISA被认为是食品药品安全、临床诊断和环境监测等应用领域中的金标准方法[27-30]。常用的ELISA是间接竞争酶联免疫吸附法(indirect competitive enzyme-linked immunosorbent assay,ic-ELISA),其检测原理示意图见图2。

图2 ic-ELISA检测原理
(2)应用:近年来,ic-ELISA被广泛应用于中药中马兜铃酸的检测分析。南铁贵等[31]采用基于马兜铃酸I单克隆抗体的ic-ELISA方法对中药及其制剂中的马兜铃酸I进行了含量测定,结果发现ic-ELISA测得马兜铃酸I的含量高于高效液相色谱法,认为可能是由于马兜铃酸I单克隆抗体与马兜铃酸I结构类似物发生了交叉反应。鉴于马兜铃酸类成分均表现出毒性作用,此检测分析法同样具有实际应用价值。Li等[32]采用免疫和细胞融合的方法筛选得到一种高特异性、高敏感性的单克隆抗体2A8,并建立了检测中药样品中马兜铃酸Ⅰ的ic-ELISA和免疫层析试纸法。ic-ELISA对马兜铃酸I具有特异性检测,免疫层析试纸视觉检测极限和截止极限分别为0.25、0.5 μg/g,肉眼在5 min内可获得检测结果。该方法可成功应用于中药中马兜铃酸I的现场检测和大量样品筛选。
(3)潜在优势与不足:ic-ELISA检测法具有较高的灵敏度,检测限可达ng/mL级,并且由于抗原与抗体的特异性识别而使其具有高度的选择性[33]。与传统的检测分析方法(如液相色谱法、液相色谱-质谱法联用等)相比,ic-ELISA对样品分析速度较快,可在短时间内处理大量样品,节省分析时间,降低成本[34]。但其洗涤步骤、孵化程序繁琐,要求具有丰富经验的专业人员进行操作,这些均限制了其应用。其次,抗体的成本相对昂贵。采用ic-ELISA会存在抗体与密切相关的物质发生交叉反应的现象,对待测物的定量结果产生影响[35]。
1.2.3 CGICA
(1)概述及检测原理:CGICA是一种以酶联免疫吸附法、单克隆抗体技术和胶体金免疫技术为基础的新型体外诊断方法(图3)[36]。其检测原理为将样品滴加到样品垫上,样品通过虹吸作用原理流动至金标结合垫上,如果样品中含有待测物质,待测物质与金标抗体结合后不再与包被抗原反应,T线不显色;若样品中不含有待测物质,金标抗体则与包被抗原反应,T线显色[37]。CGICA法最初用于生物医学领域,后来逐渐应用于药物检测[38]和环境污染监测[39]等领域。随着检测技术的发展,近10年来CGICA应用领域扩展至中药材真伪鉴别及质量的检测[40]。
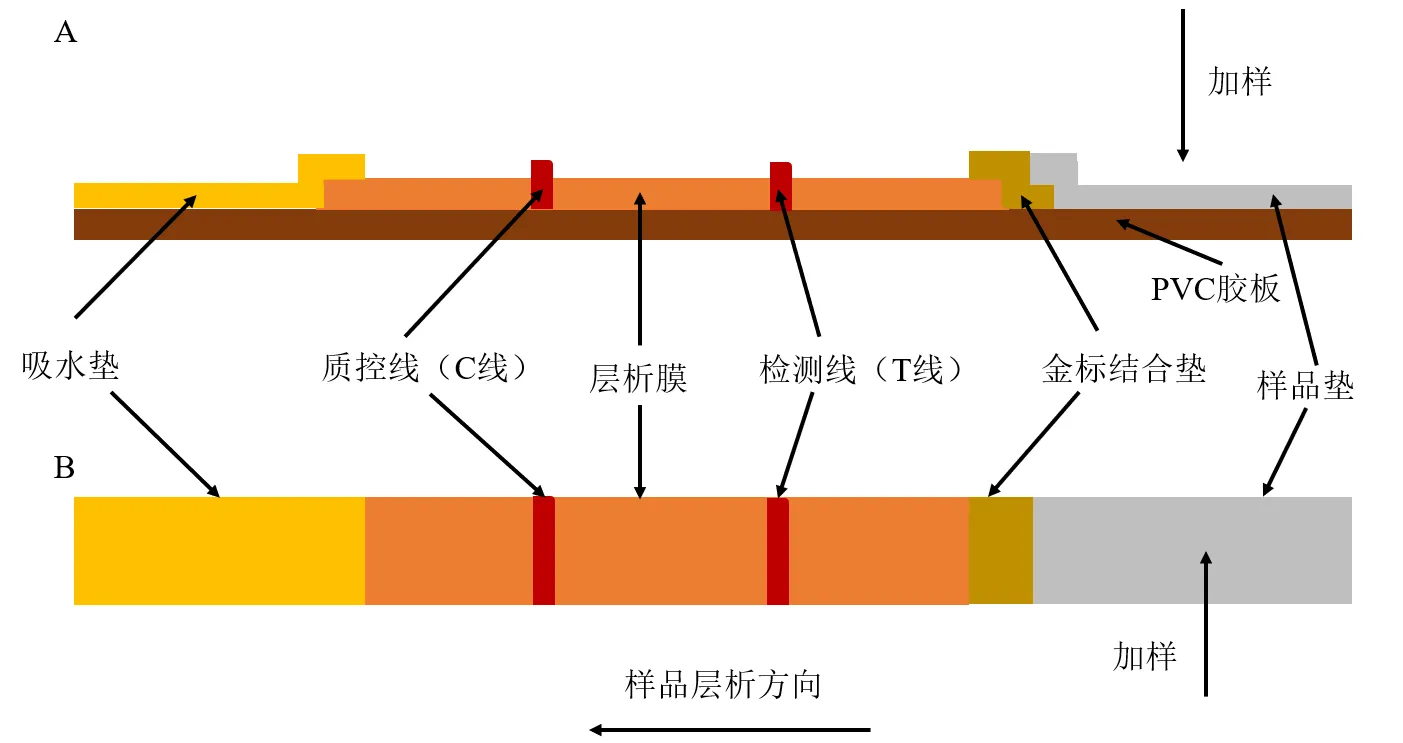
图3 CGICA示意图的侧视图(A) 和俯视图 (B)
(2)应用:目前,CGICA法已应用于中药中马兜铃酸的分析检测。周坚等[41]申请的发明专利公开了一种马兜铃酸I的快速检测卡。该快速检测卡主要由含抗马兜铃酸I单克隆抗体胶体金(或乳胶颗粒)标志物的玻璃纤维膜组成,通过免疫学特异性的方法对中药及中成药中含有的马兜铃酸I进行检测。此检测卡操作简单、检测迅速,能对复杂中药及中成药中的马兜铃酸I实现特异性检测。
(3)潜在的优势与不足:与传统检测方法相比,CGICA法具有多种优势。胶体金呈红色,无需显色标记和复杂的操作技巧,肉眼可在短时间内观察到结果[42-43];不需要昂贵的设备,对操作人员要求不高,结果判断直观,适合于现场和批量检测;无需添加化学试剂,避免ELISA等繁琐的洗涤步骤[44];所需样品量少(50~150 μL)[45]。但是CGICA法只能用于定性或半定量检测,无法实现对待测物的准确定量分析[46]。
1.2.4 NIRS
(1)概述及检测原理:NIRS是一种快速且无损的分析方法,基于样品中分子基团(C-H、N-H和O-H)的振动吸收,测定相应的光谱,利用其组成或性质的相关数据库,采用适当的化学方法建立准确的校正模型,将未知样品与建立的校正模型进行比较,实现对样品的定性和定量分析[47]。图4显示了NIRS检测分析技术流程图。目前该方法已成功应用于定性检测、定量分析和质量控制等领域[48]。
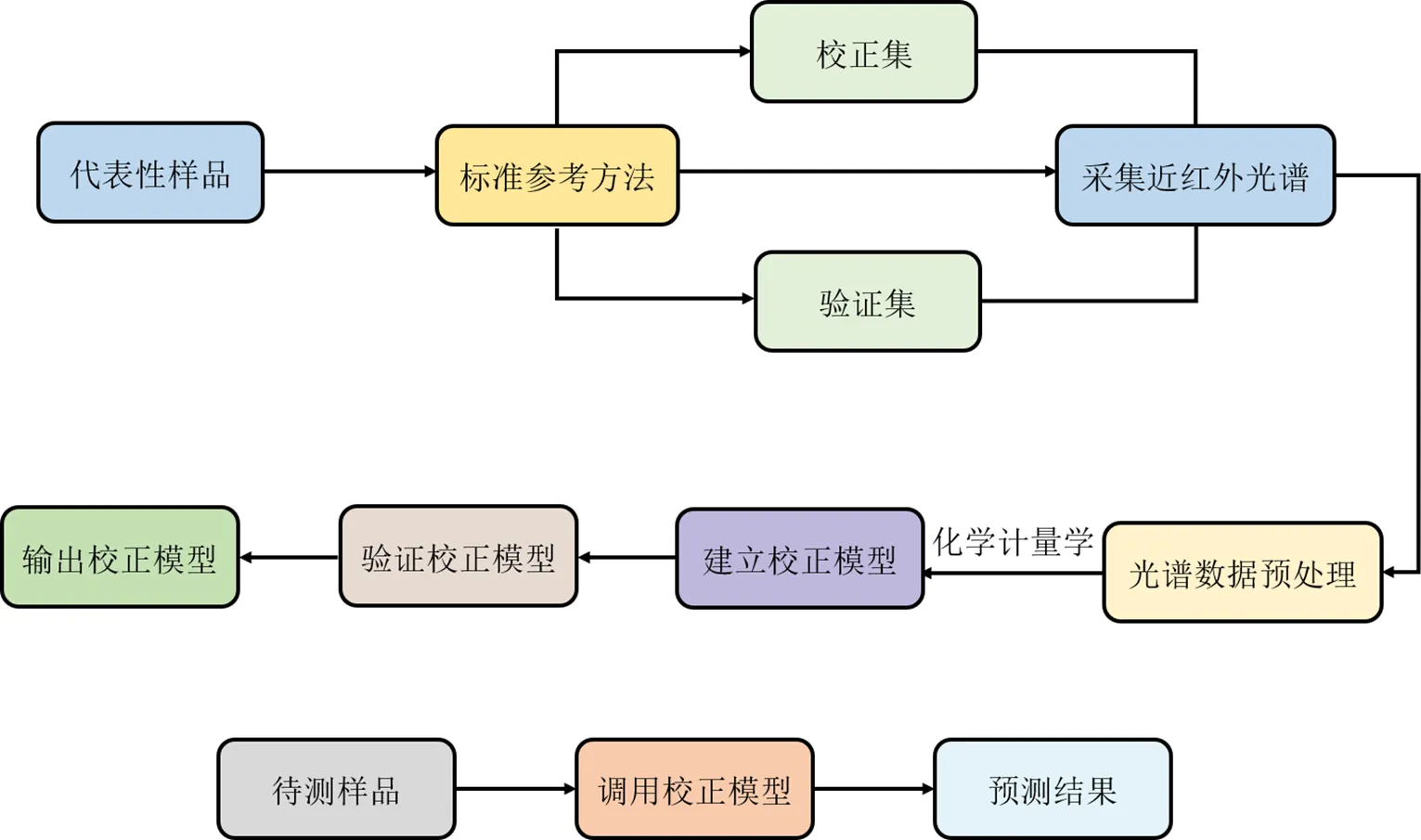
图4 NIRS的技术流程图
(2)应用:近年来,NIRS已应用于中药中马兜铃酸的检测研究。黄婷等[49]运用NIRS方法结合化学计量学方法对关木通、川木通和含有不同浓度马兜铃酸I的淀粉样本中的马兜铃酸进行定性和定量分析。结果显示,定性分析模型可准确检测马兜铃酸,利用NIRS结合化学计量学方法可准确定量中药制剂中马酸铃酸的含量。证明NIRS可作为一种检测中药制剂中马兜铃酸含量的可靠的新方法。
(3)潜在的优势与不足:NIRS作为一种检测分析方法,具有多种优势。分析速度快,一般可在30 s内完成;无试剂,检测中不产生废物,是一种绿色环保的检测方法;成本低,且一次样品采集可同时检测多种指标[50];无损伤,不需破坏样品[51];操作简单。此外,NIRS也不是尽善尽美的,也存在一些缺点。对检测物质的内部成分要求高,要求成分均匀,对受检对象的温度有要求,否则容易造成数据偏差大;需依靠其他学科建立模型,方可进行下一步的分析鉴定;扫描出的某些光谱带特征性不强,峰值不强,重叠谱带多造成测定结果不太灵敏,易受样品成分复杂程度的影响[52-53];NIRS易受外界因素的影响,仪器、温度、湿度、装样条件及样品检测部位等都会导致吸收峰的变化,使NIRS解析更加复杂化[54]。
新型快速检测方法的特点见表2。
表2 马兜铃酸新型快速检测方法的特点
Table 2 Characteristics of new rapid detection methods for aristolochic acids
新型快速检测方法共同优点优点不足之处 荧光传感器高灵敏度、高选择性、高效率成本低、操作简单依赖于仪器设备、共轭聚合物在空气中暴露于紫外-可见光不稳定 ic-ELISA短时间内可处理大量样品依赖于仪器设备、要求经验丰富的专业人员、抗体可能与密切相关的物质发生交叉反应、抗体昂贵 CGICA结果直观可见、不需要昂贵的设备、操作简单、所需样品量少定性或半定量检测 NIRS 分析速度快、操作简单、无损伤、绿色、环保、多组分同时检测对检测物质的内部成分要求高、易受外界因素的影响
2 马兜铃酸分离富集方法
马兜铃酸的毒性作用严重限制了含马兜铃酸中药及其制剂的临床应用。为降低含马兜铃酸中药的毒性,国内外众多研究者进行了广泛的研究,在不影响药材中其他药效成分的情况下,分离富集马兜铃酸,达到去毒存效的目的。近年来,已报道的马兜铃酸分离富集的方法主要为固相萃取法(solid phase extraction,SPE)和超临界流体萃取法(supercritical fluid extraction,SFE)。
2.1 SPE
SPE是一种通过添加吸附剂,对待测组分进行吸附、洗脱等步骤,实现吸附剂对待测组分选择性分离富集的一种方法。近年来,金属-有机框架(metal organic frameworks,MOFs)、分子印迹聚合物(molecularly imprinted polymers,MIPs)、碳纳米管和大孔吸附树脂(macroporous adsorption resin,MAR)等材料逐渐作为吸附剂应用于中药中马兜铃酸的固相萃取过程中,大大提高了分离富集效率和选择性。
2.1.1 MOFs
(1)概述及分离富集原理:MOFs材料是新兴的多孔材料,通常由金属节点和有机连接体之间形成配位键构成[55]。在分离富集过程中,MOFs材料作为主体,其内部规则的孔道结构可为待测物质提供空间,同时,通过氢键、π-π堆积和静电作用等超分子作用,可选择性地分离富集待测物质。其分离富集示意图见图5。
(2)应用:近年来,越来越多的学者将MOFs材料应用于中药中马兜铃酸的分离富集研究。Shu等[56]将三聚氰胺修饰到MOFs材料上,获得了比表面积高、形态均匀的复合材料,表现出对马兜铃酸I的高吸附容量、高选择性和高吸附分离效率。以该材料为吸附剂,应用于微固相萃取,可选择性识别和分离富集中药中的马兜铃酸I。Zhang等[57]通过原位聚合方法以功能化的UiO-66-NH2和-甲基丙烯酰胺为常用单体合成了MOFs复合材料,并将其用作固相萃取的吸附剂,结果发现,该方法操作简单、回收率高,可用于中药中马兜铃酸I的分离富集。Fang等[58]为了有效和选择性地分离马兜铃酸I,将离子液体和MIPs固定于MOFs材料ZIF-67,在甲醇-水(95∶5)体系中于39 ℃、138 min时对马兜铃酸I的最高吸附量为34.25 mg/g。将其用于固相萃取的吸附剂,经上样、洗涤和洗脱过程后,从天仙藤提取物中分离0.043 mg/g马兜铃酸I,回收率为97.67%~106.98%,表明MOFs材料可成功分离富集马兜铃酸I。
(3)潜在的优势与不足:MOFs材料具有高比表面积、高孔隙率的优势。通过改变有机和无机组分的组合,可非常灵活、合理地调整MOFs的几何形状、结构、组成和性能[59]。基于以上独特的优势,对目标分析物表现出较高的吸附能力和高选择性分离性能。但MOFs材料在水中不稳定,结构易坍塌,金属离子泄露会对待测样品产生二次污染。此外,合成后得到的MOFs材料,其表面和孔道内会残留一些在合成过程中所用的有机溶剂、金属盐和配体等物质,这些残留物质通常会降低材料的比表面积、堵塞其孔道,对后续应用产生影响,因此通常采用有机溶剂对其浸泡、洗涤以去除表面和孔道内残留的金属盐和有机配体,但这一过程消耗有机溶剂和时间[60]。
2.1.2 MIPs
(1)概述及分离富集原理:分子印迹法是由功能性单体、交联剂和以目标分析物或结构类似物作为模板合成特定MIPs的一种方法,其原理为去除模板后,MIPs中会产生与目标分析物或结构类似物大小、形状和功能互补的空腔,使MIPs具有特异性识别和吸附目标分析物或结构类似物的作用[61-62]。图6显示了MIPs制备过程。

图6 MIPs制备示意图
(2)应用:目前,国内外学者将MIPs广泛应用于中药中马兜铃酸的分离去除研究。Xiong等[63]通过表面分子印迹法合成了热敏和磁性MIPs,对马兜铃酸I表现出优越的吸附性能、选择性和快速磁分离能力。采用分散SPE分离富集鱼腥草中的马兜铃酸I,回收率为79.03%~99.67%。张悦美等[64]运用表面分子印迹法合成了核-壳结构SiO2表面分子印迹复合材料(SiO2@MIP NPs),其表现出对马兜铃酸I高的吸附性能和选择性吸附效果。将SiO2@MIP NPs用于加标中药川木通中马兜铃酸I的吸附,可有效将马兜铃酸I去除,回收率为73%~83%。陆雅婷等[65]以Fe3O4为载体,制备了磁性MIPs,并将其应用于马兜铃酸I的吸附,结果表明,其对马兜铃酸I具有高吸附容量,为实现中药中马兜铃酸I的分离富集提供了一种新思路。
Xiao等[66]通过RAFT沉淀聚合技术以马兜铃酸I为模板分子成功制备了MIPs,在结构类似物的存在下,证明了MIPs对马兜铃酸Ⅰ优良的选择性分离富集性能,并能够成功从关木通提取液中选择性分离富集马兜铃酸I。Wang等[67]采用虚拟模板分子1,10-菲咯啉-4-羧酸制备了分子印迹二氧化硅材料,结果表明二氧化硅与马兜铃酸I的亲和力强(8.12 mg/g),同时,其对马兜铃酸I表现出优异的特异性识别能力,成功从朱砂莲根提取物中分离富集马兜铃酸I。
Ge等[68]使用毒性较小的氧氟沙星为虚拟模板,制备了表面MIPs,并将其作为固相萃取的吸附剂,用于中药中马兜铃酸I的选择性分离。结果表明,马兜铃酸I富集可达16倍,能够选择性分离马兜铃酸I。傅强等[69]申请的发明专利公开了一种应用MIPs从中成药龙胆泻肝丸中富集与检测微量马兜铃酸I的方法,结果显示,该方法能够实现马兜铃酸I的特异性富集,且具有富集容量高、操作简单的特点。
(3)潜在的优势与不足:MIPs具有稳定性高的优点,包括耐压、耐高温等。其次,MIPs结构可设计,根据目标物质,有针对性地设计制备出具有选择性的MIPs,从而实现对目标物质的有效分离。此外,MIPs还具有特异识别性,MIPs与模板分子在空间结构、尺寸大小上完全吻合,因此,能够特异性识别目标物质。但MIPs依然存在较多问题,如聚合方法和功能单体的种类有局限性,不能满足某些分子的识别分离要求;MIPs合成过程模板分子难以从孔中完全洗脱,需要消耗大量溶剂;MIPs是一个高度交联的聚合物,使得模板分子在MIPs中的扩散缓慢且印迹孔穴埋藏过深不便使用[70]。
2.1.3 碳纳米管
(1)概述及分离富集原理:碳纳米管是一种由单层或多层石墨卷曲形成的中空管状结构的碳基材料,按其分层方式,分为单壁碳纳米管和多壁碳纳米管[71]。碳纳米管对目标分析物的分离富集受多种相互作用(π-π、氢键、共价键、静电相互作用和疏水作用)的影响[72],此外,还受孔道结构(孔径大小、分布和孔形状)的影响,只有当目标分析物分子的直径小于碳纳米管的孔径时,才能被吸附到碳纳米管的吸附位点上[73]。其分离富集原理示意图见图7。

图7 碳纳米管分离富集原理示意图
(2)应用:近年来,碳纳米管已广泛应用于马兜铃酸的吸附分离。Shu等[74]设计合成了一种腺嘌呤修饰的磁性碳纳米管复合材料,其通过π- π相互作用、氢键作用和静电作用对马兜铃酸I表现出良好的吸附性能(24.5 μg/mg)。将其作为吸附剂,进行磁性固相萃取,马兜铃酸I和马兜铃酸II回收率分别为92.7%~97.5%、92.6%~99.4%,表明腺嘌呤修饰的磁性碳纳米管复合材料能够从复杂基质中有效富集和分离马兜铃酸。Li等[75]合成的MIPs功能化的磁性碳纳米管(MCNTs@AAI-MIPs)对马兜铃酸I具有快速的分离速率(10 s),较短的动力学平衡时间(15 min)和良好的选择性(印迹因子3.17)。此外,MCNTs@AAI-MIPs对中药中马兜铃酸I的回收率范围为80%~110%(RSD值为3.27%~8.16%),证明其可以有效且特异性地从实际复杂的中药中分离富集马兜铃酸I。
(3)潜在的优势与不足:碳纳米管由于具有疏水性、高比表面积、层状中空结构、丰富的官能团、结构可调、高机械强度和化学稳定性等特点,对目标分析物具有很强的吸附分离能力[76-78]。但碳纳米管在多种溶剂中溶解性较差,限制了其在多种领域的应用,需对其进行修饰。
2.1.4 MAR
(1)概述及分离富集原理:MAR是一种具有空间网状结构的人工多孔聚合物,同时是具有吸附性和筛选性原理的一种分离介质。利用与被吸附物质之间的范德华作用力,通过其巨大的比表面积进行物理吸附,以及筛选性,筛选得到相对分子质量大小匹配的物质,达到分离富集的目的[79-80]。
(2)应用:近年来,MAR已成功应用于马兜铃科植物中马兜铃酸的分离去除。王翰[81]研究关木通中马兜铃酸的分离工艺,采用MAR分离关木通中的马兜铃酸,结果发现,关木通提取物经MAR处理后,样品质量分数达到41%,证明MAR可用于分离去除关木通中的马兜铃酸。
(3)潜在的优势与不足:MAR具有比表面积大、吸附容量大、吸附速度快、解吸条件温和、可回收、化学稳定性好、运行成本低、效率高、溶剂消耗少、寿命长、选择性好等优点,是一种很有前景的吸附剂。在单一MAR分离方法中,由于不同MAR的结构参数不同,对于具有相似结构组分的分离,回收率和分离效果较差。因此,有必要对MAR进行筛选和组合[82]。但筛选和组合出分离效率最佳的MAR工作量巨大。
2.2 SFE
2.2.1 概述及分离富集原理 超临界流体(supercritical fluid,SCF)是温度和压力高于其临界点的流体。SFE采用SCF为萃取溶剂,利用SCF的溶解能力(极性)可通过控制流体的温度和压力调节,从而可选择性地提取分离多种化合物[83]。SFE工艺流程示意图见图8。目前,大多以二氧化碳作为首选萃取溶剂,称为超临界二氧化碳萃取。

图8 SFE工艺流程的示意图
2.2.2 应用 目前,已有研究者将SFE应用于马兜铃植物中马兜铃酸的分离去除研究。如Liang等[84]采用SFE分离去除马兜铃和关木通中的马兜铃酸。以容器压力19.4 MPa,温度50 ℃,夹带剂浓度0.2摩尔分数,萃取时间4 h为SCF萃取条件。结果显示,马兜铃和关木通中马兜铃酸Ⅰ的去除率分别为65.2%、59.1%,马兜铃酸II的去除率分别为81.3%、81.2%,证实了采用SFE从2种代表性马兜铃植物中去除有毒成分马兜铃酸的可行性。
2.2.3 潜在的优势与不足 SFE是经典和传统溶剂萃取的一种很有前途的替代方法,它具有各种独特的优势。如分离效率高、分析时间短;提取分离过程中,不使用有机溶剂,减少对人类健康和环境的不利影响,是一种绿色的分离方法[85];通过调节温度和压力实现对待测成分的选择性提取分离,操作简单;二氧化碳具有毒性低、易燃性、可回收、成本低及纯度高等优点[86]。尽管SFE具有多种优势,但仍然存在局限性。购买设备、启动和运行该过程的成本很高,另外,SFE难以分离强极性组分,需添加有机溶剂作为改性剂提高分离效率,但在净化步骤中需分离改性剂[87]。
马兜铃酸2种分离富集方法具有分离能力强、选择性高的共同优点,其具体特点见表3。
3 结语与展望
中药是中医学的瑰宝和灵魂,是中华民族几千年历史长河中沉淀下来的宝贵财富。马兜铃科中药具有显著的抗炎、抗癌和利尿作用,常被用于治疗多种疾病。马兜铃科中药毒性事件的报道造成人们对其毒性的关注大于其功效作用。然而药物作用具有双重性,通过合理的手段对其毒性进行控制,达到去毒存效的目的,含马兜铃酸中药仍能发挥重要功效[88]。为发挥马兜铃科中药的药用价值和提高其用药安全性,加强其安全性评价及风险控制研究,迫切需要对马兜铃科中药中的马兜铃酸进行检测与分离。基于目前的研究现状,现有的快速检测技术检测效率高,但大多依赖于检测分析仪器。由于CGICA不依赖于分析仪器,所以未来可在CGICA试纸条的研究方面加大力度,实现对马兜铃酸的现场快速检测。现有的分离富集马兜铃酸所采用的吸附剂存在各自的特点。MOFs材料结构不稳定,会引发二次污染;MIPs印迹孔穴埋藏过深不便使用;碳纳米管需进行结构修饰实现对其选择性分离富集;MAR在组合和筛选环节中工作量较大。考虑到马兜铃科中药的药理作用,开发一种结构稳定及绿色、环保的吸附材料是未来的研究方向。共价有机框架材料作为一种新兴的多孔材料,其较高的比表面积、可调节的孔径、规则的孔道结构和较高的结构稳定性,使其在吸附领域应用广泛,未来可设计一种共价有机框架材料用于马兜铃科中药中马兜铃酸的分离,为保障含马兜铃酸药材与制剂的风险控制提供科学依据与参考。
表3 马兜铃酸分离富集方法的特点
Table 3 Characteristics of enrichment methods for aristolochic acids
分离富集方法吸附剂优点不足之处 SPEMOFs材料高比表面积、灵活的功能金属位点结构不稳定、材料处理消耗时间 MIPs高稳定性聚合方法和功能单体种类有局限性、模板分子扩散缓慢且印迹孔穴埋藏过深 碳纳米管疏水性、高比表面积、官能团丰富、化学稳定性好溶解性较差 MAR吸附速度快、化学稳定性好、成本低、溶剂消耗少筛选和组合分离效率最佳的MAR工作量巨大 SFE 效率高、无有机溶剂、操作简单成本高、难以分离强极性组分
利益冲突 所有作者均声明不存在利益冲突
[1] 梁爱华, 高月, 张伯礼. 含马兜铃酸中药的安全性问题及对策 [J]. 中国食品药品监管, 2017(11): 17-20.
[2] 姜峰, 岳丽君, 朱丹. 马兜铃酸毒副作用研究概述 [J]. 中国药物评价, 2021, 38(5): 405-408.
[3] 柏兆方, 徐广, 王伽伯, 等. 马兜铃酸及其衍生物致癌性研究进展及应对措施 [J]. 药学进展, 2018, 42(3): 164-169.
[4] Kumar V, Poonam, Prasad A K,. Naturally occurring aristolactams, aristolochic acids and dioxoaporphines and their biological activities [J]., 2003, 20(6): 565-583.
[5] Vanherweghem J L, Depierreux M, Tielemans C,. Rapidly progressive interstitial renal fibrosis in young women: Association with slimming regimen including Chinese herbs [J]., 1993, 341(8842): 387-391.
[6] Arlt V M, Ferluga D, Stiborova M,. Is aristolochic acid a risk factor for Balkan endemic nephropathy-associated urothelial cancer? [J]., 2002, 101(5): 500-502.
[7] de Jonge H, Vanrenterghem Y. Aristolochic acid: The common culprit of Chinese herbs nephropathy and Balkan endemic nephropathy [J]., 2008, 23(1): 39-41.
[8] Debelle F D, Vanherweghem J L, Nortier J L. Aristolochic acid nephropathy: A worldwide problem [J]., 2008, 74(2): 158-169.
[9] 郝近大. 从关木通被禁用, 看本草考证的重要性 [J]. 中药材, 2003, 26(S1): 16-17.
[10] 田婧卓, 梁爱华, 刘靖, 等. 从马兜铃酸含量影响因素探讨含马兜铃酸中药的风险控制 [J]. 中国中药杂志, 2017, 42(24): 4679-4686.
[11] 刘欣欣, 王莉, 肖红斌. 不同产地马兜铃药材中马兜铃总酸的含量 [J]. 时珍国医国药, 2017, 28(1): 74-76.
[12] 罗疆南, 王银红, 杨青, 等. UPLC法测定二十五味竺黄散中马兜铃酸Ⅰ含量的方法研究 [J]. 中兽医医药杂志, 2021, 40(5): 18-20.
[13] 刘嘉澍, 妙苗, 李青, 等. LC-MS/MS法测定跳骨片中马兜铃酸I含量 [J]. 亚太传统医药, 2021, 17(8): 67-70.
[14] 汪琳, 赵相鹏, 尹羿, 等. 食品安全检测技术的现状和发展趋势 [J]. 中国口岸科学技术, 2021, 3(6): 65-70.
[15] 张伟, 马青青, 张二鹏, 等. 粮食及其制品中真菌毒素检测及风险评估技术的研究进展 [J]. 中国卫生检验杂志, 2022, 32(5): 636-640.
[16] 李宇, 刘洪海. 格列本脲检测方法的研究进展 [J]. 中国现代应用药学, 2022, 39(6): 848-855.
[17] 陈林林, 郑凤鸣, 范天娇, 等. 食品中香兰素检测方法研究进展 [J]. 中国调味品, 2022, 47(5): 206-211.
[18] Umapathi R, Park B, Sonwal S,. Advances in optical-sensing strategies for the on-site detection of pesticides in agricultural foods [J]., 2022, 119: 69-89.
[19] Wu S Q, Yin K P, Sun Y,. Gold nanoclusters-based paper sensor for the visualized detection of nephrotoxic aristolochic acids [J]., 2021, 340: 129792.
[20] Liu J L, Xu C L, Yang T,. Developed a novel sensor based on fluorescent graft conjugated polymer for the determination of aristolochic acid in traditional Chinese medicine [J]., 2019, 222: 117239.
[21] 李灿鹏, 谭双, 赵卉. 一种检测马兜铃酸A荧光传感器的制备方法: 中国, CN109632736A [P]. 2019-04-16.
[22] Wang L, Wei Z L, Chen Z Z,. A chemical probe capable for fluorescent and colorimetric detection to Cu2+and CN−based on coordination and nucleophilic addition mechanism [J]., 2020, 155: 104801.
[23] Pan H, Liu Y J, Liu S Z,. A dual-function colorimetric probe based on carbazole-cyanine dyad for highly sensitive recognition of cyanide and hypochlorous acid in aqueous media [J]., 2019, 202: 329-335.
[24] Sun X Y, Wang Y, Deng X H,. A colorimetric and ratiometric fluorescent probe for the selective detection of cyanide anions in aqueous media and living cells [J]., 2016, 6(13): 10266-10271.
[25] Gao Y, Zhou Y Z, Chandrawati R. Metal and metal oxide nanoparticles to enhance the performance of enzyme-linked immunosorbent assay (ELISA) [J]., 2020, 3(1): 1-21.
[26] Canalle L A, Vong T, Adams P H,. Clickable enzyme-linked immunosorbent assay [J]., 2011, 12(10): 3692-3697.
[27] Esen C, Czulak J, Cowen T,. Highly efficient abiotic assay formats for methyl parathion: Molecularly imprinted polymer nanoparticle assay as an alternative to enzyme-linked immunosorbent assay [J]., 2019, 91(1): 958-964.
[28] Pi J L, Long Y J, Huang N,. A sandwich immunoassay for detection of Aβ1~42based on quantum dots [J]., 2016, 146: 10-15.
[29] Wu L, Li G H, Xu X,. Application of nano-ELISA in food analysis: Recent advances and challenges [J]., 2019, 113: 140-156.
[30] Zhao C Y, Si Y, Pan B F,. Design and fabrication of a highly sensitive and naked-eye distinguishable colorimetric biosensor for chloramphenicol detection by using ELISA on nanofibrous membranes [J]., 2020, 217: 121054.
[31] 南铁贵, 何素平, 谭桂玉, 等. 中药致肾毒性成分马兜铃酸A单抗制备及酶联免疫分析方法的建立 [J]. 分析化学, 2010, 38(8): 1206-1210.
[32] Li S Z, Wu X L, Song S S,. Development of ic-ELISA and an immunochromatographic strip assay for the detection of aristolochic acid I [J]., 2019, 30(1): 140-149.
[33] Wang Y, Cao J B, Sun Y N,. Development and validation of a sensitive enzyme-linked immunosorbent assay for clonidine hydrochloride in pig urine and pork samples [J]., 2021, 32(1): 851-862.
[34] Chen Y N, Liu L Q, Song S S,. Establishment of a monoclonal antibody-based indirect enzyme-linked immunosorbent assay for the detection of trimethoprim residues in milk, honey, and fish samples [J]., 2016, 27(6): 830-840.
[35] Shan G M, Embrey S K, Schafer B W. A highly specific enzyme-linked immunosorbent assay for the detection of Cry1Ac insecticidal crystal protein in transgenic WideStrike cotton [J]., 2007, 55(15): 5974-5979.
[36] Lin L, Song S S, Wu X L,. A colloidal gold immunochromatography test strip based on a monoclonal antibody for the rapid detection of triadimefon and triadimenol in foods [J]., 2020, 31(1): 447-462.
[37] Duan Y P, Luo J Y, Liu C M,. Rapid identification of triptolide inproducts by gold immunochromatographic assay [J]., 2019, 168: 102-112.
[38] Zhou X H, Li N, Sun C,. Development of a colloidal gold immunochromatographic strip for the rapid detection of pefloxacin in grass carp with a novel pretreatment method [J]., 2022, 57(7): 517-525.
[39] Xing C R, Liu L Q, Song S S,. Ultrasensitive immunochromatographic assay for the simultaneous detection of five chemicals in drinking water [J]., 2015, 66: 445-453.
[40] 李耀磊, 刘丽娜, 姚云, 等. 基于胶体金免疫层析技术对中药材中黄曲霉毒素B1的定量检测研究 [J]. 中国药学杂志, 2019, 54(17): 1432-1437.
[41] 周坚, 汤朝阳, 李云峰. 一种马兜铃酸A快速检测卡及其检测方法: 中国, CN104897890B [P]. 2017-01-04.
[42] Nato F, Boutonnier A, Rajerison M,. One-step immunochromatographic dipstick tests for rapid detection ofO1 and O139 in stool samples [J]., 2003, 10(3): 476-478.
[43] Sithigorngul P, Rukpratanporn S, Pecharaburanin N,. A simple and rapid immunochromatographic test strip for detection of pathogenic isolates of[J]., 2007, 71(3): 256-264.
[44] Guo A L, Sheng H L, Zhang M,. Development and evaluation of a colloidal gold immunochromatography strip for rapid detection ofin food [J]., 2012, 35(5): 366-371.
[45] Yang Y Q, Yang Y C, Liu M H,. FRET-created traffic light immunoassay based on polymer dots for PSA detection [J]., 2019: 1493-1501.
[46] 司芳芳, 郭逸蓉, 赵颖, 等. 纳米标记免疫层析法在农药残留检测中的应用研究进展 [J]. 农药学报, 2017(4): 409-417.
[47] 王绪新. 近红外光谱技术在中药鉴定中的应用研究 [J]. 中国实用医药, 2013, 8(8): 254.
[48] 孟超. 近红外光谱分析技术在药品快速检测中的进展 [J]. 化工设计通讯, 2022, 48(4): 212-214.
[49] 黄婷, 赵如意, 徐文林, 等. 基于近红外光谱技术快速检测中药制剂中马兜铃酸含量的实验研究 [J]. 福建医药杂志, 2019, 41(2): 122-126.
[50] Lin H J, Ying Y B. Theory and application of near infrared spectroscopy in assessment of fruit quality: A review [J]., 2009, 3(2): 130-141.
[51] Roggo Y, Chalus P, Maurer L,. A review of near infrared spectroscopy and chemometrics in pharmaceutical technologies [J]., 2007, 44(3): 683-700.
[52] 李雪. 不同产地油菜籽品质比较研究 [D]. 咸宁: 湖北科技学院, 2019.
[53] 汪鑫, 田花丽, 马卓, 等. 近红外光谱技术在油料作物快速检测中的应用研究进展 [J]. 食品研究与开发, 2021, 42(22): 220-224.
[54] 彭秋实. 近红外光谱技术在布洛芬复方片制备工艺中的应用研究 [D]. 贵阳: 贵州大学, 2018.
[55] Yan L, Chen X F, Wang Z G,. Size controllable and surface tunable zeolitic imidazolate framework-8-poly(acrylic acid sodium salt) nanocomposites for pH responsive drug release and enhancedcancer treatment [J]., 2017, 9(38): 32990-33000.
[56] Shu H, Chen G N, Wang L,. Metal-organic framework grafted with melamine for the selective recognition and miniaturized solid phase extraction of aristolochic acid I from traditional Chinese medicine [J]., 2021, 1647: 462155.
[57] Zhang M M, Liu H Y, Han Y M,. On-line enrichment and determination of aristolochic acid in medicinal plants using a MOF-based composite monolith as adsorbent [J]., 2020, 1159: 122343.
[58] Fang L W, Tian M L, Row K H,. Isolation of aristolochic acid I from herbal plant using molecular imprinted polymer composited ionic liquid-based zeolitic imidazolate framework-67 [J]., 2019, 42(19): 3047-3053.
[59] Annamalai J, Murugan P, Ganapathy D,. Synthesis of various dimensional metal organic frameworks (MOFs) and their hybrid composites for emerging applications - A review [J]., 2022, 298: 134184.
[60] Howarth A J, Peters A W, Vermeulen N A,. Best practices for the synthesis, activation, and characterization of metal–organic frameworks [J]., 2017, 29: 26-39.
[61] Morsi S M M, Abd El-Aziz M E, Mohamed H A. Smart polymers as molecular imprinted polymers for recognition of target molecules [J]., 2022: 1-24.
[62] Haupt K, Linares A V, Bompart M,. Molecularly imprinted polymers [J]., 2012, 325: 1-28.
[63] Xiong H H, Fan Y, Mao X J,. Thermosensitive and magnetic molecularly imprinted polymers for selective recognition and extraction of aristolochic acid I [J]., 2022, 372: 131250.
[64] 张悦美, 郭丽华, 李一峻, 等. 分子印迹聚合物功能化二氧化硅纳米颗粒的合成及其分离识别马兜铃酸 [J]. 色谱, 2021, 39(10): 1137-1145.
[65] 陆雅婷, 苏志恒, 梁永红. 马兜铃酸Ⅰ磁性分子印迹聚合物的制备 [J]. 广西医科大学学报, 2021, 38(1): 183-188.
[66] Xiao Y H, Xiao R, Tang J,. Preparation and adsorption properties of molecularly imprinted polymer via RAFT precipitation polymerization for selective removal of aristolochic acid I [J]., 2017, 162: 415-422.
[67] Wang L H, Zhang C Y, Chen Y J,. Dummy molecularly imprinted silica materials for effective removal of aristolochic acid I from kaempfer dutchmanspipe root extract [J]., 2020, 152: 104463.
[68] Ge Y H, Guo P Q, Xu X Y,. Selective analysis of aristolochic acid I in herbal medicines by dummy molecularly imprinted solid-phase extraction and HPLC [J]., 2017, 40(13): 2791-2799.
[69] 傅强, 葛燕辉, 余佩, 等. 从中成药龙胆泻肝丸中富集与检测微量马兜铃酸A的方法: 中国, CN106770784B [P]. 1970-01-19.
[70] Dong C Y, Shi H X, Han Y R,. Molecularly imprinted polymers by the surface imprinting technique [J]., 2021, 145: 110231.
[71] Chakraborty P, Ma T F, Zahiri A H,. Carbon-based materials for thermoelectrics [J]., 2018, 2018: 3898479.
[72] 尹东. 碳纳米管对环境污染物的吸附及其影响因素 [J]. 环境科学与技术, 2021, 44(S2): 276-283.
[73] Ma Y F, Yang L, Wu L,. Carbon nanotube supported sludge biochar as an efficient adsorbent for low concentrations of sulfamethoxazole removal [J]., 2020, 718: 137299.
[74] Shu H, Chen G N, Wang L,. Adenine-coated magnetic multiwalled carbon nanotubes for the selective extraction of aristolochic acids based on multiple interactions [J]., 2020, 1627: 461382.
[75] Li F, Gao J, Li X X,. Preparation of magnetic molecularly imprinted polymers functionalized carbon nanotubes for highly selective removal of aristolochic acid [J]., 2019, 1602: 168-177.
[76] Gao Q, Wu F, Hu J,. Chemical composition-dependent removal of cationic surfactants by carbon nanotubes [J]., 2020, 716: 137017.
[77] Nadolska M, Prześniak-Welenc M, Łapiński M,. Synthesis of phosphonated carbon nanotubes: New insight into carbon nanotubes functionalization [J].(), 2021, 14(11): 2726.
[78] Gopinath K P, Vo D V N, Gnana Prakash D,. Environmental applications of carbon-based materials: A review [J]., 2021, 19(1): 557-582.
[79] Zhao Y Y, Chen Z B, Liu D L,. Separation of flavonoids in the leaves ofby macroporous adsorption resin mixed-bed technology [J]., 2017, 46(3): 235-243.
[80] 刘晓燕. 大孔吸附树脂分离纯化东北岩高兰、紫菀等中药有效成分的研究 [D]. 聊城: 聊城大学, 2019.
[81] 王翰. 含马兜铃酸类中药 (关木通) 毒性成分研究 [D]. 成都: 成都中医药大学, 2004.
[82] Zhang X Y, Wang R T, Zhao Y Y,. Separation and purification of flavonoids fromusing macroporous adsorption resin [J]., 2021, 50(6): 574-584.
[83] Lang Q, Wai C M. Supercritical fluid extraction in herbal and natural product studies - a practical review [J]., 2001, 53(4): 771-782.
[84] Liang Q Y, Chow A H L, Wang Y T,. Removal of toxic aristolochic acid components fromplants by supercritical fluid extraction [J]., 2010, 72(3): 269-274.
[85] Liu L X, Zhang Y, Zhou Y,. The application of supercritical fluid chromatography in food quality and food safety: An overview [J]., 2020, 50(2): 136-160.
[86] Poojary M M, Barba F J, Aliakbarian B,. Innovative alternative technologies to extract carotenoids from microalgae and seaweeds [J]., 2016, 14(11): E214.
[87] Pourmortazavi S M, Saghafi Z, Ehsani A,. Application of supercritical fluids in cholesterol extraction from foodstuffs: a review [J]., 2018, 55(8): 2813-2823.
[88] 王潇晗, 张连学, 郜玉钢, 等. 含马兜铃酸中药减毒的研究进展[J]. 中草药, 2013, 44(22): 3241-3244.
Research progress on rapid detection and separation techniques of aristolochic acids in traditional Chinese medicine
SHAO Xin, ZHANG Yue, ZHENG Yan-xue, WANG Yuan-yuan, WEI Jin-xia, LI Yu-bo
School of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
Aristolochic acids are a kind of nitro-phenanthrene carboxylic acid compounds widely existing inspecies andspecies. Because of their irreversible nephrotoxicity, the US Food and Drug Administration ordered to stop importing, manufacturing and selling raw materials and medicines containing aristolochic acids in June, 2000. Subsequently, countries and regions around the world have suspended the use of medicines containing aristolochic acids. However, at present, some drugs containing low-dose aristolochic acids are still widely used clinically in China. In view of the toxic and side effects of aristolochic acids, it is of great significance to carry out risk assessment to ensure the safety of clinical medication and people’s lives. Therefore, the principle, application, advantages and disadvantages of rapid detection and separation technologies of aristolochic acids in recent years were summarized in this paper, in order to provide scientific basis for risk control and safe use of traditional Chinese medicine and their preparations containing aristolochic acids.
traditional Chinese medicine; aristolochic acids; rapid detection; separate; adsorbent
R284.1
A
0253 - 2670(2022)19 - 6200 - 13
10.7501/j.issn.0253-2670.2022.19.026
2022-06-20
国家自然科学基金面上项目(81873194);国家中医药管理局青年岐黄学者支持项目
邵 鑫(1996—),女,硕士研究生,研究方向为中药安全性评价研究。E-mail: shaoxin969@163.com
魏金霞(1987—),女,讲师,研究方向为中药安全性评价研究。E-mail: syykdxwjx410@163.com
李遇伯(1978—),女,教授,博士生导师,研究方向为中药安全性评价研究。E-mail: yaowufenxi001@sina.com
[责任编辑 崔艳丽]

