基于JAK1/STAT3信号通路研究高车前素对肝纤维化小鼠的影响
徐 冲,秦小东,任 丽,罗先钦*
基于JAK1/STAT3信号通路研究高车前素对肝纤维化小鼠的影响
徐 冲1,秦小东1,任 丽2,罗先钦2*
1. 重庆市中医院 药剂科,重庆 400021 2. 重庆医科大学中医药学院,重庆 400016
基于Janus激酶1(Janus kinase 1,JAK1)和转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路研究高车前素对四氯化碳(carbon tetrachloride,CCl4)诱导肝纤维化(hepatic fibrosis,HF)小鼠的影响。小鼠连续6周背部sc CCl4溶液制备HF模型,将HF小鼠随机分为模型组、秋水仙碱(2 mg/kg)组和高车前素高、低剂量(30、10 mg/kg)组,各给药组连续4周ip相应药物,末次给药后24 h制备血清,计算肝脏指数;采用全自动生化分析仪测定血清中丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)活性及总胆红素(total bilirubin,TBIL)水平;测定血清和肝组织中羟脯氨酸(hydroxyproline,Hyp)水平;测定肝组织中丙二醛(malondialdehyde,MDA)、还原型谷胱甘肽(glutathione,GSH)水平及超氧化物歧化酶(superoxide dismutase,SOD)活性;检测血清中透明质酸(hyaluronic acid,HA)、层黏连蛋白(laminin,LN)、III型前胶原(type III procollagen,PIIINP)、IV型胶原(type IV collagen,Col-IV)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和IL-6水平;采用苏木素-伊红(HE)染色观察肝组织病理改变;采用qRT-PCR法检测肝组织中尿激酶型纤溶酶原激活物(urokinase type plasminogen activator,)和纤溶酶原激活物抑制因子-1(plasminogen activator inhibitor-1,)mRNA表达;采用Western blotting检测肝组织中JAK1/STAT3信号通路中相关蛋白表达。与模型组比较,高车前素组小鼠体质量显著增加(<0.05、0.01),肝脏指数显著降低(<0.05、0.01);血清中ALT、AST活性和TBIL水平显著降低(<0.05、0.01);血清和肝组织中Hyp水平显著降低(<0.05、0.01);肝组织中MDA水平显著降低(<0.01),SOD活性显著升高(<0.05、0.01);血清中LN、HA、PIIINP、Col-IV、TNF-α、IL-1β和IL-6水平均显著降低(<0.05、0.01);光镜下可见肝组织细胞水肿、空泡样改变、炎细胞浸润明显减轻;肝组织中mRNA表达水平显著升高(<0.01),mRNA表达水平显著降低(<0.01);肝组织中p-JAK1和p-STAT3蛋白表达水平显著降低(<0.001)。高车前素可减轻HF小鼠的肝损伤和炎症程度,其抗HF的作用机制可能与激活uPA纤溶酶系统和干预JAK1/ STAT3信号转导通路有关。
高车前素;肝纤维化;Janus激酶1/转录激活因子3信号通路;尿激酶型纤溶酶原激活物;纤溶酶原激活物抑制因子-1
肝纤维化(hepatic fibrosis,HF)是多种病因导致肝细胞发生变性、炎症及坏死等,进而刺激肝细胞外基质(extra cellular matrix,ECM)合成与降解失调,造成肝脏内的纤维结缔组织异常增生、沉积而引起的一系列病理、生理过程[1]。其本质是由于肝星状细胞(hepatic stellate cells,HSC)活化及ECM合成与降解不平衡,导致ECM过度沉积;主要表现为广泛的肝细胞坏死、ECM过度沉积引起的正常肝组织破坏、假小叶和再生结节形成,最终导致门脉高压相关性疾病、低蛋白血症等多种严重并发症的产生[2]。尽管现代医学对HF的发病机制研究颇深,但目前大多数抗HF药物的临床效果不显著,且具有药物毒性,其实际应用受到限制。因此,开发有效的药物逆转HF进程,是治疗慢性肝病,预防肝硬化、肝癌的关键。
龙血竭是百合科植物龙血树属植物剑叶龙血树(Lour.) S. C. Chen的含脂木材经乙醇提取而得到的树脂,被誉为“活血圣药”,有散瘀生新、活血止痛、止血生肌等功效,在治疗冠心病、脑梗死、心肌缺血以及抗炎、创伤愈合等方面具有显著的疗效[3]。研究表明,龙血竭具有抗血栓、抗血小板聚集、抗纤维化等作用[4]。本课题组前期通过生物信息学方法,筛选出龙血竭中抗纤溶酶原激活物抑制因子-1(plasminogen activator inhibitor-1,PAI-1)的活性成分高车前素,其生物活性强于龙血素B[5]。高车前素是一种黄酮类化合物,现代药理学研究表明其具有抗炎、抗氧化、抗增殖、抗真菌、抗癫痫、抗诱变、抗肿瘤、保肝、抑制血管生成等多种药理活性[6]。高车前素可能通过Janus激酶1(Janus kinase 1,JAK1)和转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路,抑制磷酸化STAT3(phosphorylated STAT3,p-STAT3)和Twistl蛋白表达,从而抑制抗凋亡的B淋巴细胞瘤-2(B-cell lymphoma-2,Bc1-2)蛋白表达,抑制肝癌细胞增殖[7]。JAK1/STAT3信号转导通路是细胞因子信号转导通路之一,参与细胞的增殖、分化、凋亡以及免疫调节等多种重要的生物学过程。研究发现,JAK1/STAT3信号通路与HF有着极其密切的联系,但其具体的作用机制尚不明确[8-10]。因此,本研究采用四氯化碳(carbon tetrachloride,CCl4)诱导建立HF小鼠模型,初步考察高车前素对小鼠肝功能指标、纤维化相关指标和肝脏病理学改变等的影响,探讨高车前素对HF小鼠JAK1/STAT3信号通路的影响,为其临床应用提供思路。
1 材料
1.1 动物
SPF级雄性昆明种小鼠80只,6~8周龄,体质量18~22 g,由重庆医科大学实验动物中心提供,生产许可证号SCXK(渝)2018-0003。动物饲养于重庆医科大学实验动物中心IVC第二动物房,每笼饲养不多于5只,自由进食饮水,室温22.0~23.1 ℃,相对湿度52%~60%。动物实验经重庆医科大学医学研究伦理委员会批准(批准号2022072)。
1.2 药品与试剂
高车前素(批号DSTDG002601,质量分数为99.23%)购自成都德斯特生物技术有限公司;秋水仙碱片(0.5 mg/片,批号20200802)购自滇红药业集团玉溪生物制药有限公司;血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(批号AUZ2122)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒(批号AUZ2119)、总胆红素(total bilirubin,TBIL)试剂盒(批号AUZ2130)均购自贝克曼库尔特商贸有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号20210906)、丙二醛(malondialdehyde,MDA)试剂盒(批号20210927)、还原型谷胱甘肽(glutathione,GSH)试剂盒(批号20211009)、羟脯氨酸(hydroxyproline,Hyp)试剂盒(批号20211124)、透明质酸(hyaluronic acid,HA)试剂盒(批号20210918)、层黏连蛋白(laminin,LN)试剂盒(批号2021091)、III型前胶原(type III procollagen,PIIINP)试剂盒(批号20210909)、IV型胶原(type IV collagen,Col-IV)试剂盒(批号20211101)均购自南京建成生物工程研究所;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号E20210301A)、白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒(批号E20210312A)、IL-6 ELISA试剂盒(批号E20210407A),购自上海继锦化学科技有限公司;、尿激酶型纤溶酶原激活物(urokinase type plasminogen activator,)引物均由上海捷瑞生物工程有限公司合成;RNA simple Total RNA试剂盒(批号W0103)购自天根生化科技有限公司;RT Master Mix for qPCR(批号99152)、SYBR Green qPCR Master Mix(批号115209)购自MCE公司;全蛋白提取试剂盒(批号20211210)购自北京索莱宝科技有限公司;BCA蛋白定量试剂盒增强型(批号P0010)、SDS-PAGE凝胶配制试剂盒(批号P0012)、一抗稀释液(批号P0023)均购自碧云天生物技术有限公司;β-actin抗体(批号ab169795)、JAK1抗体(批号ab126315)、p-JAK1抗体(批号ab126413)、STAT3抗体(批号ab163709)、p-STAT3抗体(批号ab163518)均购自英国Abcam公司;HRP标记的羊抗兔IgG抗体(批号BST17C18B17D54)、HRP标记的羊抗鼠IgG抗体(批号BST17C08A17C50)购自博士德生物工程有限公司;发光液(批号2104602)购自美国Millipore公司;Western blotting Marker(批号01081673)购自PageRuler公司;CCl4(分析纯)、无水乙醇(分析纯)、二甲苯、中性树胶等均购自国药集团化学试剂有限公司。
1.3 仪器
CLW-1020型纯水机(重庆乾崃仪器有限公司);Allegra X-12型离心机(美国贝克曼库尔特有限公司);Mias-2000型病理图象处理系统(四川大学图象处理国家研究所);AU480型全自动生化分析仪(美国贝克曼库尔特有限公司);756PC型紫外可见分光光度计(上海舜宇恒平科学仪器有限公司);ST360型酶标仪(上海科华实验系统有限公司);Mastercycler®nexus型实时荧光定量PCR仪(德国Eppendorf公司);DYY-6C型电泳仪(北京市六一仪器厂公司);ChemiDoc XRS+型全自动化学发光凝胶成像分析系统(美国Bio-Rad公司)。
2 方法
2.1 造模、分组及给药
参照文献方法[11-14],取65只雄性昆明种小鼠,背部sc现用现配的40% CCl4橄榄油溶液(10 mL/kg),2次/周,连续6周,制备HF小鼠模型,另取15只小鼠作为对照组。分别取5只模型小鼠和5只对照小鼠,检测血清中肝损伤指标(AST、ALT)活性,并进行肝脏病理学观察,确定模型复制成功。造模过程中动物死亡20只,将剩余40只HF小鼠随机分为模型组、秋水仙碱(2 mg/kg)组和高车前素高、低剂量(30、10 mg/kg)组,每组10只。各给药组ip相应药物(10 mL/kg),对照组和模型组ip等体积生理盐水,1次/d,连续4周。末次给药后,小鼠禁食不禁水24 h,称定体质量,摘眼球取血,取肝脏组织,用PBS缓冲液冲洗3次,称定肝湿质量,计算肝脏指数[15-16]。
肝脏指数=肝湿质量/体质量
2.2 各组小鼠血清中肝功能相关指标测定
各组小鼠摘眼球取血后,离心分离血清,采用全自动生化分析仪测定血清中ALT、AST活性及TBIL水平。
2.3 各组小鼠血清中HF相关指标测定
取各组小鼠血清,按ELISA试剂盒说明书测定血清中HA、LN、PIIINP和Col-IV水平。
2.4 各组小鼠肝组织中SOD活性及MDA、GSH水平测定
取各组小鼠肝脏,用预冷的生理盐水洗去浮血,用生理盐水研磨成10%的肝组织匀浆,4 ℃、3500 r/min离心15 min,取上清,按试剂盒说明书测定SOD活性及MDA、GSH水平。
2.5 各组小鼠血清和肝组织中Hyp水平测定
按试剂盒说明书测定各组小鼠血清和肝组织中Hyp水平。
2.6 各组小鼠肝组织中炎症因子水平测定
按ELISA试剂盒说明书测定各组小鼠肝组织中TNF-α、IL-1β和IL-6水平。
2.7 各组小鼠肝组织病理观察
取各组小鼠肝大叶相同部位的小块肝组织,于10%甲醛溶液中固定24 h,梯度乙醇脱水,石蜡常规包埋后切片(4~5 μm厚),进行苏木素-伊红(HE)染色,自然晾干后中性树胶封片,于光学显微镜下观察肝组织病理改变。
2.8 各组小鼠肝组织中uPA和PAI-1 mRNA表达
取各组小鼠肝组织,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析[17-18]。引物序列为上游引物5’-AAAACAGTAATCCC- TACGAA-3’,下游引物5’-TTTAATGAGGAGTACT- GGAC-3’;上游引物5’-TGTCCCTTCTACA- GGG-3’,下游引物5’-GGGTTACAGCACTTGGA- CG-3’;上游引物5’-TTGTGAGACCCAATC- CG-3’,下游引物5’-AGATTTCTGAGCCGCAAG-3’。
2.9 各组小鼠肝组织中JAK1/STAT3信号通路相关蛋白表达
取各组小鼠肝组织,加入含蛋白酶抑制剂的RIPA细胞裂解液,于冰上充分裂解,12 000 r/min离心10 min,收集上清液,采用BCA蛋白定量试剂盒测定蛋白浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,TBST洗涤5 min,加入含5%脱脂奶粉的封闭液,室温封闭1 h;分别加入p-JAK1、JAK1、p-STAT3、STAT3和β-actin抗体(1∶1000),4 ℃孵育过夜;TBST洗涤10 min,洗涤3次,加入二抗(1∶10 000),室温封闭2 h;TBST洗涤10 min,洗涤3次,加入ECL发光试剂显影,采用Image J软件分析条带灰度值[8-10]。
2.10 统计学方法
3 结果
3.1 高车前素对HF小鼠体质量和肝脏指数的影响
如表1所示,与对照组比较,模型组小鼠体质量明显下降(<0.01),肝脏指数显著升高(<0.01);与模型组比较,各给药组小鼠体质量均显著升高(<0.05、0.01),肝脏指数明显降低(<0.05、0.01)。
3.2 高车前素对HF小鼠血清中肝功能指标的影响
如表2所示,与对照组比较,模型组小鼠血清中ALT、AST活性和TBIL水平均显著升高(<0.01);与模型组比较,各给药组小鼠血清中ALT、AST活性和TBIL水平均显著降低(<0.05、0.01),提示高车前素对HF小鼠肝损伤有一定保护作用。
表1 高车前素对HF小鼠体质量和肝脏指数的影响(, n = 10)
Table 1 Effect of hispidulin on body weight and liver index in HF mice (, n = 10)
组别剂量/(mg·kg−1)体质量/g肝脏指数/% 对照—38.8±5.94.81±0.92 模型—27.5±6.4##6.44±0.94## 秋水仙碱234.7±5.2**5.11±0.88** 高车前素3035.6±4.8**5.25±0.79** 1034.3±6.2*5.60±0.84*
与对照组比较:##<0.01;与模型组比较:*<0.05**<0.01,下表同
##< 0.01control group;*< 0.05**< 0.01model group, same as below tables
表2 高车前素对HF小鼠血清中肝功能指标的影响(, n = 10)
Table 2 Effect of hispidulin on liver function indicators in serum of HF mice (, n = 10)
组别剂量/(mg·kg−1)ALT/(U·L−1)AST/(U·L−1)TBIL/(µmol·L−1) 对照—60.52±15.18123.65±31.10302.7±82.8 模型—278.64±50.36##347.43±67.34##532.9±91.1## 秋水仙碱2207.30±42.44**273.21±56.29**387.0±80.8** 高车前素30209.67±56.37**265.67±45.79**396.9±82.3** 10225.54±58.32*287.08±52.23**430.8±90.3**
3.3 高车前素对HF小鼠血清中HF相关指标的影响
如表3所示,与对照组比较,模型组小鼠血清中LN、HA、PIIINP和Col-IV水平均显著升高(<0.01);与模型组比较,各给药组小鼠血清中LN、HA、PIIINP和Col-IV水平均显著降低(<0.05、0.01)。
3.4 高车前素对HF小鼠肝组织中抗氧化相关指标的影响
如表4所示,与对照组比较,模型组小鼠肝组织中MDA水平明显升高(<0.01),SOD活性和GSH水平明显降低(<0.01);与模型组比较,各给药组小鼠肝组织中MDA水平明显降低(<0.01),SOD活性明显升高(<0.05、0.01),GSH水平呈升高趋势。
3.5 高车前素对HF小鼠血清和肝组织中Hyp水平的影响
如表5所示,与对照组比较,模型组小鼠血清和肝组织中Hyp水平均显著升高(<0.01);与模型组比较,各给药组小鼠血清和肝组织中Hyp水平均显著降低(<0.05、0.01)。
3.6 高车前素对HF小鼠血清中炎症因子水平的影响
如表6所示,与对照组比较,模型组小鼠血清中TNF-α、IL-1β和IL-6水平均显著升高(<0.01);与模型组比较,各给药组TNF-α、IL-1β和IL-6水平均显著降低(<0.05、0.01),提示高车前素可通过抑制促炎细胞因子的表达,从而发挥抗HF的作用。
表3 高车前素对HF小鼠血清中HF相关指标的影响(, n = 10)
Table 3 Effect of hispidulin on HF related indicators in serum of HF mice (, n = 10)
组别剂量/(mg·kg−1)LN/(ng·mL−1)HA/(ng·mL−1)PIIINP/(ng·mL−1)Col-IV/(ng·mL−1) 对照—98.34±24.0847.32±12.5717.35±7.5626.09±8.35 模型—319.67±70.24##135.39±36.86##53.83±12.75##72.04±20.64## 秋水仙碱2221.98±65.31**77.91±29.17**38.32±10.16**45.16±19.36** 高车前素30210.14±69.55**83.41±36.65**36.51±13.60**49.58±18.47* 10237.36±60.16**80.27±30.10**40.63±14.29*52.28±16.86*
表4 高车前素对HF小鼠肝组织中抗氧化相关指标的影响(, n = 10)
Table 4 Effect of hispidulin on antioxidant related indicators in liver tissue of HF mice (, n = 10)
组别剂量/(mg·kg−1)MDA/(nmol·mg−1)SOD/(U·mL−1)GSH/(U·mL−1) 对照—4.38±0.36103.31±35.3480.21±10.37 模型—6.23±0.57##68.76±21.09##59.34±21.69## 秋水仙碱25.10±0.49**97.34±24.57**72.39±23.58 高车前素305.24±0.54**90.45±27.31*74.61±30.12 105.40±0.63**96.37±26.60**69.43±22.86
表5 高车前素对HF小鼠血清和肝组织中Hyp水平的影响(, n = 10)
Table 5 Effect of hispidulin on Hyp levels in serum and liver tissue of HF mice (, n = 10)
组别剂量/(mg·kg−1)血清Hyp/(µg·mL−1)肝组织Hyp/(µg·mg−1) 对照—61.37±3.48135.59±44.17 模型—72.64±5.41##237.32±53.64## 秋水仙碱266.59±3.26**171.65±50.35** 高车前素3065.23±2.34**174.54±46.31** 1066.27±4.03*182.63±57.83*
3.7 高车前素对HF小鼠肝组织中uPA和PAI-1 mRNA表达的影响
如表7所示,与对照组比较,模型组小鼠肝组织中mRNA表达水平显著降低(<0.01),mRNA表达水平显著升高(<0.01);与模型组比较,高车前素高、低剂量组小鼠肝组织中mRNA表达水平显著升高(<0.01),mRNA表达水平显著降低(<0.01),秋水仙碱组小鼠肝组织中和mRNA表达均无显著差异。
表6 高车前素对HF小鼠血清中炎症因子水平的影响(, n = 10)
Table 6 Effect of hispidulin on inflammatory factors levels in serum of HF mice (, n = 10)
组别剂量/(mg·kg−1)TNF-α/(pg·mL−1)IL-1β/(pg·mL−1)IL-6/(pg·mL−1) 对照—181.32±35.78307.92±81.06137.53±25.65 模型—318.87±76.70##575.65±90.32##271.32±53.16## 秋水仙碱2248.54±63.09**402.56±101.36**183.17±40.58** 高车前素30236.42±59.50**431.87±84.54**188.80±51.65** 10249.51±70.72*470.34±93.09**201.30±46.24**
表7 高车前素对HF小鼠肝组织中uPA和PAI-1 mRNA表达的影响(, n = 10)
Table 7 Effect of hispidulin on uPA and PAI-1 mRNA expressions in liver tissue of HF mice (, n = 10)
组别剂量/(mg·kg−1)mRNA相对表达量 uPAPAI-1 对照—1.000±0.0511.000±0.093 模型—0.437±0.042##1.528±0.103## 秋水仙碱20.525±0.0631.427±0.219 高车前素300.863±0.048**1.248±0.157** 100.717±0.053**1.280±0.204**
3.8 高车前素对HF小鼠肝组织病理变化的影响
如图1所示,对照组小鼠肝细胞排列整齐,肝索呈放射状,肝小叶和汇管区形态结构完整、轮廓清晰,无炎细胞浸润及纤维组织增生;模型组小鼠肝小叶和肝细胞结构紊乱、不规则,出现明显水肿,肝细胞体积变大,呈空泡样变性,可见肝细胞坏死、炎细胞浸润和明显纤维间隔形成;与模型组比较,各给药组肝细胞排列趋于正常,细胞水肿、空泡样改变、炎细胞浸润明显减轻,提示高车前素对CCl4致HF小鼠肝组织损伤具有明显的保护作用。
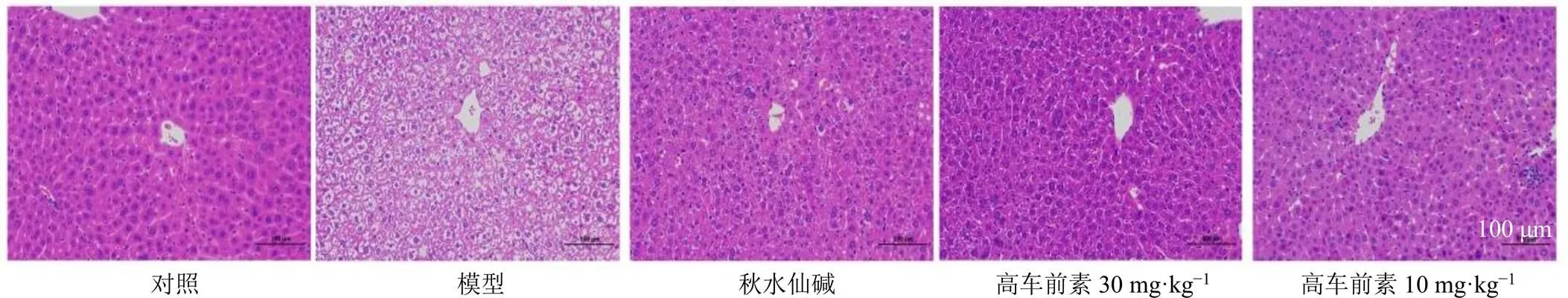
图1 高车前素对HF小鼠肝组织病理变化的影响 (HE, ×200)
3.9 高车前素对HF小鼠肝组织中JAK1/STAT3信号通路相关蛋白表达的影响
如图2所示,与对照组比较,模型组小鼠肝组织中p-JAK1和p-STAT3蛋白表达水平均显著升高(<0.001);与模型组比较,高车前素低剂量组小鼠肝组织中p-JAK1和p-STAT3蛋白表达水平均显著降低(<0.001),提示高车前素抗HF的作用机制可能与下调JAK1/STAT3信号通路有关。
4 讨论
近年来,HF的发病率越来越高,已成为目前备受关注的社会健康问题,亟待利用我国中医药资源的优势,加强中药抗HF机制研究。CCl4可通过直接破坏肝细胞膜,造成肝细胞损伤坏死,长期给药可导致HF、肝硬化和肝癌,其病理组织学变化与人类HF相似,现已被广泛用于抗HF药物的研究。
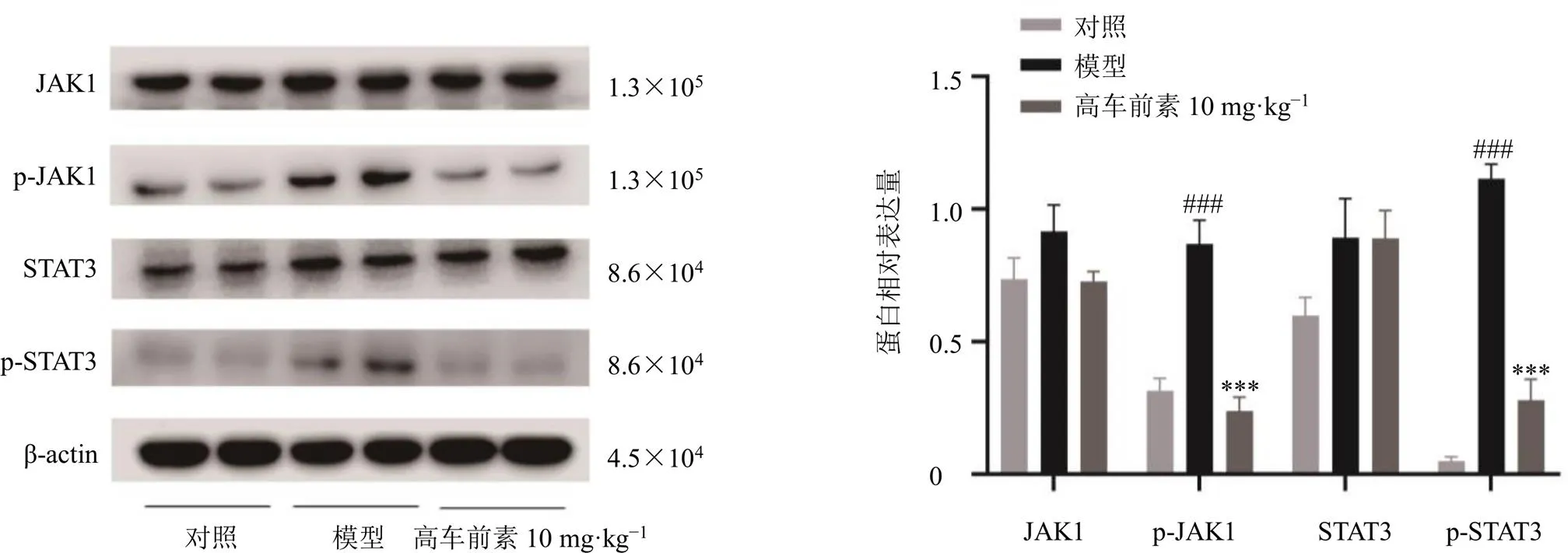
与对照组比较:###P<0.001;与模型组比较:***P<0.001
本研究采用sc CCl4建立HF小鼠模型,结果显示,模型组小鼠肝脏指数、血清ALT、AST活性及TBIL水平以及血清和肝组织中Hyp水平均显著升高,肝组织MDA水平显著升高,肝组织SOD活性和GSH水平明显降低,同时血清中促炎细胞因子TNF-α、IL-1β和IL-6水平显著升高,这些细胞因子的不断刺激又可进一步加重肝损伤,形成恶性循环,导致HF的发生发展。高车前素能够显著降低血清中ALT、AST活性和TBIL水平,下调血清和肝组织中Hyp水平,降低血清中MDA水平并升高SOD活性,且对GSH水平有上调趋势;此外,高车前素能够降低肝脏指数和血清中促炎因子TNF-α、IL-1β、IL-6水平,使肝细胞排列趋于正常,细胞水肿、空泡样改变、炎细胞浸润明显减轻。提示高车前素可有效减轻CCl4诱导HF模型小鼠的肝损伤和炎症程度,具有明显的保肝作用。
PAI-1作为一种单链糖蛋白,由379个氨基酸残基组成,属于丝氨酸蛋白酶家族,通过与纤溶酶原激活物丝氨酸活性中心结合,使其活化作用丧失。PAI-1是专一抑制纤溶酶原激活的抑制剂,在生理条件下,PAI-1通过形成复合物来抑制uPA和组织型纤溶酶原激活物(tissue plasminogen activator,tPA),从而阻止纤溶酶的形成。PAI-1在肝脏中主要由巨噬细胞、肝窦细胞和HSC表达。在正常肝脏中PAI-1含量很低,肝部分切除后再生细胞中的PAI-1含量升高。研究发现,PAI-1与HF的发生关系密切,随着纤维化的加重,PAI-1含量增加,抑制PAI-1表达可以有效抑制HSC活性。PAI-1可阻止uPA激活纤溶酶原,降低基质金属蛋白酶(matrix metalloproteinase,MMP)活性,导致ECM在肝细胞内过多沉积,PAI-1还可以诱导细胞分化为活化的成纤维细胞[19]。在PAI-1过表达小鼠中纤维蛋白沉积和器官纤维化增加[20],而PAI-1缺陷小鼠中HF减弱[21]。CCl4诱导的HF小鼠模型中,PAI-1在HF进程中持续上调,可能参与Col-I、Col-III的表达调控,在HF的发生中起重要作用,从而证实了PAI-1可促进HF时基质蛋白的合成[22]。临床实践表明,HA、LN、PIIINP和Col-IV 4项指标是临床判断HF的重要血清学指标,其水平与肝组织炎症活动及纤维化均呈正相关[23]。本研究发现,模型组小鼠血清中HA、LN、PIIINP和Col-IV水平显著升高,同时小鼠肝组织中mRNA表达水平显著降低,而mRNA表达水平显著升高,说明CCl4引起了小鼠肝组织的损伤及纤维化;给予高车前素干预后,小鼠血清中HA、LN、PIIINP和Col-IV水平均显著下降,肝组织中mRNA表达水平显著上调,mRNA表达水平显著下调,表明高车前素具有抗HF作用,其作用机制可能与激活uPA纤溶酶系统有关。
JAK/STAT信号通路是一条由细胞转导刺激的信号通路,参与细胞的生长、分化以及免疫调控等生物学过程,主要由酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT组成。血小板衍生生长因子(platelet-derived growth factor,PDGF)、IL-4、IL-6、瘦素、生长激素和γ干扰素等细胞因子均能激活这一通路,其中最主要刺激因子为PDGF,当PDGF与受体结合后,会磷酸化JAK1,继而磷酸化STAT3,之后与受体分离进入核内,激活靶基因转录和表达,直接促进HSCs生长和分裂,提示JAK1/STAT3信号通路在HF的形成过程中发挥了重要的调控作用,抑制JAK1/STAT3信号通路的转导和激活可延缓HF的进展。本研究结果显示,高车前素低剂量组小鼠肝组织中p-JAK1和p-STAT3蛋白表达水平均显著降低,表明高车前素抗HF的作用机制可能调节JAK1/STAT3信号通路相关因子有关。
综上所述,高车前素可有效减轻CCl4诱导HF小鼠的肝损伤和炎症程度,其抗HF的作用机制可能与激活uPA纤溶酶系统和干预JAK1/STAT3信号通路有关。
利益冲突 所有作者均声明不存在利益冲突
[1] Krenkel O, Puengel T, Govaere O,. Therapeutic inhibition of inflammatory monocyte recruitment reduces steatohepatitis and liver fibrosis [J]., 2018, 67(4): 1270-1283.
[2] 周翔, 顾达, 童聪, 等. 鳖甲煎丸对CCl4诱导小鼠肝纤维化的治疗作用机制研究 [J]. 陕西中医, 2022, 43(2): 151-156.
[3] 胡迎庆, 宫飙, 屠鹏飞. 龙血树属植物化学成分及生物活性研究进展 [J]. 现代药物与临床, 2000, 15(1): 5-8.
[4] Xin N, Li Y J, Li Y,. Dragon's blood extract has antithrombotic properties, affecting platelet aggregation functions and anticoagulation activities [J]., 2011, 135(2): 510-514.
[5] Xu C, Liu X, Shen J,. Integrative identification of human serpin PAI-1 inhibitors fromdragon blood and molecular implications for inhibitor-induced PAI-1 allosterism [J]., 2022, 69(1): 221-229.
[6] 陈春林, 王健, 戈悦欣, 等. 高车前素药理作用研究进展 [J]. 宜春学院学报, 2019, 41(12): 17-20.
[7] 张涛. 高车前素对肝癌细胞增殖的抑制作用及作用机制研究 [J]. 中国药物与临床, 2014, 14(10): 1349-1351.
[8] 李晨, 李晓媚, 刘亭, 等. 高盐饮食激活肠JAK1/STAT3通路诱导肠上皮屏障功能障碍 [J]. 实用医学杂志, 2021, 37(1): 35-40.
[9] Li H G, You P T, Xia Y,. Yu Gan Long ameliorates hepatic fibrosis by inhibiting PI3K/AKT, Ras/ERK and JAK1/STAT3 signaling pathways in CCl4-induced liver fibrosis rats [J]., 2020, 40(3): 539-547.
[10] 吴斌, 王蓉, 李胜男, 等. 秦皮素通过调节JAK1/STAT3信号通路抑制肝纤维化 [J]. 中南药学, 2019, 17(3): 420-425.
[11] 王娟, 杨晶晶, 周仁鹏, 等. 肝纤维化小鼠模型研究现状 [J]. 中国比较医学杂志, 2022, 32(2): 105-110.
[12] 孙家昌, 孙妩弋, 厉歆然, 等. 不同浓度四氯化碳诱导小鼠肝纤维化模型的比较 [J]. 实验动物与比较医学, 2018, 38(4): 255-260.
[13] 王肖辉, 周霖, 杜秋争, 等. 五味子甲素对四氯化碳诱导小鼠肝纤维化的保护作用及其机制研究 [J]. 中国药房, 2020, 31(22): 2725-2730.
[14] 鲁智文, 潘晓莉, 宋宇虎. 3种小鼠肝纤维化模型的建立及评价 [J]. 胃肠病学和肝病学杂志, 2018, 27(4): 390-392.
[15] 李茜, 吴惠春, 谭家鑫, 等. 柔肝方通过抑制纤维化蛋白抗肝纤维化的机制研究 [J]. 中国免疫学杂志, 2022, 38(3): 263-269.
[16] 张春雷, 吴新玉, 王栋, 等. 大王马先蒿对四氯化碳诱导肝纤维化小鼠的保护作用 [J]. 医药导报, 2022, 41(4): 423-429.
[17] 焦黎. 纤溶酶原激活物抑制因子-1对肝星状细胞活化及其细胞外基质的影响 [D]. 太原: 山西医科大学, 2011.
[18] 王桐生, 李莉, 吴德玲, 等. 桃红四物汤对肝纤维化模型大鼠肝脏组织/mRNA表达的影响 [J]. 中药药理与临床, 2016, 32(2): 5-9.
[19] Adnot S, Breau M, Houssaini A. PAI-1: A new target for controlling lung-cell senescence and fibrosis? [J]., 2020, 62(3): 271-272.
[20] Coudriet G M, Stoops J, Orr A V,. A noncanonical role for plasminogen activator inhibitor type 1 in obesity-induced diabetes [J]., 2019, 189(7): 1413-1422.
[21] Pant A, Kopec A K, Baker K S,. Plasminogen activator inhibitor-1 reduces tissue-type plasminogen activator-dependent fibrinolysis and intrahepatic hemorrhage in experimental acetaminophen overdose [J]., 2018, 188(5): 1204-1212.
[22] 朱颖炜, 曾欣, 谢渭芬, 等. 纤溶酶原激活物抑制剂-1在大鼠肝纤维化组织中的表达及其与I、III型胶原的相关性分析 [J]. 肝脏, 2006, 11(1): 18-20.
[23] 郭羽轩, 董惠娟, 刘涛, 等. 睡莲花总黄酮对四氯化碳诱导大鼠肝纤维化的防治作用 [J]. 中草药, 2020, 51(19): 4983-4990.
Effect of hispidulin on hepatic fibrosis mice based on JAK1/STAT3 signaling pathway
XU Chong1, QIN Xiao-dong1, REN Li2, LUO Xian-qin2
1. Department of Pharmacy, Chongqing Hospital of Traditional Chinese Medicine, Chongqing 400021, China 2. College of Traditional Chinese Medicine, Chongqing Medical University, Chongqing 400016, China
To study the effect of hispidulin on carbon tetrachloride (CCl4)-induced hepatic fibrosis (HF) mice based on Janus kinase 1 (JAK1) and signal transducer and activator of transcription 3 (STAT3) signaling pathway.HF model was prepared by sc CCl4solution on the back of mice for six consecutive weeks, HF mice were randomly divided into model group, colchicine (2 mg/kg) group and hispidulin high-and low-dose (30, 10 mg/kg) groups, each administration group was ip corresponding drug for four consecutive weeks, serum was prepared at 24 h after the last administration, and liver index was calculated; Fully automated biochemical analyzer was used to measure alanine aminotransferase (ALT), aspartate aminotransferase (AST) activities and total bilirubin (TBIL) level in serum; Levels of hydroxyproline (Hyp) in serum and liver tissues were detected; Malondialdehyde (MDA), glutathione (GSH) levels and superoxide dismutase (SOD) activity in liver tissues were detected; Hyaluronic acid (HA), laminin (LN), type III procollagen (PIIINP), type IV collagen (Col-IV), tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) and IL-6 levels in serum were detected; Hematoxylin-eosin (HE) staining was used to observe pathological changes in liver tissues; qRT-PCR was used to detect urokinase type plasminogen activator () and plasminogen activator inhibitor-1 () mRNA expressions in liver tissues; Western blotting was used to detect the expressions of related proteins in JAK1/STAT3 signaling pathway in liver tissues.Compared with model group, body weight of mice in hispidulin group was significantly increased (< 0.05, 0.01), liver index was significantly decreased (< 0.05, 0.01), ALT, AST activities and TBIL level in serum were significantly decreased (< 0.05, 0.01), Hyp levels in serum and liver tissue were significantly decreased (< 0.05, 0.01), MDA level in liver tissue was significantly decreased (< 0.01), while SOD activity was significantly increased (< 0.05, 0.01), levels of LN, HA, PIIINP, Col-IV, TNF-α, IL-1β and IL-6 in serum were significantly decreased (< 0.05, 0.01); Hepatic tissue edema, vacuolar-like changes, and inflammatory cell infiltration were observed under light microscope;mRNA expression in liver tissue was significantly increased (< 0.01), andmRNA expression was significantly decreased (< 0.01); p-JAK1 and p-STAT3 protein expression levels in liver tissue were significantly decreased (< 0.001).Hispidulin can reduce liver injury and inflammation in HF mice, and its anti-HF mechanism may be related to the activation of uPA plasmin system and intervention of JAK1/STAT3 signal transduction pathway.
hispidulin; hepatic fibrosis; Janus kinase 1/signal transducer and activator of transcription 3 signaling pathway; urokinase type plasminogen activator; plasminogen activator inhibitor-1
R285.5
A
0253 - 2670(2022)19 - 6093 - 08
10.7501/j.issn.0253-2670.2022.19.015
2022-06-16
重庆市自然科学基金面上项目(cstc2019jcyj-msxmX0044)
徐 冲,副主任中药师,从事中药有效成分和药理活性研究。Tel: (023)67063730 E-mail: chongxu@cdutcm.edu.cn
罗先钦,研究员,从事中药药理与毒理评价研究。Tel: (023)65712062 E-mail: lxq_0203@163.com
[责任编辑 李亚楠]

