一种抗菌自修复壳聚糖薄膜材料的制备和表征
宣红云,钱嘉锡,李碧云,孙苗,袁卉华
1.南通大学 生命科学学院(南通, 226019)
2.南通理工学院 机械工程学院(南通, 226002)
0 引言
聚合物薄膜材料已广泛用于生物医学领域[1]。其特点在于低成本,易加工,便于大批次生产[2]。对于医疗设备和生物医学等领域,特别是疫情大时代背景下,医用防护材料需具备自修复和抗菌性能,能够减少感染风险和延长使用寿命[3-4]。
自修复材料大致可以分为二种,一种是本征型自修复材料,另一种是非本征型自修复材料[5]。其中本征型自修复材料依靠自身聚合物内部的共价键或是非共价键,通过可逆的动态的特征实现自修复功能[6],只需要加热。加湿等方法就可以促进自修复[7],从而使材料具备一定的稳定性与可靠性[8]。相比与非本征型修复材料,本征型修复材料可以实现多次自主修复,且不需要额外的催化剂[9]。在本征型自修复的基础上,拓展出以主客体为主的自修复形式[10],主体分子通常较大,并具有疏水或亲水腔,可以嵌入较小的客体[11]。目前已有很多有关主客体分子的研究。以环糊精和金刚烷为例,环糊精具备的独特空腔,能够包裹住客体分子,形成络合物[12-13]。但环糊精和金刚烷均不具备抗菌性能,无法应用于医用防护方面,但可以通过抗菌剂的接枝或共混改性使其具备抗菌性能[14]。
壳聚糖( Chitosan,CS)是一种具备良好生物相容性的天然碱性多糖,同时也具有抗菌性,无毒性等特点[15-16]。壳聚糖对于细菌、真菌有一定毒性[17],但是对哺乳动物细胞毒性较低[18]。壳聚糖分子内部有数量较多的氢键,可以形成结晶区,从而具备良好的吸附能力[19]。因此,如果利用壳聚糖对环糊精和金刚烷分别进行修饰,将改善环糊精-金刚烷自修复材料的抗菌功能[20-21]。目前,利用壳聚糖的修饰环糊精和壳聚糖修饰的金刚烷经层层自组装技术形成自修复的抗菌涂层薄膜的研究还未见报道。
拟采用壳聚糖、羧甲基壳聚糖分别修饰环糊精和金刚烷,进一步在玻璃片上经过层层自组装技术制备聚合物薄膜。探讨了该新型聚合物薄膜的自修复能力和抗菌能力。为壳聚糖基的主客体自修复涂层材料在生物医学防护领域的应用提供了理论依据。
1 材料制备方法
1.1 材料和仪器
材料:冰醋酸,上海阿拉丁生化科技股份有限公司;壳聚糖(CS)和羧甲基壳聚糖(CS-COOH),来自合肥博美生物科技有限责任公司;β-环糊精(β-cyclodextrin,β-CD),山东滨州智源生物科技有限公司;金刚烷胺(Amantadine,AD),上海笛柏有限公司;1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(1-ethyl-(3-dimethylaminopropyl)carbodiimide hydrochloride, EDC)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)均为上海碧云天生物技术有限公司;LB培养基,上海源叶生物科技有限公司。
仪器:红外光谱仪(TENSOR 27 ),德国布鲁克公司;恒温培养箱(DH4000BII),苏州菲斯福电子材料有限公司;光学显微镜(DM2500),德国莱卡公司。
1.2 涂层材料的制备
首先需要制备主客体2种溶液,也就是环β-CD/CS溶 液 和 AD/(CS-COOH)溶 液。CS和CS-COOH先分别用3%冰醋酸溶液溶解,然后以10 mg/mL的浓度,向壳聚糖溶液中添加β-CD,避光振荡,使环糊精充分溶解。5 mg/mL浓度的金刚烷胺加入至羧甲基壳聚糖溶液中,同时加入适量的EDC和NHS进行活化,避光振荡12 h,使金刚烷胺充分溶解。在圆形的玻璃片上滴加β-CD-CS溶液,并轻轻涂匀填满整个玻璃片表面,等待溶液自然风干,再滴加AD-(CS-COOH)溶液,轻轻涂匀,等待自然风干。多次反复上述操作(60周期),最终得到具有抗菌性能和自修复能力的β-CD-CS/AD-(CS-COOH)涂层薄膜。
为了检测壳聚糖、羧甲基壳聚糖是否能够被环糊精或是金刚烷胺修饰,需单独制备涂有纯β-CD-CS溶液的涂层与纯AD-(CS-COOH)溶液的涂层,并使用红外光谱仪进行分析。
1.3 自修复实验
自修复实验有3种:①单次划伤修复实验:用小刀轻划涂层,使其暴露出一定宽度的伤口并在光学显微镜下观察记录。再用喷壶喷洒蒸馏水,使涂层进行自修复。在修复过程中,用光学显微镜持续观察划痕处,并记录划痕修复完成的时间。②根据实验确定的划痕修复完成的时间来进行多次划伤修复实验:多次划伤修复实验大体步骤与单次划伤实验相同,不同点在于反复划伤,修复。用显微镜观察在相同修复时间下,薄膜的伤口愈合情况。③截断修复实验:将制备好的涂层薄膜从玻璃载体上轻轻揭下,用剪刀截断成两半,一半用蓝色染料染色进行对比。之后相互靠拢,喷水,使其自修复。
1.4 抗菌实验
目前在抗菌实验中,常用大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)作为评估材料的抗菌性能典型菌种。本次实验分为2组进行,分别针对大肠杆菌、金黄色葡萄球菌,并与空白组进行对比。先制备用于抗菌实验的涂层薄膜。先将圆形玻璃片浸泡在无水乙醇中3 h,随后进行紫外照射2 h。处理好的玻璃片上滴加β-CD-CS溶液,涂匀并自然风干,再滴加AD-(CS-COOH)溶液,涂匀风干。反复重复上述操作(60周期),直至涂层达到实验所需的层数,形成实验所需的涂层薄膜。
以大肠杆菌组为例,先将大肠杆菌培养在液体培养基中,温度保持在37 ℃,振荡孵育24 h。随后在无菌操作台内,分别取20 μL大肠杆菌菌液滴加在紫外照射2 h后有涂层的玻璃片上和没有涂层的玻璃片上(作为对照组)。放入恒温细菌培养箱内培养2 h。吸取涂层上液体,并使用0.85%的生理盐水进行梯度稀释。取适量的混合液,均匀涂布在预先配好的固体培养基(含有2% 琼脂的LB液体培养基)内,再放入恒温细菌培养箱进行培养,保持5% CO2和95% O2大气范围,温度为37 ℃,培养24 h后取出,观察并计算菌落数。金黄色葡萄球菌组操作步骤与大肠杆菌组大致相同,实验平行样品数为3。
2 结果
2.1 红外分析
如图1所示,根据CS, CS-COOH, β-CD-CS与AD-(CS-COOH)的分子结构式,和相应的红外光谱分析发现,3 400 cm-1左右出现的特征峰为上述四种材料的O-H官能团(CS,β-CD-CS, CSCOOH分子中含有 )或N-H(CS, CS-COOH, 分子中含有)官能团的伸缩振动峰,895 cm-1处为CS的β-糖苷键弯曲振动特征吸收峰,895 cm-1处为CS的β-(1,4)糖苷键弯曲振动特征吸收峰。1 690cm-1处的吸收峰是CS-COOH中羧酸基团中羰基的伸缩振动所产生的。形成复合物后羰基(C=O)的特征峰发生了一定的偏移出现在1 650cm-1附近处,且此处的峰出现了较为明显的增强,这则是因为酰胺化反应的发生在聚合物中引入了更多的羰基基团所致[22-23]。
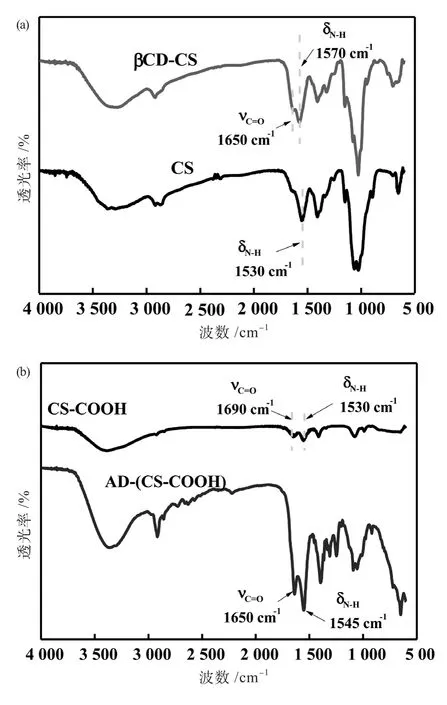
图1 CD-CS与AD-(CS-COOH)的红外光谱图Fig.1 Infrared spectrum of CD-CS and AD - (CS-COOH)
2.2 自修复结果
如图2所示,在单次划伤后,涂层薄膜的伤口随着时间的增加逐渐愈合。结果显示,经过20 min的修复,伤口基本愈合。多次划伤后,涂层薄膜均能自主进行自修复,并且成功修复划痕伤口,如图3所示。在截断之后,2片薄膜也可以通过自修复,成功修复成一个整体,而且用镊子夹起至一定高度,薄膜也不脱落,如图4所示。以上结果均证明该薄膜材料自修复效果良好。

图2 CD-CS与AD-(CS-COOH)显微镜像Fig.2 Microscope image of CD-CS and AD - (CS-COOH)

图3 CD-CS与AD-(CS-COOH)修复前后显微镜像Fig.3 Microscopic image before and after repair of CD-CS与AD-(CS-COOH)

图4 涂层薄膜截断修复实物图Fig4 Physical map of coating film truncation repair
2.3 抗菌试验结果
从图5(a)可以明显看出,大肠杆菌(E.coli)组中,未经过涂层薄膜培养过后的大肠杆菌菌液,其在培养基上的菌落数数量很多,而在涂层薄膜培养2 h后的菌液,其在培养基上的菌落数量显著下降。图5(a)显示的金黄色葡萄球菌(S.aureus)组结果与大肠杆菌组结果相同。且2组菌种的菌落数量下降幅度超过90%,材料抗菌性能接近100%,如图5(b)所示,实验组与空白组之间存在显著的差异。
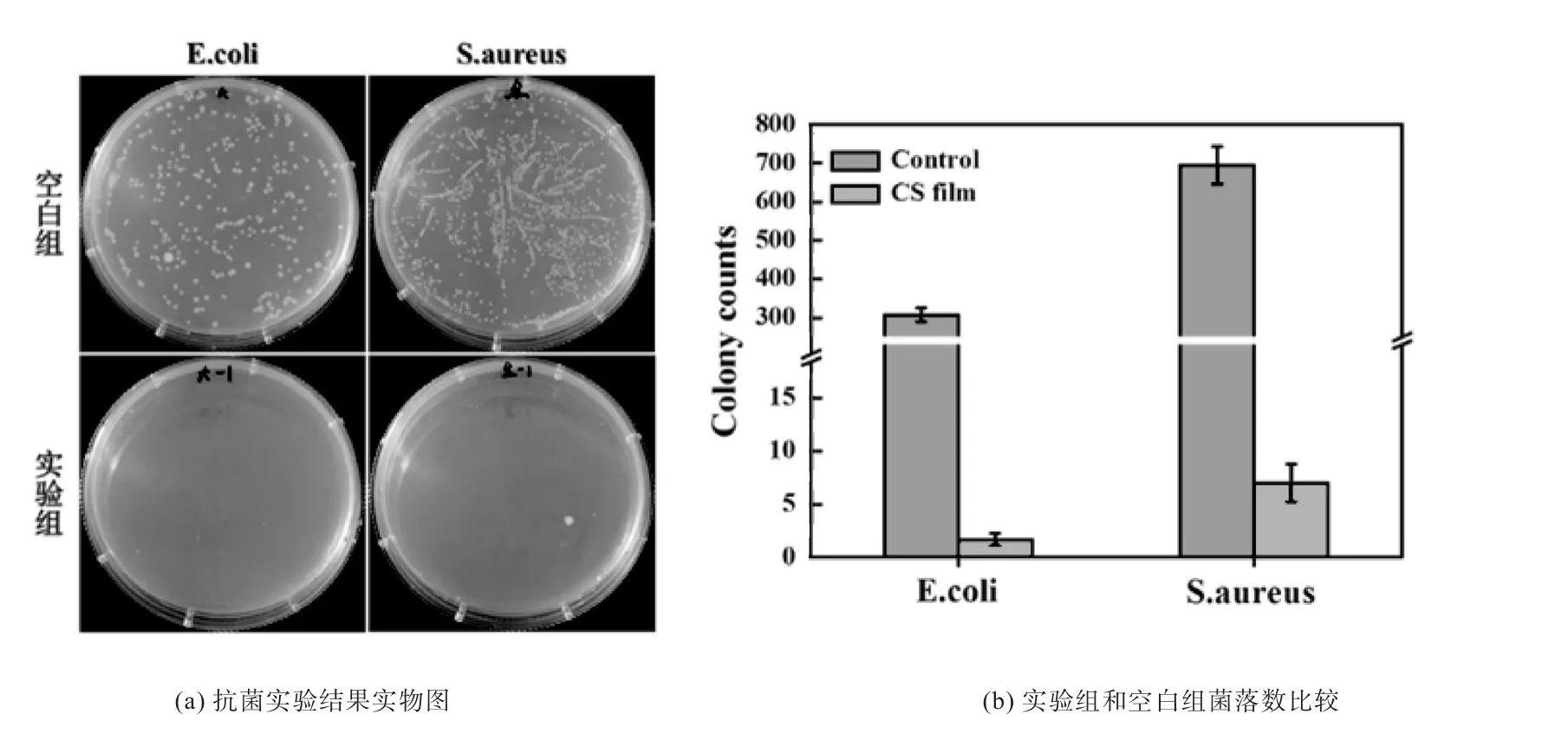
图5 抗菌实验结果Fig 5 Antibacterial test results
3 结语
将玻璃作为涂层的支持物,通过层层自组装技术,将β-CD-CS与AD-(CS-COOH)组装成有一定厚度的涂层,并粘附在玻璃片上。检测了环糊精和金刚烷是否能够与壳聚糖聚合,测试了这种涂层的自修复能力和抗菌能力。羧甲基壳聚糖在1 690 cm-1和1 530 cm-1处分别为羧酸基团羰基的特征吸收峰和氨基的特征峰。壳聚糖出现在1 530 cm-1处的吸收峰为氨基的面外弯曲振动所产生的,也是氨基键的峰值表征,证明壳聚糖含有氨基官能团。而在经过环糊精和金刚烷修饰过后的壳聚糖,原先的C=O官能团峰值会向低波段偏移。C=O官能团从1 690 cm-1偏移至1 650 cm-1,这是因为N原子中的孤电子对和羧基之间形成了p-π共轭作用。而N-H官能团则会向高波段偏移,如图1(b)所示,N-H官能团从CS的1 530 cm-1偏移至βCD-CS的1 570 cm-1,N-H官能团从CS-COOH的1 530 cm-1偏移至AD-(CS-COOH)的1 545 cm-1。以上的现象表明了被修饰过的壳聚糖有新的酰胺键形成,证明了壳聚糖可以被环糊精和金刚烷修饰,从而构建涂层薄膜。
通过划痕和截断实验来证明材料的自修复能力。实验结果表明,单次和多次划伤后,涂层薄膜都能够进行愈合。如图3、图4所示,划痕明显消失。而且在截断之后,涂层薄膜仍然能够进行自修复,重新联结成一个整体,且不易断裂,重新修复的涂层薄膜仍具有一定黏性。其原理为,当膜上的划痕或是缺口暴露于湿润环境中时,划痕或是缺口两侧的材料相互接触后,材料中的β-CD-CS分子与AD-(CS-COOH)分子能够发生主客体作用,分子之间重新排列组合,随着薄膜内的水分子蒸发,自修复也在进行。在实验过程中我们还发现,反复堆叠的层数越多,其自修复能力越强。但相对的其厚度越大,透光性越低。
通过使用大肠杆菌,金黄色葡萄球菌对涂层的抗菌能力进行评价,结果表明,涂层材料对大肠杆菌以及金黄色葡萄球菌的抗菌效果超过了95%。证明了该涂层材料具有优良的抗菌性能,能够有效抑制细菌在涂层上的生长。该涂层材料抗菌原因很大程度上是因为壳聚糖富含氨基,使自身具有抗菌的特性,而且这种特性在经过其他物质修饰之后,仍可以被保留。同时涂层薄膜的结构特性使得细菌难以生存,该材料自身具备一定的抗菌能力。
综上所述,我们探究了壳聚糖修饰的环糊精与羧甲基壳聚糖修饰的金刚烷,通过自组装形成的涂层薄膜材料,对材料自身的自修复能力和抗菌能力做了系统性的探究,从而为接下来探索该材料的细胞相容性等功能提供了理论基础[24]。结果证明了该材料有良好的自修复能力与抗菌能力,能够用于医疗设备或是生物医学工程等方面,例如用于口罩、防护服等防护装置的涂层,并在生物医学工程方面拥有广阔的应用前景。