苦参素对青光眼模型大鼠的视网膜神经保护作用及机制
宋影慧,李文焘,贺琳,李洋,李艳,李晓鹏
(1.新乡医学院第三附属医院眼科,河南 新乡 453000;2.郑州市第二人民医院,河南 郑州 450000)
青光眼是一组以视乳头改变伴随视敏度下降,极易视野缺失为特征的视神经退行性疾病,是仅次于白内障的全球第二大致盲眼病[1-2]。视网膜神经节细胞(retinal ganglion cells,RGCs)的进行性丢失及轴突数目的减少是青光眼的主要病因[3-4]。因此,寻找新的安全有效的药物以减少视网膜神经节细胞的丢失,对恢复青光眼患者视力至关重要。苦参素(matrine)主要从豆科植物苦参、苦豆子及广豆根中提取,其中,氧化苦参碱成分含量在98%以上[5]。苦参素具有多种药理学作用,如抗病毒、抗炎、抗纤维化、抑制肿瘤细胞等[6-7]。既往相关眼科研究表明:苦参素对实验性自身免疫性视神经炎模型大鼠的视神经具有保护作用[8];苦参素对长春新碱耐药的视网膜母细胞瘤细胞具有促凋亡作用[9];苦参碱眼液可降低实验性葡萄膜炎家兔房水中炎症因子水平,减轻炎性反应[10]。基于苦参素在眼科治疗方面的潜力,本研究建立青光眼大鼠模型,观察苦参素对其视神经保护的作用及机制,旨在为青光眼的临床治疗提供更多的药物选择,现将研究结果报道如下。
1 材料与方法
1.1 实验动物40只SPF级健康成年雄性SD大鼠,体质量220~250 g,购自北京维通利华实验动物技术有限公司上海分公司,动物生产许可证号:SCXK(沪)2017-0011。购入后委托华兰生物工程股份有限公司饲养[许可证号:SYXK(豫)2017-0003]。保持环境通风、温度23~25℃,相对湿度50%~70%,明暗12 h/12 h交替。适应性饲养3 d,使用眼压计测量眼压,40只大鼠眼压均正常。
1.2 药物、试剂与仪器苦参素(成都曼思特生物科技有限公司,批号:A0095);盐酸法舒地尔注射液(Fasudil,天津红日药业股份有限公司,批号:19031601);注射用盐酸丁卡因(江苏九旭药业有限公司,批号:201223);诺氟沙星滴眼液(安徽省双科药业有限公司,批号:210206)。苏木素-伊红(HE)染色试剂盒(北京索莱宝科技有限公司);兔抗大鼠Brn3a、Tau、突触素(synaptophysin)等抗体(美国Invitrogen公司);兔抗大鼠磷酸化肌球蛋白轻链(p-MLC)、磷酸化肌球蛋白轻链磷酸酶(p-MLCP)、磷酸化LIM激酶(p-LIMK)、Rho激酶(ROCK)1和ROCK2等抗体(美国Invitrogen公司);山羊抗兔免疫球蛋白(IgG)(英国Abcam公司)。Tope-open AVIA型眼压计(美国Rei-chert公司);裂隙灯(苏州六六科技有限公司);532-二极管激光(美国Alcon公司);NIB910FL型荧光显微镜(广州市明慧科技有限公司);Fisher Biotech电泳仪(美国Thermo Fisher Scientific公司)。
1.3 分组与建模将40只SD大鼠随机分为正常组、模型组、法舒地尔组和苦参素组,每组各10只。除正常组外,其余各组大鼠采用532-二极管激光光凝法[11]进行造模。方法:麻醉固定大鼠,双眼使用注射用盐酸丁卡因进行表面麻醉,以左眼作为实验眼,右眼作为对照眼。将大鼠头部置于裂隙灯显微镜头架处,以532-二极管激光对左眼行静脉血管光凝(包括角膜缘小梁网和角膜缘颞侧及颞上、颞下3条巩膜浅层静脉),之后使用诺氟沙星滴眼液滴眼。隔日在裂隙灯下观察结膜充血及水肿情况,若左眼眼压高于右眼10 mmHg,则表示造模成功[12]。
1.4 给药自模型制备当日起即给药。按照药理试验中动物与人体间的等效剂量换算公式[13]计算,法舒地尔组大鼠腹腔注射法舒地尔150 mg/kg,每日1次;苦参素组大鼠腹腔注射50 mg/kg苦参素[14](生理盐水溶解),每日1次;模型组注射等体积生理盐水,每日1次。连续注射8 d。正常组大鼠不做处理。实验期间,所有大鼠均存活。
1.5 观察指标与方法
1.5.1 标本采集建模后第8天,从每组中随机选取5只大鼠,摘取眼球置于10%多聚甲醛中固定24 h,去除眼前节组织,取出晶体。每只眼球作为一个标本,常规脱水、透明,石蜡包埋,行视网膜矢状面切片,厚度5 μm,用于HE染色和免疫荧光染色实验。每组随机另取5只大鼠,摘除眼球后,显微镜下去掉眼前节,取出晶体,剥离视网膜,将视网膜置于冻存管中,-80℃保存,用于蛋白免疫印迹(Western Blot)实验。
1.5.2 HE染色观察大鼠视网膜病理学改变将视网膜石蜡切片行常规HE染色,倒置显微镜下观察视网膜的组织结构,采用图像分析系统采集图像,应用Image-Pro Plus 6.0分析系统测定大鼠视网膜厚度。每张切片随机选取5个测试点,取平均值。
1.5.3 免疫荧光染色法检测大鼠视网膜组织内Brn3a及Tau、突触素蛋白表达将视网膜石蜡切片脱蜡;PBS洗涤,柠檬酸抗原修复10 min后,自然冷却;PBS洗涤,室温下用3%H2O2封闭内源性过氧化物酶20 min;PBS洗涤,每张切片加50 μL山羊血清,常温下封闭内源性生物素20 min;每张切片加相应一抗Brn3a(1∶1 000稀释)、Tau(1∶1 000稀释)、突触素(1∶1 000稀释),4℃孵育过夜;PBS洗涤,加二抗(1∶2 000稀释),37℃反应2 h;PBS洗涤,脱水,封片。荧光显微镜下采集图片,Image-Pro Plus 6.0定量分析各目的蛋白的荧光强度。计数Brn3a阳性标记的视网膜神经节细胞。
1.5.4 Western Blot法检测大鼠视网膜组织内p-MLCP、p-MLC、p-LIMK、ROCK1和ROCK2蛋白表达取大鼠视网膜组织标本,常规裂解方法提取细胞质蛋白,按细胞核蛋白抽提试剂盒说明书提取核蛋白,按照BCA蛋白定量试剂盒说明书检测蛋白浓度。取上清液进行SDS-PAGE凝胶电泳后,将蛋白电转移至PVDF膜上,用0.5%脱脂乳粉室温封闭1 h,充分洗涤后分别加入p-MLCP(1∶1 000)、p-MLC(1∶1 000)、p-LIMK(1∶500)、ROCK1(1∶1 000)和ROCK2(1∶1 000)等一抗稀释液,4℃孵育过夜。二抗(1∶5 000)稀释液常温孵育30 min,电化学发光试剂(ECL)显色曝光,应用ImageJ软件分析蛋白灰度。以β-actin为内参,计算目的蛋白的相对表达量。每组实验独立重复3次。
1.6 统计方法采用SPSS 19.0统计软件进行数据分析。计量资料经Shapiro-Wilk检验呈正态分布,以均数±标准差(±s)表示,组间资料经Levene检验证实方差齐性。多组间各指标总体差异比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠视网膜病理形态比较图1结果显示:正常组大鼠视网膜各层排列整齐,结构清晰,神经节细胞核边界清晰;模型组大鼠视网膜出现水肿,视网膜厚度减小,视网膜神经节细胞数量减少,内核层变薄,细胞排列疏松不规则,部分细胞核出现溶解或破碎样;法舒地尔组和苦参素组大鼠视网膜神经节细胞异常程度较模型组减轻,视网膜厚度较模型组增加,与正常组无明显差异。

图1 各组大鼠视网膜病理学形态比较(HE染色,×200)Figure 1 Comparison of rat retinal pathological features among various groups(by HE staining,×200)
表1结果显示:与正常组比较,模型组大鼠视网膜厚度降低(P<0.05);与模型组比较,法舒地尔组和苦参素组大鼠视网膜厚度增加(P<0.05),且与正常组无明显差异(P>0.05);法舒地尔组与苦参素组视网膜厚度无明显差异(P>0.05)。
表1 各组大鼠视网膜厚度比较Table 1 Comparison of rat retinal thickness among various groups(±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组法舒地尔组苦参素组F值P值鼠数/只5 5 5 5视网膜厚度/μm 154.21±6.55 74.02±4.13①135.50±3.34②130.61±5.00②13.054 0.000
2.2 各组大鼠视网膜神经节细胞数量比较图2、表2结果显示:模型组大鼠视网膜神经节细胞数量低于正常组,差异有统计学意义(P<0.05);法舒地尔组和苦参素组大鼠视网膜神经节细胞数量高于模型组,差异有统计学意义(P<0.05),且与正常组比较,差异无统计学意义(P>0.05);法舒地尔组与苦参素组间视网膜神经节细胞数量无明显差异(P>0.05)。

图2 各组大鼠Brn3a阳性标记的视网膜神经节细胞分布情况(免疫荧光染色,×200,标尺=100 μm)Figure 2 Distribution of rat retinal ganglion cells(RGCs)positively labelled with Brn3a in various groups(by immunofluorescence staining,×200,scale bar=100 μm)
表2 各组大鼠视网膜神经节细胞数量比较Table 2 Comparison of number of rat RGCs among various groups (±s)

表2 各组大鼠视网膜神经节细胞数量比较Table 2 Comparison of number of rat RGCs among various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组法舒地尔组苦参素组F值P值鼠数/只5 5 5 5视网膜神经节细胞数量/个40.12±3.01 15.31±2.30①34.22±4.11②30.45±2.64②9.677 0.000
2.3 各组大鼠视网膜Tau和突触素蛋白表达比较图3、图4、表3结果显示:模型组大鼠视网膜组织内Tau和突触素蛋白表达水平低于正常组,差异有统计学意义(P<0.05);法舒地尔组和苦参素组大鼠视网膜组织内Tau和突触素蛋白表达水平高于模型组,差异有统计学意义(P<0.05),且与正常组比较,差异无统计学意义(P>0.05);法舒地尔组与苦参素组间Tau和突触素蛋白表达水平无明显差异(P>0.05)。
表3 各组大鼠视网膜Tau、突触素蛋白表达水平比较Table 3 Comparison of the protein expression levels of Tau and synaptophysin in rat retina among various groups (±s)
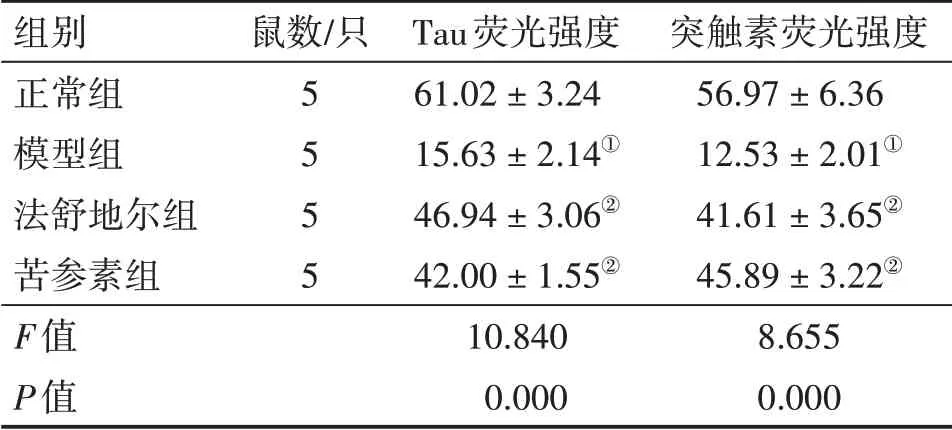
表3 各组大鼠视网膜Tau、突触素蛋白表达水平比较Table 3 Comparison of the protein expression levels of Tau and synaptophysin in rat retina among various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组法舒地尔组苦参素组F值P值鼠数/只5 5 5 5 Tau荧光强度61.02±3.24 15.63±2.14①46.94±3.06②42.00±1.55②10.840 0.000突触素荧光强度56.97±6.36 12.53±2.01①41.61±3.65②45.89±3.22②8.655 0.000
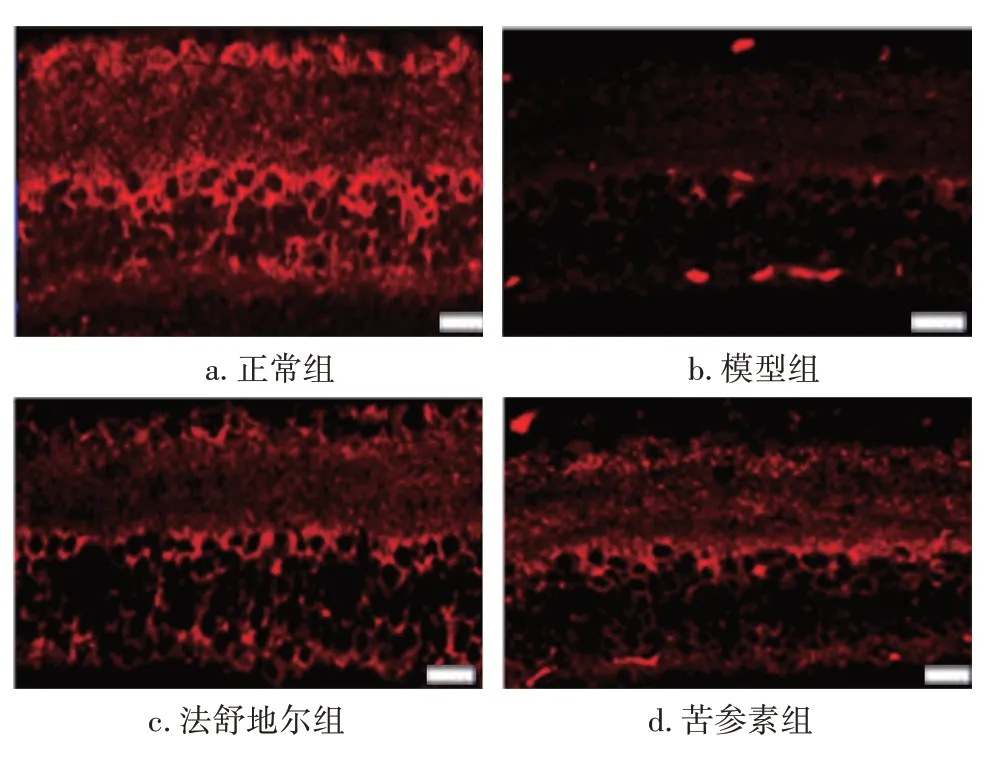
图3 各组大鼠视网膜Tau的免疫荧光染色结果(×400,标尺=50 μm)Figure 3 Immunofluorescence staining results of retinal Tau in various groups of rats(×400,bar=50 μm)

图4 各组大鼠视网膜突触素的免疫荧光染色结果(×400,标尺=50 μm)Figure 4 Immunofluorescence staining results of retinal synaptophysin in various groups of rats(×400,bar=50 μm)
2.4 各组大鼠视网膜p-LIMK、p-MLC和p-MLCP蛋白表达比较图5、表4结果显示:模型组大鼠视网膜组织内p-LIMK、p-MLC和p-MLCP蛋白表达水平均高于正常组,差异有统计学意义(P<0.05);法舒地尔组和苦参素组大鼠视网膜组织内p-LIMK、p-MLC和p-MLCP蛋白表达水平均低于模型组,差异有统计学意义(P<0.05),且与正常组比较,差异无统计学意义(P>0.05);法舒地尔组和苦参素组间p-LIMK、p-MLC和p-MLCP蛋白表达水平无明显差异(P>0.05)。
表4 各组大鼠视网膜p-LIMK、p-MLC和p-MLCP蛋白表达水平比较Table 4 Comparison of the protein expression levels of p-LIMK,p-MLC and p-MLCP in rat retina among various groups(±s)

表4 各组大鼠视网膜p-LIMK、p-MLC和p-MLCP蛋白表达水平比较Table 4 Comparison of the protein expression levels of p-LIMK,p-MLC and p-MLCP in rat retina among various groups(±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组法舒地尔组苦参素组F值P值鼠数/只5 5 5 5 p-LIMK蛋白相对表达量0.63±0.12 1.21±0.14①0.65±0.09②0.71±0.20②6.310 0.000 p-MLC蛋白相对表达量0.67±0.08 1.04±0.13①0.66±0.07②0.64±0.06②20.501 0.000 p-MLCP蛋白相对表达量0.65±0.13 0.92±0.12①0.68±0.07②0.63±0.09②18.347 0.000
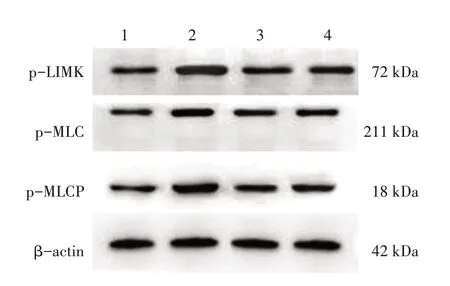
图5 各组大鼠视网膜p-LIMK、p-MLC和p-MLCP的Western Blot电泳条带图Figure 5 Western Blot electrophoretic bands of p-LIMK,p-MLC and p-MLCP in rat retina in various groups
2.5 各组大鼠视网膜ROCK1和ROCK2蛋白表达比较图6、表5结果显示:模型组大鼠视网膜组织内ROCK1和ROCK2蛋白表达水平高于正常组,差异有统计学意义(P<0.05);法舒地尔组和苦参素组大鼠视网膜组织内ROCK1和ROCK2蛋白表达水平低于模型组,差异有统计学意义(P<0.05),而ROCK1蛋白表达水平高于正常组,差异有统计学意义(P<0.05);法舒地尔组与苦参素组间ROCK1和ROCK2蛋白表达水平无明显差异(P>0.05)。
表5 各组大鼠视网膜ROCK1、ROCK2蛋白表达水平比较Table 5 Comparison of the protein expression levels of ROCK1 and ROCK2 in rat retina among various groups (±s)
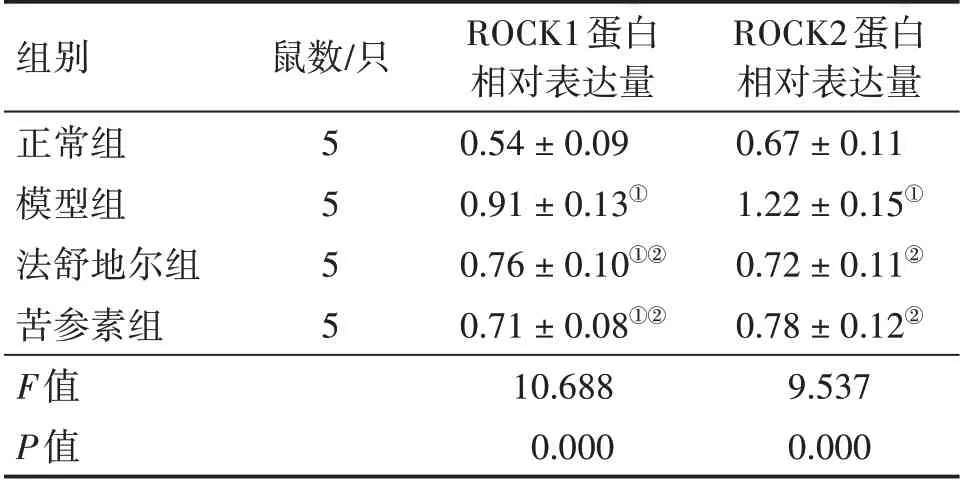
表5 各组大鼠视网膜ROCK1、ROCK2蛋白表达水平比较Table 5 Comparison of the protein expression levels of ROCK1 and ROCK2 in rat retina among various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组法舒地尔组苦参素组F值P值鼠数/只5 5 5 5 ROCK1蛋白相对表达量0.54±0.09 0.91±0.13①0.76±0.10①②0.71±0.08①②10.688 0.000 ROCK2蛋白相对表达量0.67±0.11 1.22±0.15①0.72±0.11②0.78±0.12②9.537 0.000

图6 各组大鼠视网膜内ROCK1、ROCK2的Western Blot电泳条带图Figure 6 Western Blot electrophoretic bands of ROCK1 and ROCK2 in rat retina in various groups
3 讨论
青光眼与视神经广泛性病变、视网膜神经节细胞数量凋亡及其轴突变性有关,可导致慢性渐进性视觉损伤。目前,临床上对于青光眼的治疗主要以降低眼压为主,但由于青光眼视神经病变最终导致视网膜神经节细胞的丧失,仅靠降低眼压不能完全阻止视神经的进行性损伤,因此,开发青光眼的视神经保护药物,不仅能直接促进视网膜神经节细胞的存活,还能促进轴突再生,从而使视神经功能恢复,具有重要的研究意义。
有研究表明,眼部组织除晶状体外,ROCK1和ROCK2均同时表达[15-16]。Rho蛋白是Rho基因编码的信号肽,由200~300个氨基酸组成,在细胞信号转导过程中发挥重要作用。Rho激酶(ROCK)为Rho的下游底物,ROCK有2种同工酶,分别为ROCK1和ROCK2。活化的ROCK可磷酸化其下游底物,包括MLC、MLCP及LIMK,导致生长锥的萎缩和轴突退缩,损伤视神经细胞[17]。ROCK抑制剂能够诱导视神经损伤后轴突的生长和神经再生。动物实验证实,ROCK抑制剂组视网膜神经节细胞的轴突长度、密度及活动度较安慰剂组明显增加[18];体外实验证实,ROCK抑制剂能保护经硫酸软骨素蛋白多糖处理的神经节细胞,使神经损伤程度降低,促进细胞轴突生长[19]。推测ROCK通路相关蛋白可能是视神经损伤后轴突的生长和神经再生的重要靶点。
法舒地尔作为经典的ROCK抑制剂,已被证实对青光眼视神经节细胞具有保护作用[20],因此,本研究选用法舒地尔为对照药物。苦参素来源广泛,容易获取,其安全性已得到证实[21]。Kan等[22]研究证实,苦参素能通过抑制Rho/ROCK信号通路的活性促进多发性硬化症动物模型中枢神经细胞轴突再生。本研究观察了苦参素对青光眼大鼠视网膜中ROCK通路相关分子表达的影响,结果显示,模型组大鼠视网膜p-LIMK、p-MLC和p-MLCP等ROCK通路下游主要目标蛋白及ROCK1和ROCK2蛋白表达水平高于正常组(P<0.05),法舒地尔组和苦参素组大鼠视网膜组织内上述各蛋白表达水平低于模型组(P<0.05),法舒地尔组和苦参素组间各蛋白表达水平无明显差异(P>0.05)。表明苦参素可抑制青光眼大鼠视网膜ROCK及其下游分子表达,且其抑制作用与法舒地尔无明显差异,提示苦参素可能是通过抑制ROCK通路活性促进青光眼大鼠视网膜神经节细胞的存活及轴突的再生。
另外,Tau蛋白是神经细胞中的主要微管相关蛋白,对神经细胞骨架的稳定起重要作用[23]。突触素蛋白在视神经突触的发育中发挥重要作用,增强突触素的表达可促进轴突的再生及神经功能的恢复[24]。Tau和突触素表达强度可表示青光眼大鼠视神经突触的再生状态。本研究结果显示,苦参素可提高青光眼大鼠视网膜神经节细胞数量,上调视网膜Tau和突触素蛋白表达水平,进一步证明了苦参素可促进青光眼大鼠视神经轴突的再生。
综上所述,苦参素对青光眼模型大鼠视神经具有保护作用,可促进青光眼大鼠视网膜神经节细胞的存活和轴突的生长,其作用机制可能与抑制ROCK的活性有关。

