基于“心藏神”探讨金丝桃苷对心肌梗死后抑郁大鼠的治疗作用及机制
裴玲军,王小玲,张乃中,章艺子,李洁,王会敏,裴金娜,唐新花
(1.迁安市老干部保健中心,河北 迁安 064400;2.迁安市中医医院,河北 迁安 064400)
急性心肌梗死是临床上常见的危重病症,其发病率逐年升高,并存在年轻化及复杂化的趋势[1]。抑郁是心肌梗死患者的常见并发症,国际研究显示,心肌梗死患者合并抑郁的发生率为30%~60%,被认为是影响心肌梗死患者预后及死亡的独立危险因子[2]。有研究[3]表明,心血管疾病可以导致抑郁症,抑郁症也可以引起心血管疾病。中医认为“心藏神”,即心主神志,也就是心主神明,指心具有主宰人体五脏六腑、形体官窍的一切生理活动和人体精神意识思维活动的功能[4]。明代张介宾《类经·脏象类》中谓:“心者,君主之官,神明出焉。”《灵枢·邪客篇》曰:“心者,五脏六腑之大主也,精神之所舍也。”调心神是重要的治疗法则。金丝桃苷(hyperoside)是一种存在于连翘、菟丝子、黄蜀葵花、山楂、吴茱萸等中药植物中的黄酮类化合物,既有保护心血管[5-9],又有抗抑郁[10]、改善失眠[11-12]的作用,符合调心神治法,体现了“心藏神”的理论内涵。因此,本研究构建心肌梗死后抑郁大鼠模型,观察金丝桃苷对其治疗的作用及机制,以期为心肌梗死后抑郁治疗药物的选择提供参考依据,现将研究结果报道如下。
1 材料与方法
1.1 实验动物SPF级健康3~4月龄Wistar大鼠60只,雌雄参半,体质量200~220 g,均购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2020-0010,饲养在本院实验动物中心,饲养温度(22±3)℃,湿度60%。按照动物饲养规定喂养7 d后进行实验。
1.2 药物、试剂与仪器金丝桃苷(分子式:C21H20O12;分子量:464.376 3),成都曼斯特生物技术公司生产(批号:MUST18100910),纯度99.98%,为淡黄色粉末,以2%二甲基亚砜(DMSO)配制成混悬液保存备用;福辛普利钠片(中美上海施贵宝制药有限公司,批号:国药准字H19980197);乌拉坦(齐鲁制药有限公司,批号:国药准字H37022259);注射用青霉素钠(华北制药股份有限公司,批号:国药准字H13020655)。白细胞介素(IL)-1β、脑源性神经营养因子(BDNF)及皮质酮(CORT)酶联免疫吸附法(ELISA)检测试剂盒[研域(上海)化学试剂公司];小鼠抗N-甲基-D-天门冬氨酸受体1(NMDAR1)抗体、A型钾离子通道电压门控型钾通道4.2(Kv4.2)抗体(武汉艾美捷科技有限公司);苏木素-伊红(HE)染色液(广州威佳科技有限公司)。动物呼吸机(成都泰盟科技有限公司);SP-2006心电图解析系统(北京软隆生物技术有限公司);高速离心机(德国Eppendorf公司);蛋白电泳仪(北京六一仪器厂);心脏电生理刺激仪(上海涵飞医疗器械有限公司);TBA-120FR全自动生化分析仪(日本东芝公司)。
1.3 心肌梗死后抑郁模型的建立(1)先建立急性心肌梗死模型[13],方法:给予大鼠腹腔注射乌拉坦(800 mg/kg)与α-氯醛糖(40 mg/kg)麻醉后固定于鼠板上。常规消毒后进行心电图监测,气管插管后连接小动物呼吸机(潮气量:30~40 mL/kg、呼吸频率70~80次/min)。于第4肋间钝性分离肋间肌,撕开心包,暴露心脏,左侧心耳及肺动脉圆锥的交界及心尖上结扎冠状动脉前降支。术后观察到大鼠左室壁慢慢变得苍白,并且室壁运动逐渐减弱,心电图ST段出现明显抬高,提示造模成功[14]。术后1~3 d腹腔注射青霉素40万U以减少伤口感染。假手术组在结扎时施以活结。(2)再建立抑郁模型[15]。方法:鼠笼45℃倾斜1 d,鼠笼摇晃15 min,禁食禁水1 d,潮湿垫料1 d,行为限制2 h,4℃冷水、42℃热水均游泳5 min,夹尾1 min,连续光照36 h,捕食者声音刺激0.5 h。上述内容连续28 d内随机选择一种进行刺激,同种刺激不能连续出现。以大鼠伴有探索行为减少、体质量减轻、兴趣下降、毛色晦暗等抑郁症状为建模成功标准[16]。
1.4 分组与干预方法将60只大鼠分为6组,即假手术组,模型组,金丝桃苷低、中、高剂量组和西药组,每组10只。除假手术组外,其余大鼠均建立心肌梗死后抑郁模型。建模成功后第1天,金丝桃苷低、中、高剂量组分别给予9、18、36 mg/kg金丝桃苷灌胃,西药组给予15 mg/kg福辛普利钠灌胃,模型组和假手术组给予0.01 mL/g生理盐水灌胃。每日1次,连续灌胃14 d。
1.5 观察指标与方法
1.5.1 睡眠潜伏期与睡眠时间末次灌胃结束后,给予大鼠腹腔注射50 mg/mL戊巴比妥钠(35 mg/kg)麻醉后,仰卧位放置于平板上,当尾部与平板垂直时开始计时,60 s内不翻动为翻正反射消失。将注射时间到翻正反射消失时间作为睡眠潜伏期(SL),持续计时到大鼠仰卧自动翻转身体为睡眠时间(ST)。
1.5.2 ELISA法检测血清IL-1β、BDNF、CORT含量末次灌胃后,采集大鼠尾部静脉血,离心,保留上清液,实验步骤严格按ELISA试剂盒说明书进行操作。实验完成后立即用酶标仪在450 nm相对630 nm波长处,测定每孔吸光度,绘制标准曲线,计算IL-1β、BDNF、CORT含量。
1.5.3 电生理实验“1.5.2”项下实验结束后,利用心脏电生理刺激测定梗死周边区及远离梗死区的心室有效不应期(VERP)及心室颤动阈值(VFT)。刺激电压从起搏阈值开始,每次以1 V递增直至诱发心室颤动。心室颤动阈值定义为能诱发持续性心室颤动的最小刺激电压。
1.5.4 苏木素-伊红(HE)染色法观察脑、心肌组织形态处死大鼠后取脑组织、心肌组织,石蜡包埋后4 μm切片,二甲苯脱蜡后按照100%-95%-85%-75%乙醇进行逐层脱水,苏木精染色10 min,1%盐酸处理,伊红复染,100%-95%-85%-75%乙醇脱水,封片后观察组织形态。
1.5.5 蛋白免疫印迹法检测心肌组织NMDAR1及Kv4.2蛋白表达取心肌组织裂解,离心,取上清,BCA法进行蛋白定量。上样后,进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离蛋白,转移至聚偏氟乙烯(PVDF)膜,用PBS缓冲液冲洗5 min,用胎牛血清(BSA)封闭液封闭1.5 h;加 入 小 鼠 抗NMDAR1(1∶1 000)、Kv4.2(1∶3 000)、GAPDH(1∶2 000)等一抗稀释液,4℃孵育过夜。洗膜后加入辣根过氧化物酶标记兔抗小鼠IgG二抗(1∶5 000稀释)常温孵育90 min,洗膜后,用电化学发光试剂(ECL)显影曝光3 min。分析NMDAR1、Kv4.2、GAPDH灰度值,结果以目的蛋白与内参蛋白的灰度值比值表示。实验重复3次取平均值。
1.6 统计方法采用SPSS 23.0统计软件进行数据分析。所有数据符合正态分布,以均数±标准差(±s)表示,多组间比较采用单因素方差分析,2组间比较采用独立样本t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠睡眠潜伏期、睡眠时间比较表1结果显示:与假手术组比较,模型组大鼠睡眠潜伏期延长,睡眠时间缩短(P<0.05);与模型组比较,金丝桃苷低、中、高剂量组和西药组大鼠睡眠潜伏期缩短,睡眠时间延长(P<0.05),且中药组呈剂量依赖性;与西药组比较,金丝桃苷高剂量组上述指标差异无统计学意义(P>0.05)。
表1 各组大鼠睡眠潜伏期及睡眠时间比较Table 1 Comparison of sleep latency and sleep duration of rats among various groups(±s)

表1 各组大鼠睡眠潜伏期及睡眠时间比较Table 1 Comparison of sleep latency and sleep duration of rats among various groups(±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与西药组比较
组别假手术组模型组金丝桃苷低剂量组金丝桃苷中剂量组金丝桃苷高剂量组西药组F值P值鼠数/只10 10 10 10 10 10睡眠潜伏期/s 171±18 381±22①266±19①②③226±17①②③177±16①②179±18①②193.900<0.001睡眠时间/min 241±32 75±13①154±16①②③171±18①②③196±22①②193±20①②70.050<0.001
2.2 各组大鼠血清IL-1β、BDNF、CORT水平比较表2结果显示:与假手术组比较,模型组大鼠血清IL-1β、BDNF含量降低,CORT含量升高(P<0.05);与模型组比较,金丝桃苷低、中、高剂量组和西药组大鼠血清IL-1β、BDNF含量升高,CORT含量降低(P<0.05),且中药组呈剂量依赖性;与西药组比较,金丝桃苷高剂量组上述指标差异无统计学意义(P>0.05)。
表2 各组大鼠血清白细胞介素(IL)-1β、脑源性神经营养因子(BDNF)及皮质酮(CORT)水平比较Table 2 Comparison of rat serum interleukin(IL)-1β,brain-derived neurotrophic factor(BDNF)and corticosterone(CORT)levels among various groups (±s)
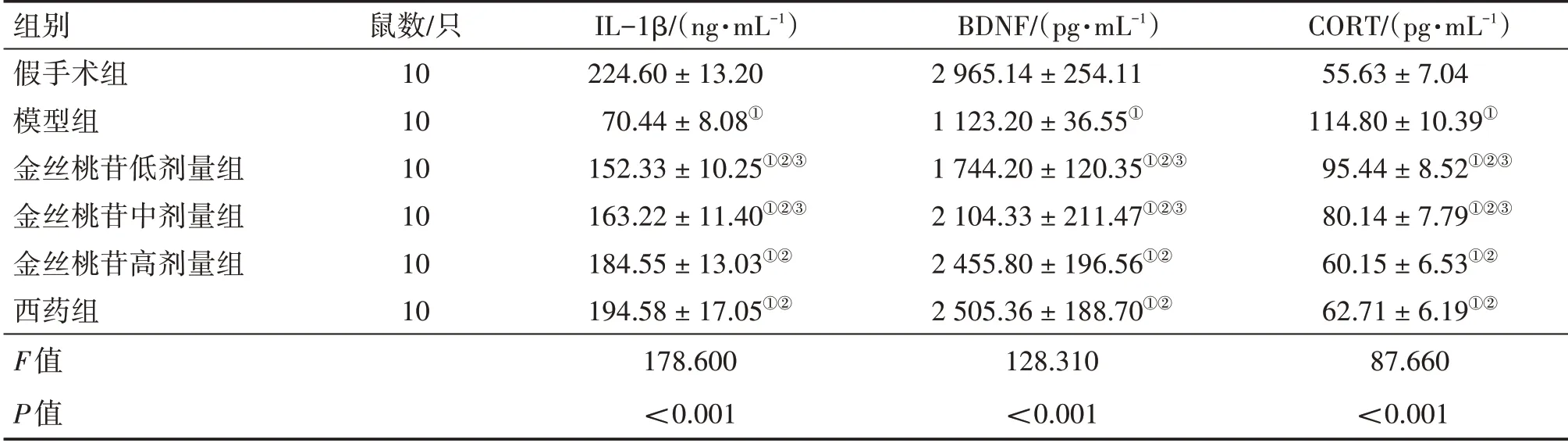
表2 各组大鼠血清白细胞介素(IL)-1β、脑源性神经营养因子(BDNF)及皮质酮(CORT)水平比较Table 2 Comparison of rat serum interleukin(IL)-1β,brain-derived neurotrophic factor(BDNF)and corticosterone(CORT)levels among various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与西药组比较
组别假手术组模型组金丝桃苷低剂量组金丝桃苷中剂量组金丝桃苷高剂量组西药组F值P值鼠数/只10 10 10 10 10 10 IL-1β/(ng·mL-1)224.60±13.20 70.44±8.08①152.33±10.25①②③163.22±11.40①②③184.55±13.03①②194.58±17.05①②178.600<0.001 BDNF/(pg·mL-1)2 965.14±254.11 1 123.20±36.55①1 744.20±120.35①②③2 104.33±211.47①②③2 455.80±196.56①②2 505.36±188.70①②128.310<0.001 CORT/(pg·mL-1)55.63±7.04 114.80±10.39①95.44±8.52①②③80.14±7.79①②③60.15±6.53①②62.71±6.19①②87.660<0.001
2.3 各组大鼠心室电生理结果比较表3结果显示:各组大鼠远离梗死区的VERP水平比较,差异无统计学意义(P>0.05)。与假手术组比较,模型组梗死周边区VERP升高,VFT降低(P<0.05);与模型组比较,金丝桃苷低、中、高剂量组和西药组梗死周边区VERP降低,VFT升高(P<0.05),且中药组呈剂量依赖性;与西药组比较,金丝桃苷高剂量组上述指标差异无统计学意义(P>0.05)。
表3 各组大鼠心室有效不应期(VERP)、心室颤动阈值(VFT)比较Table 3 Comparison of ventricular effective refractory period(VERP)and ventricular fibrillation threshold(VFT)of rats among various groups (±s)

表3 各组大鼠心室有效不应期(VERP)、心室颤动阈值(VFT)比较Table 3 Comparison of ventricular effective refractory period(VERP)and ventricular fibrillation threshold(VFT)of rats among various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与西药组比较
组别假手术组模型组金丝桃苷低剂量组金丝桃苷中剂量组金丝桃苷高剂量组西药组F值P值鼠数/只10 10 10 10 10 10梗死周边区VERP/ms 53.02±2.88 71.25±5.35①66.25±3.04①②③60.18±2.69①②③56.88±2.80①②57.30±3.11①②38.490<0.001远离梗死区VERP/ms 50.33±2.20 52.39±2.84 52.36±2.54 51.27±2.33 51.58±2.60 52.17±2.53 1.014 0.418 VFT/V 13.28±1.68 7.45±1.64①8.25±1.80①②③9.63±1.77①②③10.55±1.73①②9.89±2.13①②12.750<0.001
2.4 各组大鼠脑、心肌组织形态比较图1结果显示:假手术组大鼠脑组织海马区域结构完整,细胞排列整齐、层次清晰,神经细胞核形态正常;模型组大鼠海马区域结构破坏,神经细胞出现萎缩及核固;金丝桃苷低、中、高剂量组和西药组大鼠脑组织海马区结构逐渐趋于完整,神经细胞排列较整齐及层次较丰富,较模型组均明显改善;西药组与金丝桃苷高剂量组脑组织海马区结构改善程度相似。
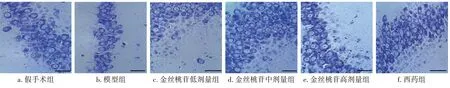
图1 各组大鼠脑海马区组织形态比较(HE染色,×200)Figure 1 Comparison of the histomorphological features of the hippocampal region of the rat brain among various groups(by HE staining,×200)
图2结果显示:假手术组大鼠心肌组织排列整齐,结构完整,无炎症细胞浸润;模型组大鼠心肌组织结构紊乱,心肌细胞数目减少,出现大量肌丝溶解及炎症细胞浸润;与模型组比较,金丝桃苷低、中、高剂量组和西药组心肌组织结构紊乱得到有效改善,心肌细胞数目增多,炎症细胞浸润逐渐减少。

图2 各组大鼠心肌组织形态比较(HE染色,×200)Figure 2 Comparison of rat myocardial histomorphological features among various groups(by HE staining,×200)
2.5 各组大鼠心肌组织中NMDAR1、Kv4.2蛋白表达水平比较表4、图3结果显示:与假手术组比较,模型组大鼠心肌组织中NMDAR1蛋白表达水平升高,Kv4.2蛋白表达水平降低(P<0.05);与模型组比较,金丝桃苷低、中、高剂量组和西药组NMDAR1蛋白表达水平降低,Kv4.2蛋白表达水平升高(P<0.05),且中药组呈剂量依赖性;与西药组比较,金丝桃苷高剂量组上述指标差异均无统计学意义(P>0.05)。

图3 各组大鼠心肌组织NMDAR1(A)、Kv4.2(B)蛋白的Western Blot电泳图Figure 3 Western Blot electrophoretogram of NMDAR1(A)and Kv4.2(B)proteins in rat myocardial tissue in various groups
表4 各组大鼠心肌组织中NMDAR1及Kv4.2蛋白表达水平比较Table 4 Comparison of protein expression levels of NMDAR1 and Kv4.2 in rat myocardial tissue among various groups(±s)
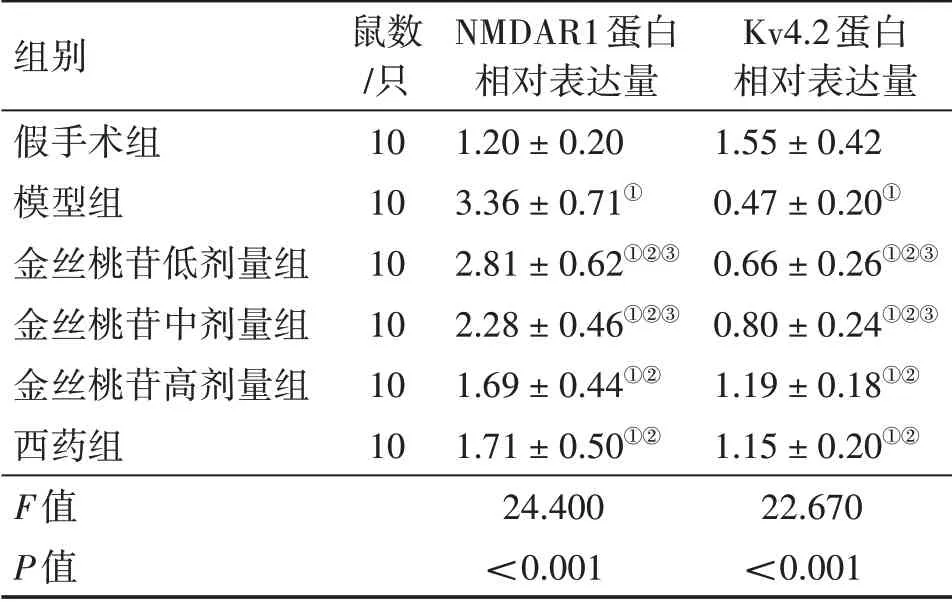
表4 各组大鼠心肌组织中NMDAR1及Kv4.2蛋白表达水平比较Table 4 Comparison of protein expression levels of NMDAR1 and Kv4.2 in rat myocardial tissue among various groups(±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与西药组比较
组别假手术组模型组金丝桃苷低剂量组金丝桃苷中剂量组金丝桃苷高剂量组西药组F值P值鼠数/只10 10 10 10 10 10 NMDAR1蛋白相对表达量1.20±0.20 3.36±0.71①2.81±0.62①②③2.28±0.46①②③1.69±0.44①②1.71±0.50①②24.400<0.001 Kv4.2蛋白相对表达量1.55±0.42 0.47±0.20①0.66±0.26①②③0.80±0.24①②③1.19±0.18①②1.15±0.20①②22.670<0.001
3 讨论
本研究构建了心肌梗死后抑郁大鼠模型,造模过程中大鼠对外界声源表现出由兴奋状态逐渐转为抑郁状态,可见目光呆滞、精神萎靡等,证实心肌梗死后抑郁大鼠缺乏活力,呈现少神状态,这与“心藏神”功能失司密切相关[17]。
本研究HE染色结果显示,模型组大鼠脑组织海马结构破坏,神经细胞出现萎缩及核固,心肌组织结构紊乱,心肌细胞数目减少,出现大量肌丝溶解及炎症细胞浸润,而金丝桃苷组大鼠脑组织及心肌组织病理形态较模型组好转,表明金丝桃苷可修复心脑组织病理损伤。脑组织和心肌组织出现不同程度的病理形态改变,则是“心藏神”功能受到损害后出现的病理变化。
IL-1β能够增加非快速动眼,敲除后该效应消失、睡眠减少,提示IL-1β在调节生理性睡眠中起重要作用[18]。BDNF有调节睡眠的作用,上调其表达可增加睡眠慢波活性,缩短睡眠潜伏期[19]。CORT是一种由下丘脑-垂体-肾上腺素轴分泌的产物,其表达升高可增加血清中睡眠-觉醒因子进而导致睡眠障碍。本研究结果显示,模型组大鼠较假手术组睡眠潜伏期延长、睡眠时间缩短,血清中IL-1β、BDNF含量减少,CORT含量增加;而与模型组比较,金丝桃苷组大鼠睡眠潜伏期缩短、睡眠时间延长,血清中IL-1β、BDNF含量增加,CORT含量减少。表明金丝桃苷能够提高心肌梗死后抑郁大鼠的睡眠质量。
相关研究证实,心肌梗死后抑郁与异常的心室电生理异常相关[20-22]。本研究心肌电生理研究结果显示,模型组大鼠梗死周边区的VERP显著增加,VTF降低,表明心肌梗死后抑郁大鼠交感神经活性、心室电不稳定性增加;金丝桃苷组大鼠心肌梗死周边区VERP降低、VFT升高,表明金丝桃苷能够改善心肌梗死后抑郁大鼠的心肌电生理异常。
N-甲基-D-天门冬氨酸受体(NMDAR)是一类离子型谷氨酸受体,其功能主要参与发育过程中神经回路的细化及触发多种形式的突触可塑性,NMDAR在抑郁症患者中呈高表达[23]。NMDAR1是NMDA受体亚基之一,其异常激活能够介导神经突触损伤,降低神经突触关联,能够影响神经元之间的信号传递,进而增加钙离子大量内流、降低Kv4.2表达,可导致Ito电流密度降低、增加复极时间[24]。Lin等[25]研究表明,抑郁大鼠心肌细胞中NMDAR1表达显著升高,其过度表达可增加心律失常等疾病发生。Kv4.2是重要的Ito电流离子通道蛋白,其表达降低时心脏电生理异常[26-27]。本研究结果显示,与假手术组比较,模型组大鼠心肌组织中NMDAR1表达升高,Kv4.2表达降低,而与模型组比较,金丝桃苷组大鼠心肌组织中NMDAR1表达降低,Kv4.2表达升高,表明金丝桃苷可阻断心肌梗死后抑郁大鼠心肌NMDAR1表达,促进Kv4.2表达。
综上所述,基于“心藏神”,本研究应用金丝桃苷治疗心肌梗死后抑郁大鼠,发现金丝桃苷能够改善心肌梗死后抑郁大鼠的心电不稳定性,改善睡眠质量,且其机制可能与增加血清中IL-1β、BDNF含量,减少CORT含量,抑制心肌组织NMDAR1表达及促进Kv4.2表达有关。
本研究存在一定的不足之处,今后有待加强心藏神和金丝桃苷治疗心肌梗死后抑郁之间进一步联结的研究,以期更好地为心肌梗死后抑郁提供治疗方案。

