基于巨噬细胞焦亡探讨心脉康方抗动脉粥样硬化机制
冯文伟,叶健烽,吕洪雪,周智慧,陈丽萍,叶小汉
(广州中医药大学东莞医院心血管内科,广东 东莞 523808)
目前,动脉粥样硬化性心血管疾病(arteriosclerotic cardiovascular disease)的发病率和死亡率仍不断增长,已经成为全球死亡的首位原因[1-2]。动脉粥样硬化(atherosclerosis)已被证实是一种慢性炎症性的动脉血管壁的脂肪病变,是动脉粥样硬化性心血管疾病发病的重要病理生理基础[3]。他汀类药物是治疗动脉粥样硬化的主要药物,但仍难以有效终止动脉粥样硬化的进展。
动脉粥样硬化属于中医学“脉痹”范畴。本课题组前期研究提出痰浊、瘀血是导致动脉粥样硬化的关键病理因素,广东省名中医叶小汉主任医师结合岭南地区特点对鳖甲煎丸进行加减,衍生了心脉康方[4]。心脉康方有化痰消积、软坚散结的功效,前期临床研究表明,其能改善冠心病患者的症状、炎症指标及血脂水平[5-6]。前期动物实验表明,心脉康方能抑制新西兰兔粥样硬化斑块形成,下调白细胞介素6(IL-6)和白细胞介素1β(IL-1β)等炎症因子和Toll样受体4(TLR4)的表达[7-8],但其具体分子机制仍不明确。有研究[9]表明,TLR4/核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)介导的巨噬细胞焦亡在调节动脉粥样硬化炎症反应中起重要的作用。本研究旨在进一步探讨心脉康方通过抑制TLR4/NLRP3介导巨噬细胞焦亡对动脉粥样硬化的改善作用,以期为临床应用提供实验依据,现将研究结果报道如下。
1 材料与方法
1.1 细胞J774A.1小鼠单核巨噬细胞(来源于BABL/cN小鼠),由广州吉妮欧生物科技有限公司提供。
1.2 药物、试剂与仪器心脉康方由醋鳖甲15 g、枳实12 g、三棱10 g、胆南星6 g、醋莪术10 g、生牡蛎30 g、党参15 g、地龙10 g组成,中药材由广州中医药大学东莞医院中药房提供;阿托伐他汀钙片(乐普制药科技有限公司生产,批号:202004105C)。胎牛血清、青霉素和链霉素(美国Hyclone公司);DMEM培养基(美国Gibco公司);TLR4过表达质粒(广州吉妮欧生物科技有限公司);氧化低密度脂蛋白(ox-LDL)试剂(北京协生生物科技有限责任公司);总胆固醇(TC)、甘油三酯(TG)、游离胆固醇(FC)及胆固醇酯(CE)等检测试剂盒(南京建成生物工程研究所);油红O染色液和碘化丙啶(PI)染色液(北京索莱宝科技有限公司);乳酸脱氢酶(LDH)检测试剂盒(沈阳万类生物科技有限公司);兔抗IL-1β抗体和兔抗GAPDH抗体(美国Abcam公司);兔抗TLR4、NLRP3、含CARD结构域的凋亡相关颗粒样蛋白(ASC)、白细胞介素18(IL-18)、消皮素D-N端(GSDMD-N)、半胱氨酸蛋白水解酶1(Caspase-1)等抗体和辣根过氧 化 物 酶(HRP)标 记 的 山 羊 抗 兔IgG(H+L)(Affinity,中国);TRIzol(美国Invitrogen公司);逆转录和实时定量多聚酶链反应(qPCR)试剂盒(TaKaRa,中国)。Multiskan FC酶标仪(美国Thermo Fisher公司);BX53M倒置显微镜(日本Olympus公司);CFX96 qPCR仪(美国Bio-Rad公司)。
1.3 含药血清制备将18只SD大鼠(体质量约200 g)随机分为空白组、心脉康方组和阿托伐他汀组,每组6只。根据70 kg成人每日口服用药的临床推荐剂量,按照成人与大鼠的等效剂量换算系数折算成大鼠灌胃给药剂量,心脉康方组给予心脉康方9.72 g·kg-1·d-1灌胃,阿托伐他汀组给予1.80 mg·kg-1·d-1[10]灌胃,空白组给予等体积生理盐水灌胃,每12 h 1次,连续灌胃7 d。末次给药后1 h,无菌取血制备含药血清。经56℃灭活30 min后,冻存管分装,-20℃冰箱保存备用。使用时以DMEM培养液稀释成所需浓度。
1.4 细胞培养及药物处理用含有10%胎牛血清的DMEM培养基在37℃、5%CO2的条件下培养J774A.1巨噬细胞。加药前1 d,以2×105/孔细胞接种到6孔板中,分组:对照组(10%胎牛血清),ox-LDL组(100 μg·mL-1ox-LDL[11]),阿托伐他汀组(100 μg·mL-1ox-LDL+10%阿托伐他汀含药血清),心脉康方低浓度组(100 μg·mL-1ox-LDL+5%心脉康方含药血清),心脉康方中浓度组(100 μg·mL-1ox-LDL+10%心脉康方含药血清),心脉康方高浓度组(100 μg·mL-1ox-LDL+20%心脉康方含药血清)。阿托伐他汀和不同浓度的心脉康方含药血清分别与100 μg·mL-1ox-LDL共同处理J774A.1巨噬细胞48 h后,收集细胞沉淀和培养上清液。
继而进行恢复实验,实验分组:对照组(10%胎牛血清)、ox-LDL组(100 μg·mL-1ox-LDL)、心脉康方组(100 μg·mL-1ox-LDL+20%心脉康方含药血清)、阿托伐他汀组(100 μg·mL-1ox-LDL+10%阿托伐他汀含药血清)、心脉康方+TLR4组(100 μg·mL-1ox-LDL+20%心脉康方含药血清+2 μg·mL-1TLR4过表达质粒[12])、阿托伐他汀+TLR4组(100 μg·mL-1ox-LDL+10%阿托伐他汀含药血清+2 μg·mL-1TLR4过表达质粒)。
1.5 观察指标与方法
1.5.1 脂质检测药物处理方法同“1.4”项。收集细胞沉淀,用超声波破碎仪裂解细胞,以400g离心5 min后,收集上清液。用TC、TG、FC检测试剂盒检测TC、TG、FC以及CE(CE=TC-FC)的水平,评估细胞中脂质累积情况。
1.5.2 qPCR法检测细胞焦亡通路相关信号分子的基因表达药物处理方法同“1.4”项。收集细胞沉淀,采用TRIzol提取总RNA,并将总RNA逆转录成cDNA。进行qPCR扩增,每个样品重复3次。qPCR反应程序:热变性95℃2 min,进入循环,95℃15 s,60℃30 s,反应45个循环后退出,进入溶解曲线60~95℃。采用2-ΔΔCt方法分析目的基因表达量。TLR4、NLRP3、Caspase-1、IL-18、IL-1β及β-actin(为内参)引物序列见表1。

表1 PCR引物序列Table 1 PCR primer sequences
1.5.3 Western Blot法检测细胞焦亡通路相关信号分子的蛋白表达药物处理方法同“1.4”项。收集细胞沉淀,加入放射免疫沉淀分析(RIPA)裂解液抽提总蛋白,用二喹啉甲酸(BCA)定量试剂盒测定蛋白浓度。上样,进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离蛋白并转移到PVDF膜上,用5%脱脂奶粉封闭液在室温下封闭1 h后,分别加入以下一抗稀释液[TLR4(1∶800)、NLRP3(1∶800)、Caspase-1(1∶500),ASC(1∶500)、GSDMD-N(1∶500),IL-18(1∶1 000)、IL-1β(1∶1 000)、GAPDH(1∶1 000)],4℃孵育过夜。TBST洗膜3次,每次5 min,然后与HRP标记的山羊抗兔IgG(H+L)二抗稀释液(1∶5 000)进行室温孵育2 h,再用TBST洗膜3次,每次5 min,最后用电化学发光试剂(ECL)进行显影,冲洗胶片。
1.5.4油红O染色法观察巨噬细胞脂质积聚和泡沫化情况药物处理方法同“1.4”项。药物处理细胞48 h后,取0.5%油红O/异丙醇储存液与蒸馏水按照3∶2比例混匀,静置10 min后过滤获得油红O染液。将不同组别干预处理48 h的细胞加入60%异丙醇浸泡5 min,倒去异丙醇后,换0.5%油红O溶液浸染15 min,倒去油红O溶液后,换85%异丙醇溶液清洗3 min至背景无色后换蒸馏水清洗。最后倒置显微镜下观察和拍照。
1.5.5 碘化丙啶(PI)染色法观察细胞死亡情况药物处理方法同“1.4”项。药物处理细胞48 h后,加入1 μg·mL-1Heochst 33342染色液,37℃孵育10 min,再弃去染液后,加入1.0 mL PI染液,4℃避光染色15 min,倒置荧光显微镜下观察和拍照。
1.5.6 微量酶标法检测细胞上清LDH含量药物处理方法同“1.4”项。收集细胞培养上清液,用LDH试剂盒(微量酶标法)检测细胞培养上清液中的LDH水平。
1.6 统计方法采用SPSS 22.0和GraphPad Prism 9.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组比较采用单因素方差分析以及事后检验Tukey HSD法。以P<0.05为差异有统计学意义。
2 结果
2.1 心脉康方含药血清抑制ox-LDL诱导的巨噬细胞脂质积聚和泡沫化TC、TG、FC以及CE/TC水平升高是脂质累积的重要指标。与对照组比较,ox-LDL组中TC、TG、FC和CE/TC水平明显升高;而各浓度心脉康方含药血清和阿托伐他汀抑制了ox-LDL诱导的TC、TG、FC和CE/TC水平升高,且抑制作用呈浓度依赖性。提示心脉康方能抑制ox-LDL诱导的巨噬细胞脂质积聚。见图1。

图1 心脉康方含药血清对ox-LDL诱导巨噬细胞脂质积聚的影响Figure 1 Effect of Xinmai Kang Formula-containing serum on lipid accumulation in ox-LDL-induced macrophages
巨噬细胞泡沫化是早期动脉粥样硬化进展的主要标志。油红O染色结果显示:对照组大部分细胞没有脂滴,少数细胞含有少量的脂滴;ox-LDL组细胞体积增大变圆,细胞质中含有大量红色脂滴;与ox-LDL组相比较,阿托伐他汀组和不同浓度的心脉康方含药血清组脂滴含量逐渐下降,呈浓度依赖性。提示心脉康方能够抑制ox-LDL诱导的巨噬细胞泡沫化。见图2。
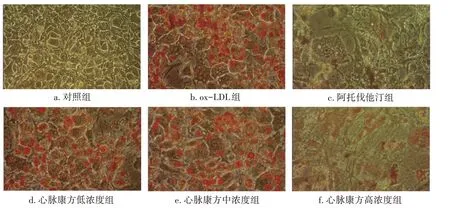
图2 心脉康方含药血清对ox-LDL诱导巨噬细胞泡沫化的影响(油红O染色法)Figure 2 Effect of Xinmai Kang Formula-containing serum on foaming in ox-LDL-induced macrophages(by oil red O staining method)
2.2 心脉康方含药血清抑制ox-LDL诱导巨噬细胞焦亡与对照组比较,ox-LDL组中IL-1β、IL-18 mRNA和蛋白水平以及GSDMD-N蛋白表达水平显著上升;与ox-LDL组比较,阿托伐他汀组和不同浓度的心脉康方含药血清组上述各指标水平均呈下降趋势,且呈浓度依赖性。具体结果见图3-A~F。
图3-G结果显示,ox-LDL能够诱导巨噬细胞培养上清液中LDH含量明显地增高,经阿托伐他汀或者不同浓度的心脉康方含药血清干预后,这种上升趋势得到逆转,且逆转的程度与心脉康方含药血清浓度呈正相关性。
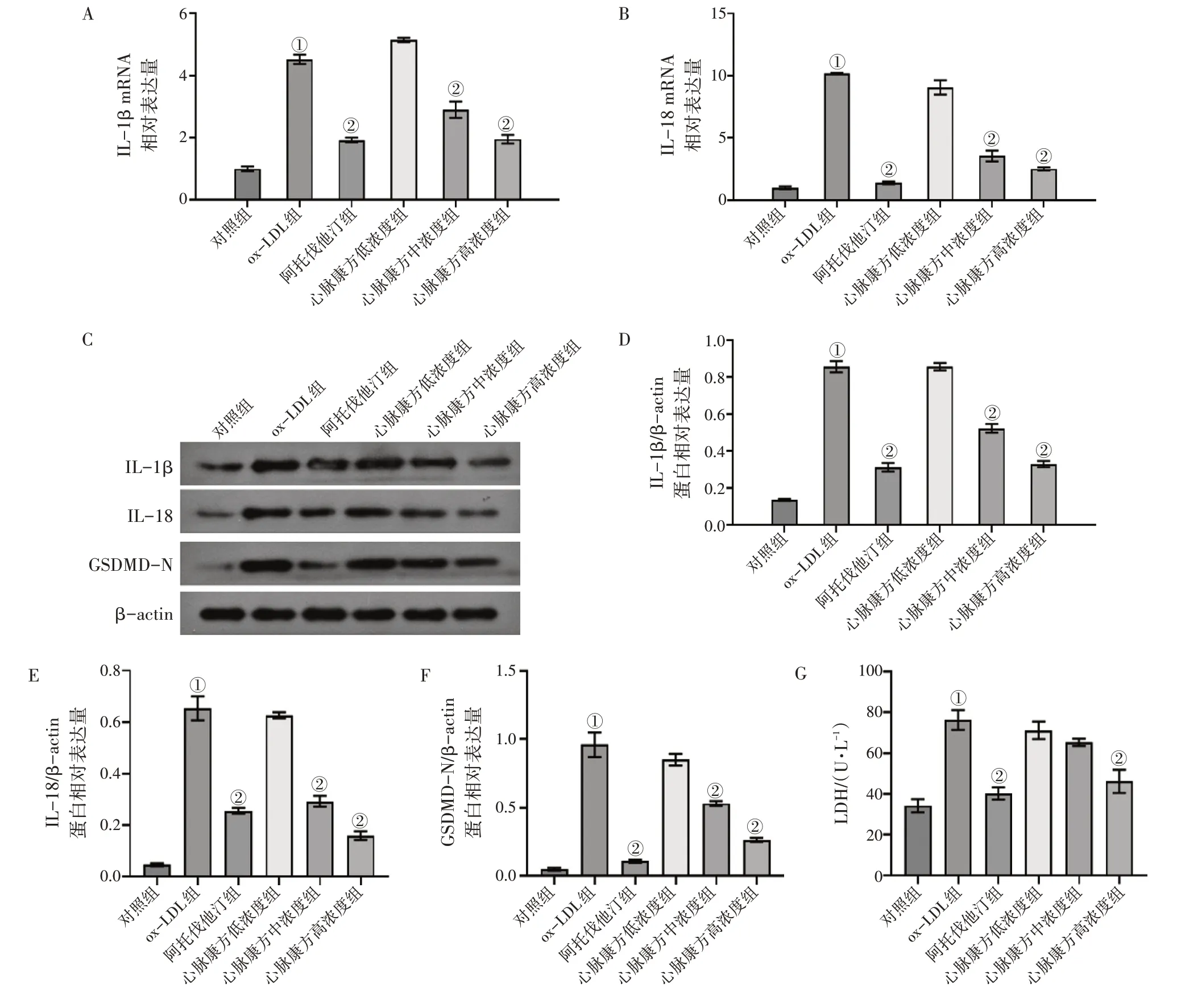
图3 心脉康方含药血清对ox-LDL诱导巨噬细胞焦亡的影响Figure 3 Effect of Xinmai Kang Formula-containing serum on pyroptosis of ox-LDL-induced macrophages
PI染色结果显示,与对照组相比较,ox-LDL组中PI阳性细胞数量急剧上升,但在阿托伐他汀或者不同浓度的心脉康方含药血清的干预下,PI阳性细胞数量呈下降趋势,且呈浓度依赖性。具体结果见图4。
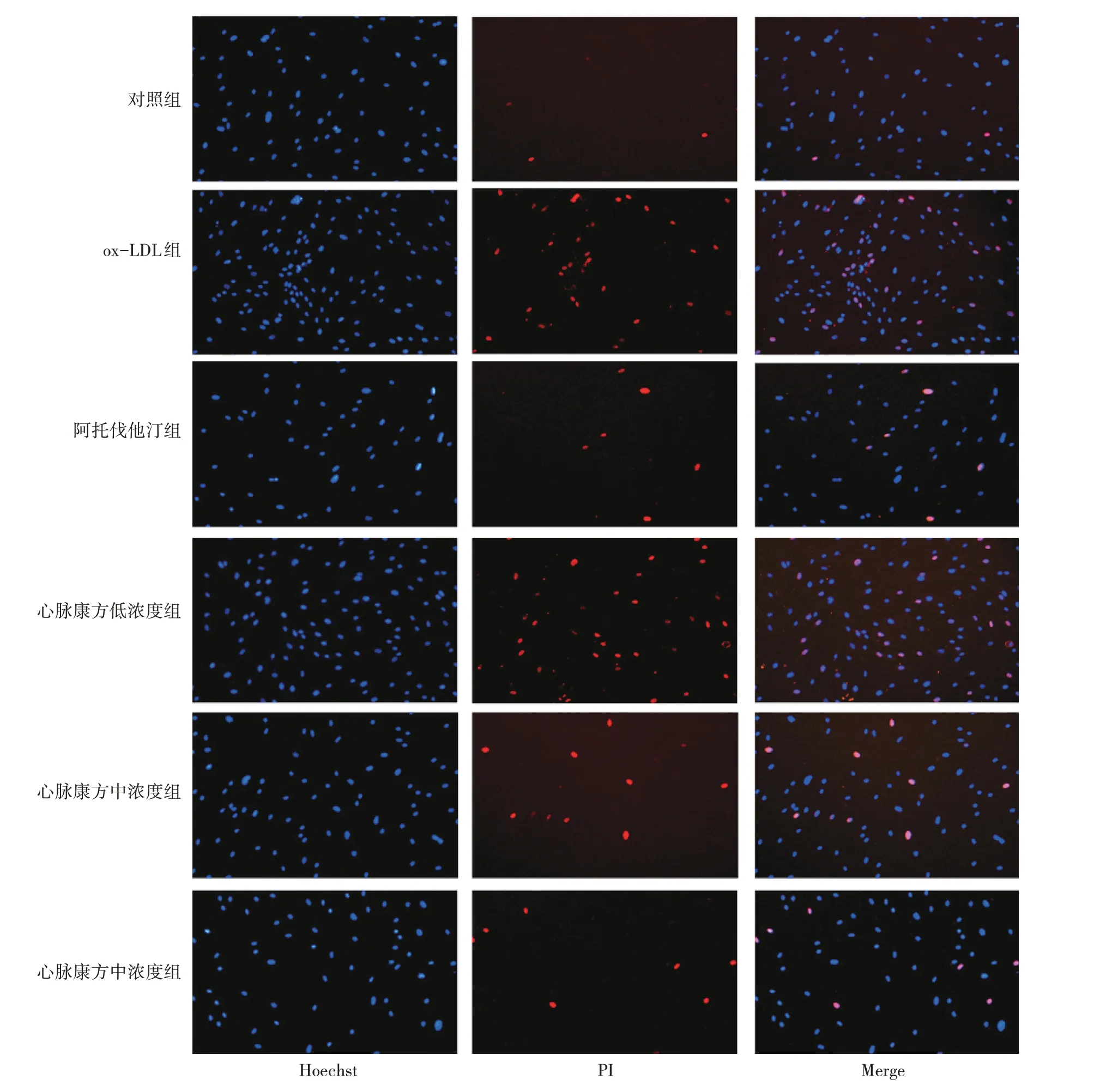
图4 心脉康方含药血清对ox-LDL诱导巨噬细胞焦亡的影响(PI染色法)Figure 4 Effect of Xinmai Kang Formula-containing serum on pyroptosis of ox-LDL-induced macrophages(by PI staining method)
以上实验结果提示,心脉康方能够阻遏ox-LDL诱导的巨噬细胞焦亡。
2.3 心脉康方含药血清抑制ox-LDL诱导巨噬细胞TLR4/NLRP3信号通路的激活采用qPCR实验检测焦亡相关信号通路基因表达。结果显示,ox-LDL可明显地上调巨噬细胞中TLR4、NLRP3和Caspase-1 mRNA表达水平,经阿托伐他汀或者不同浓度的心脉康方含药血清干预后,可明显逆转ox-LDL诱导巨噬细胞中TLR4、NLRP3和Caspase-1 mRNA表达水平的升高,且心脉康方含药血清浓度越高,抑制效果越明显。具体结果见图5-A~C。
继而采用Western Blot实验检测焦亡相关信号通路的激活情况。结果显示,与对照组相比较,ox-LDL组中TLR4、NLRP3、ASC以及Caspase-1的蛋白表达水平显著上升,在阿托伐他汀或者不同浓度的心脉康方含药血清的作用下,这种上升趋势得以逆转,且逆转效果与心脉康方含药血清的浓度呈正相关。具体结果见图5-D~H。
以上实验结果提示,心脉康方能够阻止ox-LDL诱导巨噬细胞中TLR4/NLRP3信号通路的激活。
2.4 TLR4过表达逆转心脉康方含药血清对ox-LDL诱导巨噬细胞TLR4/NLRP3信号通路的抑制作用为了探讨心脉康方含药血清是否通过TLR4/NLRP3信号通路来调控巨噬细胞焦亡,本研究首先将TLR4过表达质粒、ox-LDL和心脉康方含药血清共同处理巨噬细胞48 h,并通过qPCR和Western Blot实验检测各组细胞中TLR4、NLRP3、Caspase-1的表达水平。qPCR结果显示,TLR4过表达能够显著地逆转阿托伐他汀或者心脉康方含药血清对ox-LDL诱导巨噬细胞中TLR4、NLRP3、Caspase-1 mRNA水平的降低作用,具体结果见图6-A~C。
Western Blot实验结果也显示,TLR4过表达能够明显地逆转阿托伐他汀或者心脉康方含药血清对ox-LDL诱导巨噬细胞中TLR4、NLRP3、ASC和Caspase-1蛋白水平的下调作用,具体结果见图6-D~H。
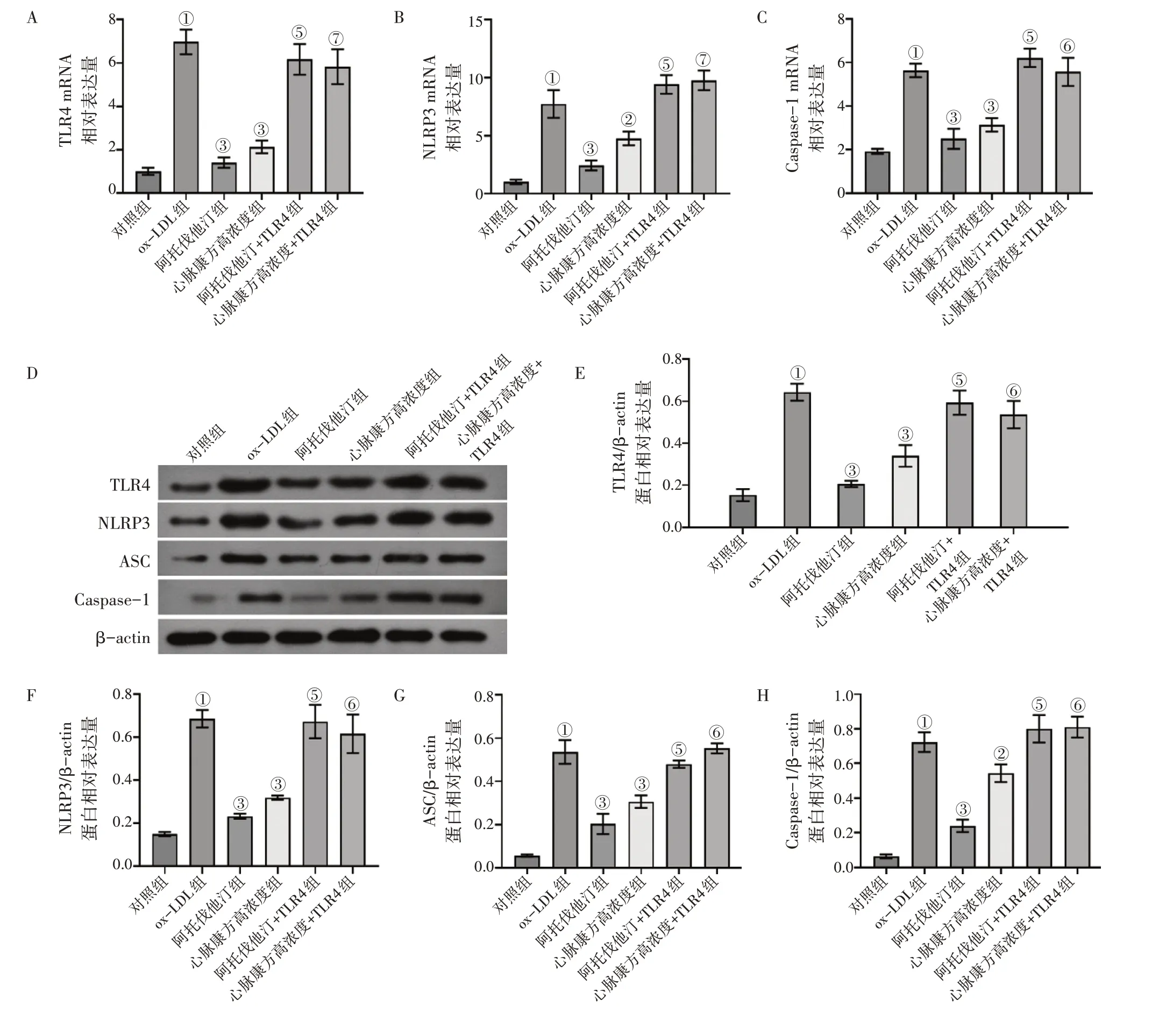
图6 TLR4过表达与心脉康方含药血清共同作用对ox-LDL诱导巨噬细胞中TLR4/NLRP3信号通路的影响Figure 6 Effect of TLR4 overexpression in combination with Xinmai Kang Formula-containing serum on pyroptosis of ox-LDL-induced macrophages
2.5 TLR4过表达逆转心脉康方含药血清对ox-LDL诱导巨噬细胞脂质积聚和泡沫化的抑制作用本研究通过检测TC、TG、FC水平,及采用油红O染色观察各组中脂质积累和泡沫化情况,结果显示,TLR4过表达能够显著地逆转阿托伐他汀或者心脉康方含药血清对ox-LDL诱导巨噬细胞脂质积聚的减少作用,具体结果见图7。同时,TLR4过表达也能够明显地逆转阿托伐他汀或者心脉康方含药血清对ox-LDL诱导巨噬细胞泡沫化的抑制作用,具体结果见图8。
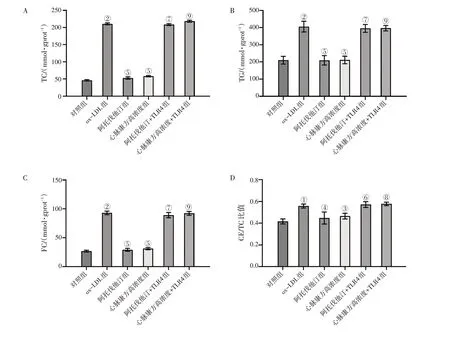
图7 TLR4过表达与心脉康方含药血清共同作用对ox-LDL诱导巨噬细胞脂质积聚的影响Figure 7 Effect of TLR4 overexpression in combination with Xinmai Kang Formula-containing serum on lipid accumulation in ox-LDL-induced macrophages
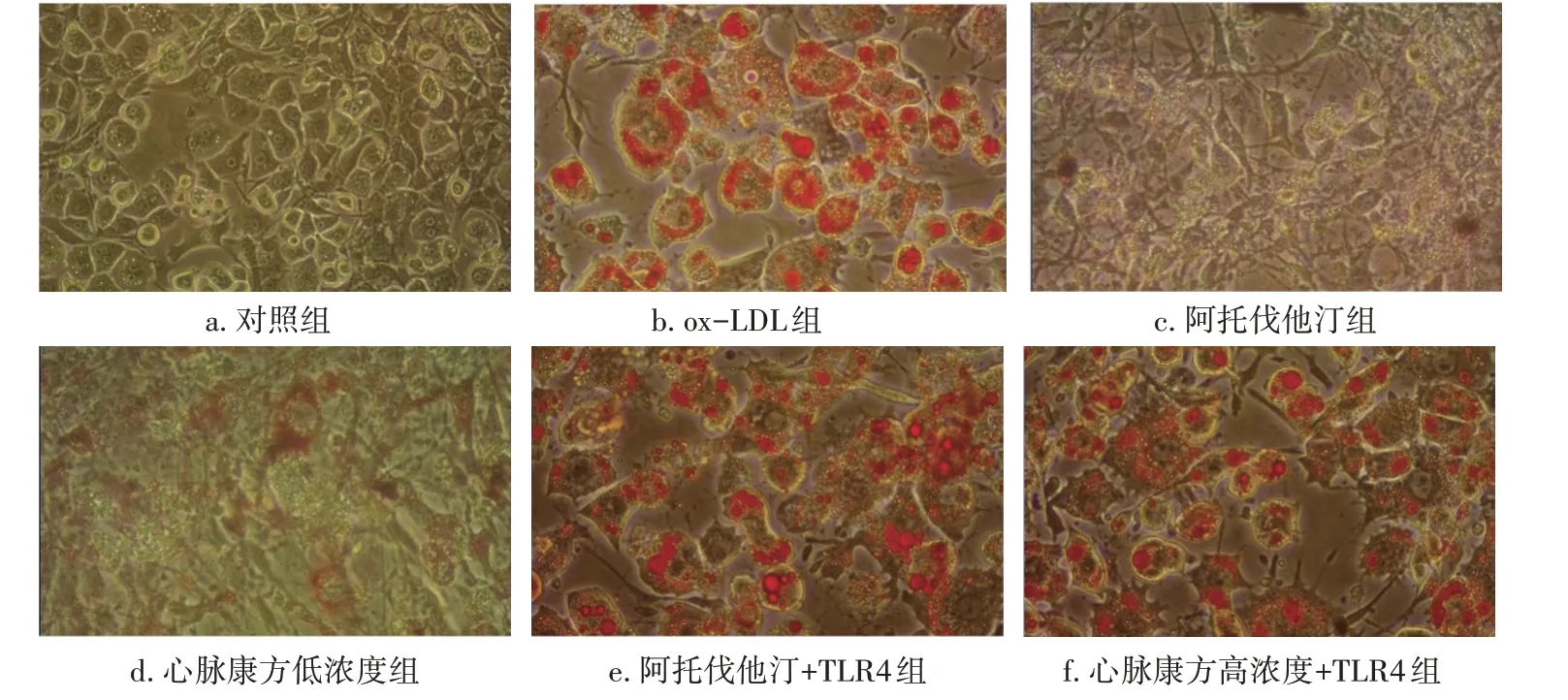
图8 TLR4过表达与心脉康方含药血清共同作用对ox-LDL诱导巨噬细胞泡沫化的影响(油红O染色法)Figure 8 Effect of TLR4 overexpression in combination with Xinmai Kang Formula-containing serum on foaming of ox-LDL-induced macrophages(by Oil Red O staining method)
2.6 TLR4过表达逆转心脉康方含药血清对ox-LDL诱导巨噬细胞焦亡的抑制作用采用qPCR和Western Blot法检测各组中细胞焦亡相关下游基因和蛋白的表达以及采用LDH试剂盒和IP染色检测各组中细胞焦亡情况,结果显示,TLR4过表达能够逆转阿托伐他汀或者心脉康方含药血清对ox-LDL诱导巨噬细胞焦亡相关下游基因IL-1β和IL-18 mRNA表达水平以及IL-1β、IL-18和GSDMD-N蛋白表达水平的下降作用,具体结果见图9-A~F。TLR4过表达也能够逆转阿托伐他汀或者心脉康方含药血清对ox-LDL诱导巨噬细胞释放LDH水平的减少作用,具体结果见图9-G。此外,TLR4过表达能够逆转阿托伐他汀或者心脉康方含药血清对ox-LDL诱导PI阳性细胞数量的降低作用,具体结果见图10。

图9 TLR4过表达与心脉康方含药血清共同作用对ox-LDL诱导巨噬细胞焦亡的影响Figure 9 Effect of TLR4 overexpression in combination with Xinmai Kang Formula-containing serum on pyroptosis of ox-LDL-induced macrophages
3 讨论
动脉粥样硬化的病变特点为由于机体内脂质代谢受损引起的动脉壁内膜易损斑块沉积,斑块中含有大量炎症细胞(巨噬细胞、激活的T细胞等),少量平滑肌细胞及较多新生血管。炎症作为免疫应答的关键环节,贯穿动脉粥样硬化发病的整个过程,影响动脉粥样硬化的形成和进展[3]。因此,干预炎症因子逐渐成为防治动脉粥样硬化的有效手段[13-14]。
心脉康方中:鳖甲滋阴清热、软坚散结,为君药;三棱、莪术行气破血,牡蛎、地龙软坚消积,共为臣药;枳实破气化痰消积,胆南星化痰,为佐药;再佐以党参益气健脾,使破气不伤正和伤胃。诸药合用,共奏化痰消积、软坚散结之功。现代药理学研究表明:莪术、三棱能够抑制炎症,阻止血栓形成[15];党参多糖、地龙可调节免疫反应,抑制细胞炎症因子表达[16-17]。
动脉粥样硬化的始动环节是血管内皮损伤,脂质积聚,巨噬细胞吞噬脂质后变成巨噬泡沫细胞。本研究结果显示,ox-LDL能够诱导巨噬细胞脂质沉积和泡沫化,与文献报道[18-19]一致。血脂异常为动脉粥样硬化的主要危险因素,巨噬细胞泡沫化是早期动脉粥样硬化进展的主要标志。本研究结果显示,心脉康方含药血清中、高浓度均能改善TC、TG、FC和CE/TC水平,呈浓度依赖性。油红O染色结果显示,心脉康方含药血清可减少ox-LDL诱导巨噬细胞中红色脂滴的积聚,随着药物浓度的增加,效果更为明显。表明心脉康方含药血清能够抑制ox-LDL诱导的巨噬细胞泡沫化,从而发挥其改善动脉粥样硬化的作用。
巨噬细胞功能障碍被认为是动脉粥样硬化发展的关键步骤。在动脉粥样硬化的进展中,病变巨噬细胞的死亡和死细胞的吞噬清除功能缺陷促进了斑块坏死的形成[20]。据报道,细胞焦亡(pyroptosis)与人类巨噬细胞死亡有关,提示细胞焦亡在动脉粥样硬化中发挥重要的作用[4]。细胞焦亡又称细胞炎性坏死,是一种促炎症性程序性细胞死亡方式,其特点是气泡状突起形成,GSDMD在细胞膜形成孔,胞内LDH等物质流出,最终导致细胞肿胀,膜破裂,造成IL-18和IL-1β等炎症因子的大量释放。因此,活化的GSDMD蛋白是引起细胞焦亡的关键步骤,而检测LDH可评估细胞渗漏程度。有研究证实,动脉粥样硬化斑块中IL-18和IL-1β的表达均升高,而在不稳定斑块中,其表达更为明显[21]。本研究结果显示,模型组中LDH含量,PI阳性细胞数,GSDMD-N、IL-1β和IL-18水平均显著升高,而心脉康含药血清可使PI阳性细胞呈下降趋势,降低GSDMD-N的表达和上清液中LDH含量,以及下调IL-18和IL-1β等炎症因子的表达,且趋势呈浓度依赖性,这表明心脉康方含药血清有效地抑制了巨噬细胞焦亡。
ox-LDL可被巨噬细胞中的TLR-4所识别,进而诱导巨噬细胞中NLRP3、pro-Caspase-1、GSDMD、pro-IL-1β和pro-IL-18的上调,NLRP3受到刺激活化后,与ASC相结合,募集pro-Caspase-1并诱导自我剪切成Caspase-1。Caspase-1的激活介导后续消皮素D(GSDMD)蛋白的活化,导致焦亡的发生[11]。由此可见,TLR4/NLRP3信号通路在细胞焦亡的调控中发挥着重要作用。有学者报道,抑制该通路可减少细胞焦亡及改善动脉粥样硬化[22-23]。本研究结果显示,不同浓度的心脉康方含药血清均可降低ox-LDL诱导巨噬细胞中TLR4、NLRP3、ASC和Caspase-1的表达,并且随着心脉康方含药血清浓度的升高其表达量逐渐下降。这提示心脉康方可能通过阻止TLR4/NLRP3信号通路的激活,抑制了ox-LDL诱导巨噬细胞焦亡,从而发挥改善动脉粥样硬化的作用。为了进一步探讨心脉康方含药血清是否通过TLR4/NLRP3信号通路来调控巨噬细胞焦亡抗动脉粥样硬化,本研究进行了一系列的细胞恢复实验。结果表明,TLR4过表达能够逆转心脉康方含药血清对ox-LDL诱导巨噬细胞脂质积聚、泡沫化、焦亡和炎症反应的抑制作用,进一步证实了心脉康方对巨噬细胞焦亡的抑制作用与TLR4/NLRP3通路有关。
综上所述,心脉康方可通过调控TLR4/NLRP3信号通路的活化抑制ox-LDL诱导巨噬细胞脂质累积、泡沫化和焦亡,从而起到抗动脉粥样硬化的作用。

