枸杞多糖对慢性青光眼大鼠视网膜神经节细胞损伤的改善作用及其可能机制▲
蒋兆荣 段海霞 陈 冰 王班伟
[珠海市第二人民医院(珠海市中西医结合医院)眼科,广东省珠海市 519000]
青光眼是一种复杂的慢性神经退行性疾病,可损害视神经,严重时可导致永久性失明,目前仍缺乏有效的治疗方法。枸杞多糖(lycium barbarum polysaccharide,LBP)是我国传统中药枸杞的提取物,不但具有抗衰老、抗肿瘤、降血糖、提高免疫力等多种功效,而且还可防治视网膜病变、白内障、青光眼等眼部慢性疾病[1]。研究表明,LBP可以改善小鼠视网膜形态,延缓视网膜神经节细胞(retinal ganglion cell,RGC)功能衰退而导致的光感受器退化[1],并可挽救急性高眼压大鼠神经退行性变,改善视网膜功能[2],还能维持血-视网膜屏障,提高RGC的存活率[3]。
氧化应激反应的增强可引起青光眼、糖尿病视网膜病变和缺血性视神经病变等[4],LBP可通过改善大鼠视网膜的氧化应激状态抑制氯化钙诱导的RGC凋亡[4]。Ras同源基因家族成员A(Ras homolog family member A,RHOA)属于小分子三磷酸鸟苷结合蛋白Rho家族成员之一,而Rho相关卷曲螺旋形成蛋白激酶1(Rho associated coiled-coil containing protein kinase 1,ROCK1)是RHOA/ROCK1信号通路下游的主要靶效应因子,也是Caspase-3的直接底物,而抑制ROCK1和Caspase-3的活化可减轻甲基汞诱导的细胞凋亡[5]。但是LBP是否可通过RHOA/ROCK1通路减轻慢性青光眼大鼠的RGC损伤,目前鲜有报告。本研究采用上巩膜静脉烙闭法建立慢性青光眼大鼠模型,使用LBP和RHOA激动剂水仙环素进行干预,旨在从RHOA/ROCK1通路探讨LBP减轻慢性青光眼大鼠RGC损伤的作用机制,为在临床上应用LBP治疗慢性青光眼提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:清洁级健康SD大鼠(120只,雄性,7~8周龄,体重180~220 g)购自重庆医科大学动物实验中心[许可证号:SCXK(渝)2018-0003],相关干预处理符合国家实验室动物伦理保护标准及相关法律规定。按照3R原则给予实验动物人道的关怀照顾。饲养条件为温度22 ℃,湿度55%,12 h光暗循环。
1.1.2 实验药物:LBP(含量>32%)购自宁夏润德枸杞产业有限公司(批号:100407-201801)。RHOA激动剂水仙环素(纯度为99.74%,目录号为HY-16563)购自美国MCE公司(批号:29477-83-6)。
1.1.3 主要试剂和仪器:大鼠超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛、一氧化氮ELISA试剂盒(批号分别为ml063052、ml093018、ml093036)均购自上海酶联生物科技有限公司,TUNEL凋亡检测试剂盒(批号:T2190)购自上海碧云天生物科技有限公司,SDS和鼠抗β-actin(批号:A5441)均购自美国Sigma公司,蛋白提取试剂盒、ECL显色试剂盒和二喹啉甲酸蛋白定量试剂盒(批号分别为ZLI-9018、36208ES60、K812)均购自北京中山金桥生物科技有限公司;RHOA、ROCK1、Caspase-3、磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)、磷酸化PI3K(phosphorylated PI3K,p-PI3K)、蛋白激酶B(protein kinase B,AKT)、磷酸化AKT(phosphorylated AKT,p-AKT)和缺氧诱导因子1ɑ(hypoxia-inducible factor 1ɑ,HIF-1ɑ)一抗,以及辣根过氧化物酶标记的羊抗鼠IgG和羊抗兔IgG二抗(批号分别为ab54835、ab97592、ab179517、ab32089、ab278545、ab38449、ab8805、ab51608、ab205719、ab6721)均购自美国Abcam公司。TONO-PEN AVIA®型笔式眼压计购自美国Mentor公司,Stat Fax-2100酶标仪购自美国Awareness公司,尼康SMZ745光学显微镜购自上海普赫生物科技有限公司,XSP-63B型荧光显微镜购自上海光学仪器厂,ChemiDoc MP全能型蛋白凝胶成像仪购自美国Bio-Rad公司,WZY型脱水机、ABM-6型包埋机、HS-3315型石蜡切片机和XK-1型染色机均购自湖北惠达仪器有限公司。
1.2 实验方法
1.2.1 慢性青光眼大鼠模型的建立及分组:(1)采用上巩膜静脉烙闭法建立慢性青光眼大鼠模型[6]。通过腹腔注射10%水合氯醛(300 mg/kg)全身麻醉100只大鼠,用0.5%盐酸丙美卡因滴眼液进行右眼角结膜表面麻醉,在颞上、颞下和鼻上位置沿角膜边缘剪开相应的球结膜并慢慢分开眼肌和筋膜,暴露出3支上巩膜静脉,以眼科手术止血器进行烙闭,即可见近端静脉充血怒张,远端静脉发白,整复球结膜,用红霉素眼膏涂眼,待大鼠苏醒后放回笼中,每天涂红霉素眼膏,2次/d,连续6 d。在手术10 d后大鼠平均眼压维持在22 mmHg(1 mmHg=0.133 KPa)以上即为造模成功,本实验100只大鼠中有80只造模成功。(2)使用随机数字表法,将造模成功的80只大鼠分为模型组、LBP组、水仙环素组和LBP+水仙环素组,每组20只,另取20只大鼠作为假手术组,按上述方法麻醉大鼠后进行手术,但术中仅暴露上巩膜静脉,不进行烙闭。造模成功后,给予模型组和假手术组大鼠灌胃蒸馏水,给予LBP组大鼠灌胃 LBP(200 mg/kg)[7],给予水仙环素组1 mg/kg 水仙环素灌胃,给予LBP+水仙环素组200 mg/kg LBP和1 mg/kg 水仙环素同时灌胃,均于每天同一时间灌胃1次,灌胃体积为10 mL/kg,连续灌胃8周。干预结束并进行右眼眼压测量后,采用随机数字表法,每组取10只大鼠的右眼视网膜用于观察形态及检测RGC凋亡情况,取5只大鼠的右眼视网膜用于检测SOD活性、丙二醛和一氧化氮水平;取剩余5只大鼠的右眼视网膜用于检测RHOA、ROCK1、Caspase-3、PI3K、p-PI3K、AKT、p-AKT和HIF-1ɑ蛋白表达水平。均通过注射3%戊巴比妥钠(50 mg/kg)对大鼠进行麻醉,而后实施安乐死,摘除眼球后在显微镜下剥离视网膜组织。
1.2.2 眼压测量:用TONO-PEN AVIA®笔式眼压计分别于造模前、给药前及给药8周后测量各组大鼠眼压。为避免误差,每次测量每只大鼠右眼3次,计算3次测量的平均值,测完后用稀释过的庆大霉素冲眼以免感染。
1.2.3 观察视网膜组织形态:分别取各组10只大鼠的右眼视网膜组织,用4%多聚甲醛固定,石蜡包埋,制作4 μm厚切片,HE染色后,光学显微镜下观察各组大鼠视网膜组织形态。
1.2.4 检测视网膜组织中SOD活性、丙二醛和一氧化氮水平:分别取各组5只大鼠右眼视网膜组织,加入预冷的生理盐水,4 ℃条件下,3 000 r/min离心20 min,取上清,严格按SOD、丙二醛、一氧化氮 ELISA试剂盒说明书进行操作,使用酶标仪测定各组大鼠视网膜组织中SOD、丙二醛、一氧化氮的光密度值,依据各自标准曲线,计算视网膜组织中SOD活性、丙二醛、一氧化氮水平,每组设置3个复孔。
1.2.5 检测RGC凋亡情况:取上述1.2.3各组大鼠视网膜组织切片,常规脱蜡至水,严格按照TUNEL凋亡试剂盒检测说明书进行操作,置于荧光显微镜下观察(激发波长450~500 nm,发射波长515~565 nm),每组样品随机选取5个400倍视野,在距视盘边缘100 μm范围内计数凋亡细胞,其中绿色荧光细胞为凋亡细胞。
1.2.6 检测视网膜组织中相关蛋白的表达水平:取各组剩余5只大鼠,剥离右眼视网膜,使用蛋白提取试剂盒提取视网膜组织总蛋白。使用二喹啉甲酸蛋白定量试剂盒进行蛋白定量,然后进行SDS-PAGE、湿转法转膜(400 mA,4 h)、5%脱脂奶粉封闭膜1 h,分别使用按1 ∶2 000浓度稀释后的RHOA、ROCK1、Caspase-3、PI3K、p-PI3K、AKT、p-AKT和HIF-1ɑ一抗,以及按1:1000浓度稀释后的β-actin一抗于4 ℃下孵育过夜;孵育结束后使用PBS洗膜3次,5 min/次,使用辣根过氧化物酶标记的羊抗鼠或羊抗兔IgG二抗(1 ∶5 000)在室温下孵育2 h,用ECL显色试剂盒显色,凝胶成像仪拍照,分析灰度值,以β-actin为参照计算目的蛋白相对表达量。每组设置3个复孔。
1.3 统计学分析 使用SPSS 24.0软件进行统计分析。计量数据以(x±s)表示, 采用单因素方差分析进行多组间比较,采用LSD-t检验进行两两比较。以P<0.05表示差异有统计学意义。
2 结果
2.1 不同时间点各组大鼠眼压的比较 造模前,各组大鼠的眼压差异无统计学意义(均P>0.05)。给药前,与假手术组相比,其余各组大鼠眼压升高(P<0.05)。给药8周后,与模型组相比,LBP组大鼠眼压降低,水仙环素组大鼠眼压升高(均P<0.05);与LBP组相比,LBP+水仙环素组大鼠眼压升高(P<0.05);与水仙环素组相比,LBP+水仙环素组大鼠眼压降低(P<0.05)。见表1。
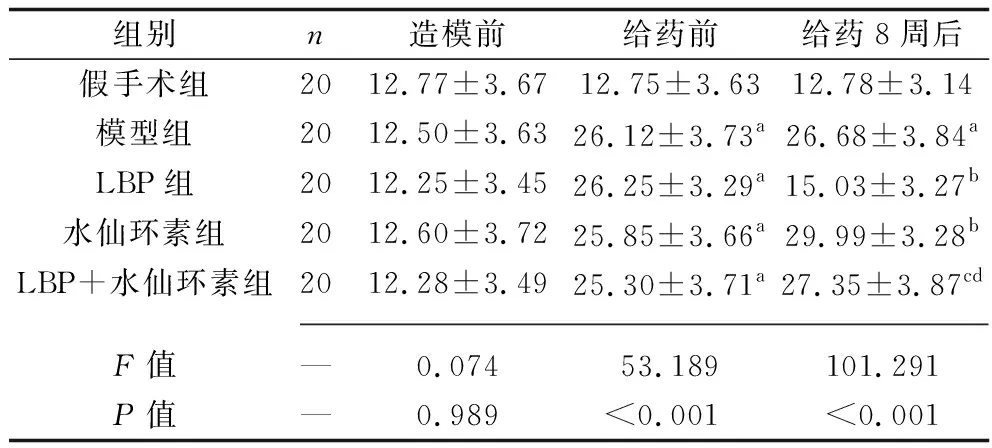
表1 不同时间点各组大鼠眼压的比较(x±s,mmHg)
2.2 各组大鼠视网膜形态的比较 假手术组大鼠视网膜组织厚,结构完整,各层细胞排列紧密。模型组大鼠视网膜组织较薄,细胞排列稀疏,膜盘间隙有空泡,RGC数量较少。与模型组相比,LBP组大鼠视网膜组织增厚,细胞排列整齐,RGC数量增多;水仙环素组大鼠视网膜组织变薄,结构紊乱,细胞排列疏松、膜盘间隙空泡增多,RGC数量减少。与LBP组相比,LBP+水仙环素组视网膜较薄,细胞排列稀疏,RGC数量减少;但与水仙环素组相比,LBP+水仙环素组视网膜增厚,结构清晰,细胞排列更密。见图1。
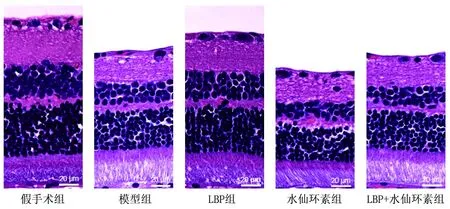
图1 各组大鼠视网膜组织形态(HE染色,×400)
2.3 各组大鼠视网膜组织中SOD活性、丙二醛和一氧化氮水平的比较 与假手术组相比,模型组大鼠视网膜组织中SOD活性降低,丙二醛和一氧化氮水平升高(均P<0.05)。与模型组相比,LBP组大鼠视网膜组织中SOD活性升高,丙二醛和一氧化氮水平降低(均P<0.05),而水仙环素组大鼠视网膜组织中SOD活性降低,丙二醛和一氧化氮水平升高(均P<0.05)。与LBP组相比,LBP+水仙环素组大鼠视网膜组织中SOD活性降低,丙二醛和一氧化氮水平升高(均P<0.05);但与水仙环素组相比,LBP+水仙环素组大鼠视网膜组织中SOD活性升高,丙二醛和一氧化氮水平降低(均P<0.05)。见表2。

表2 各组大鼠视网膜组织中SOD活性、丙二醛和一氧化氮水平的比较(x±s)
2.4 各组大鼠RGC凋亡情况的比较 与假手术组相比,模型组大鼠RGC凋亡数量增多(P<0.05)。与模型组相比,LBP组大鼠RGC凋亡数量减少,水仙环素组大鼠RGC凋亡数量增多(均P<0.05)。与LBP组相比,LBP+水仙环素组大鼠RGC凋亡数量增多(P<0.05);但与水仙环素组相比,LBP+水仙环素组大鼠RGC凋亡数量减少(P<0.05)。见图2和表3。
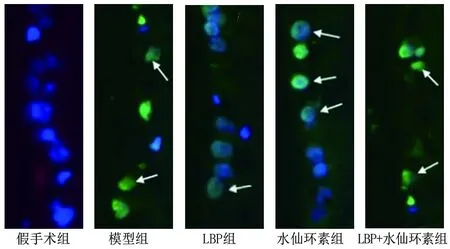
图2 各组大鼠视网膜组织RGC凋亡检测结果(TUNEL染色,×400)

表3 各组大鼠RGC凋亡数量的比较(x±s,个/100 μm)
2.5 各组大鼠视网膜组织中RHOA、ROCK1和Caspase-3蛋白表达水平的比较 与假手术组相比,模型组大鼠视网膜组织中RHOA、ROCK1和Caspase-3蛋白表达水平均升高(均P<0.05)。与模型组相比,LBP组大鼠视网膜组织中RHOA、ROCK1和Caspase-3蛋白表达水平均降低,水仙环素组大鼠视网膜组织中RHOA、ROCK1和Caspase-3蛋白表达水平均升高(均P<0.05)。与LBP组相比,LBP+水仙环素组大鼠视网膜组织中RHOA、ROCK1和Caspase-3蛋白表达水平均升高(均P<0.05);而与水仙环素组相比,LBP+水仙环素组大鼠视网膜组织中RHOA、ROCK1和Caspase-3蛋白表达水平均降低(均P<0.05)。见图3和表4。

图3 各组大鼠视网膜组织RHOA、ROCK1和Caspase-3蛋白的电泳图
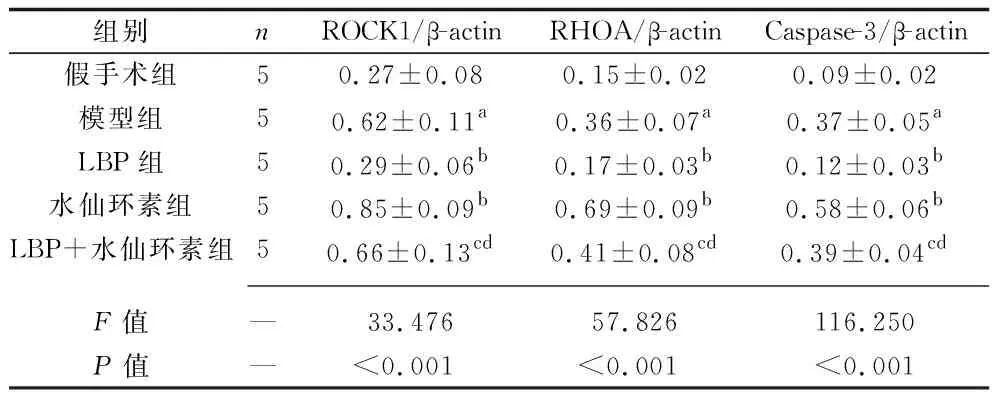
表4 各组大鼠视网膜组织RHOA、ROCK1和Caspase-3蛋白相对表达水平的比较(x±s)
2.6 各组大鼠视网膜组织中PI3K/AKT信号通路及相关因子HIF-1ɑ蛋白表达水平的比较 与假手术组相比,模型组大鼠视网膜组织中p-PI3K/PI3K比值、p-AKT/AKT比值和HIF-1ɑ蛋白表达水平均升高(均P<0.05)。与模型组相比,LBP组大鼠视网膜组织中p-PI3K/PI3K比值、p-AKT/AKT比值和HIF-1ɑ蛋白表达水平均降低(均P<0.05),水仙环素组大鼠视网膜组织中p-PI3K/PI3K比值、p-AKT/AKT比值和HIF-1ɑ蛋白表达水平升高(均P<0.05)。与LBP组相比,LBP+水仙环素组大鼠视网膜组织中p-PI3K/PI3K比值、p-AKT/AKT比值和HIF-1ɑ蛋白表达水平均升高(均P<0.05);而与水仙环素组相比,LBP+水仙环素组大鼠视网膜组织中p-PI3K/PI3K比值、p-AKT/AKT比值和HIF-1ɑ蛋白表达水平均降低(均P<0.05)。见图4和表5。

图4 各组大鼠视网膜组织中p-PI3K、PI3K、p-AKT、AKT、HIF-1ɑ蛋白的电泳图
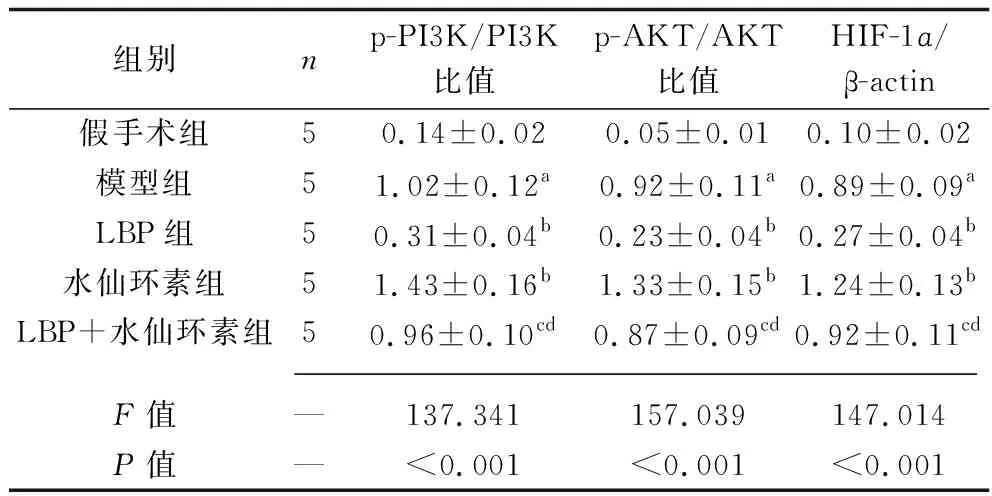
表5 各组大鼠视网膜组织p-PI3K/PI3K比值、p-AKT/AKT比值和HIF-1ɑ蛋白相对表达水平的比较(x±s)
3 讨 论
青光眼已成为继白内障之后全球第二致盲性眼病,可引起眼内压力升高,造成不可逆致盲。但目前青光眼的确切病因尚未完全清楚,其可能是由多种不同因素共同作用而引起的一种集合症候群。西医治疗在一定程度上能够降低眼压,但尚不能从根本上保护青光眼患者RGC免受损伤,因此,近年来中药在治疗青光眼中的作用越来越受重视。枸杞是我国药食两用的传统中药材,用于治疗血虚痿黄、目昏不明等病症已有2 500多年的历史,其提取物LBP含有多种活性成分,不但可以抵抗各种类型的癌细胞,而且能够保护青光眼模型大鼠的RGC免受损伤[8],对慢性高眼压模型大鼠也具有神经保护作用[9],并能提高大鼠视神经部分折断后的RGC存活率[10]。因此,深入研究其中的作用机制,可为LBP用于防治青光眼提供更多的科学依据。
已有研究表明,LBP能改善糖尿病大鼠视网膜的氧化应激状态,对RGC具有一定的保护作用[11],同时可显著提升人小梁网细胞活力,调节眼压,并能缓解小梁网细胞因抗氧化反应而引起的损伤[12]。青光眼患者的丙二醛水平显著升高,SOD活性显著降低[13],而视网膜组织中较高水平的丙二醛和一氧化氮能抑制血管调节因子,促进假性青光眼的发展[14];降低丙二醛水平并增加SOD活性,可保护青光眼动物模型的神经[15]。本研究结果表明,LBP能降低慢性青光眼大鼠眼压、视网膜组织中的丙二醛和一氧化氮水平,减少RGC凋亡,提高视网膜组织中的SOD活性,并促使视网膜组织增厚,使其结构完整清晰,使细胞排列紧密,提示LBP可减轻慢性青光眼大鼠视网膜组织的氧化应激反应,缓解视网膜损伤,对慢性青光眼具有一定的治疗作用。
RHOA信号介导了由小梁网细胞变化引起的眼压升高[16]。Liu等[17]的研究表明ROCK1活性上调不仅依赖于RHOA的表达,还依赖于Caspase-3的表达。ROCK1是Caspase-3的直接底物,在缺血再灌注时ROCK1的表达增加可提高Caspase-3的表达水平,两者的级联反应形成恶性循环,加重缺血再灌注损伤[18]。另有研究显示,RHOA/ROCK是PI3K/AKT的上游信号通路[19]。HIF-1ɑ是机体对缺氧适应性调节的重要调控蛋白,有研究显示,下调HIF-1ɑ表达,可减少小鼠RAW264.7巨噬细胞的凋亡[20]。而PI3K/AKT信号通路与细胞凋亡密切相关,AKT磷酸化可促进Caspase-3的激活,调控HIF-1ɑ活性,进而诱导细胞凋亡[21]。本研究结果显示,与假手术组比较,模型大鼠视网膜组织中RHOA、ROCK1、Caspase-3和HIF-1ɑ蛋白水平,以及p-PI3K/PI3K比值、p-AKT/AKT比值均增高,提示慢性青光眼大鼠中RHOA/ROCK1通路及其下游PI3K/AKT信号通路处于激活状态。已有研究表明,LBP不仅可通过调节Rho/ROCK信号通路保护大鼠视网膜-血屏障[22],还能通过下调视网膜神经中内皮素表达及其相关的信号通路,从而保护视神经[23]。本研究中,给予LBP处理后,慢性青光眼大鼠RGC凋亡数量减少,视网膜结构变清晰,细胞排列变紧密,RHOA、ROCK1、Caspase-3和HIF-1ɑ蛋白表达水平下调,p-PI3K/PI3K比值、p-AKT/AKT比值降低,表明LBP可通过抑制RHOA/ROCK1通路,以抑制其下游PI3K/AKT通路及HIF-1ɑ蛋白表达,从而减少RGC凋亡,缓解慢性青光眼大鼠RGC损伤。
此外,我们发现,应用LBP和RHOA激活剂水仙环素联合处理后,慢性青光眼大鼠眼压升高、视网膜组织损伤和RGC凋亡等情况均较LBP单独处理时加重,但较水仙环素单独处理时减轻;同时视网膜组织中丙二醛和一氧化氮水平、Caspase-3和HIF-1ɑ蛋白表达水平、PI3K/AKT通路活化程度较LBP单独处理时升高,但较水仙环素单独处理时降低,SOD活性较LBP单独处理时降低,但较水仙环素单独处理时升高。以上结果表明,LBP对RGC的保护效果可被RHOA激活剂水仙环素逆转,进一步揭示了LBP对慢性青光眼大鼠RGC的保护作用可能与抑制RHOA/ROCK1通路进而降低其下游PI3K/AKT通路活性有关。
综上所述,LBP可能通过抑制RHOA/ROCK1通路,以抑制下游PI3K/AKT通路和调控HIF-1ɑ水平,从而缓解视网膜氧化应激反应,减少RGC凋亡、减轻RGC损伤,并降低慢性青光眼大鼠眼压,这或可为在临床上应用LBP治疗慢性青光眼提供了理论依据。但是LBP治疗慢性青光眼的作用机制十分复杂,可能还涉及其他信号通路及相关因子,尚需后续深入研究。

