miR-155在炎症微环境下对牙周膜干细胞成骨分化的调控作用
刘煜清,龚 瑶,赵苏峰,戴 丽
牙周炎是累及牙周组织的慢性炎症性疾病,会造成牙周支持组织破坏,严重者出现牙齿松动脱落[1]。牙周膜干细胞(periodontal ligment stem cells,PDLSCs)是参与牙周组织损伤及修复的重要细胞,具有成骨分化的潜能,但在牙周炎症环境下,PDLSCs的成骨分化能力明显减弱,不利于PDLSCs发挥损伤修复的生物学功能[2-3]。miR-155是一种对干细胞成骨分化具有抑制作用的miR[4],有研究发现慢性牙周炎患者牙周膜中miR-155的表达水平明显增加[5]。本研究拟检测miR-155在炎症微环境下对PDLSCs成骨分化的调控作用,以期为临床应用提供理论依据。
1 材料与方法
1.1 试剂与仪器
肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)(Sigma,美国);阴性对照(NC)miR、miR-155抑制物、miR-155模拟物(吉玛,中国);miR提取试剂盒、miR cDNA第一链合成试剂盒、miR荧光定量检测试剂盒、RNA提取试剂盒、cDNA第一链合成试剂盒、荧光定量检测试剂盒(天根,中国);双荧光素酶报告基因试剂盒(Promega,美国);成骨诱导分化培养基(赛业生物,中国);Runx2、OCN、Col-Ⅰ、骨形态发生蛋白(bone morphogenetic protein, BMP)5、BMP10、GAPDH抗体(Abcam,英国);Ⅰ型胶原酶(Merck,德国)。
细胞培养箱(Thermo,德国);荧光定量PCR仪(ABI,美国);蛋白电泳转膜系统、凝胶成像仪(Bio-Rad,美国)。
1.2 离体牙收集
选择2020年5月—2021年5月期间因正畸需要在南京大学医学院附属口腔医院口腔颌面外科进行拔牙患者的前磨牙,均为健康牙,无根尖及牙体疾病。本研究经医院伦理委员会批准(2020(年)伦审【科】第(13)号),所有患者知情同意。
1.3 PDLSCs的培养及鉴定
刮取离体牙根中1/3的牙周膜组织,清洗后用3 g/L的Ⅰ型胶原酶37 ℃消化15 min,加入含有10%胎牛血清的培养基终止消化后1 000 r/min离心10 min,弃去上清液,用含有10%胎牛血清的培养基重悬并接种在培养皿内,待从组织块中爬出的细胞密度达90%后,用0.25%胰蛋白酶消化并传代继续培养,选取第3代PDLSCs用于实验。流式细胞仪检测细胞表面CD44及CD90的阳性表达情况。将细胞液滴加至载玻片上,按照各染色试剂盒说明书方法分别滴加茜素红、油红O、阿尔辛蓝染色液进行染色处理,随后封片,置于显微镜下观察。茜素红染色、油红O染色、阿尔辛蓝染色分别检测PDLSCs的成骨、成脂、成软骨能力。
1.4 PDLSCs分组
将PDLSCs按照不同处理方法进行分组。①对照组:用空白培养基处理;②TNF-α组[6]:用含有10 μg/L TNF-α的培养基处理;③miR-NC组:转染NC miR;④TNF-α+miR-NC组:用含有10 μg/L TNF-α的培养基处理,同时转染NC miR;⑤TNF-α+miR-155抑制物组:用含有10 μg/L TNF-α的培养基处理,同时转染miR-155抑制物;⑥miR-155组:转染miR-155模拟物。每组设置5个复孔,各组处理24 h。
1.5 qRT-PCR检测
对照组和TNF-α组处理后24 h后,采用miR提取试剂盒提取细胞miR,miR cDNA第一链合成试剂盒将miR反转录为cDNA,利用miR荧光定量检测试剂盒对cDNA中的miR-155及U6进行PCR扩增,根据扩增曲线计算miR-155的表达水平。
各组细胞干预24 h后,RNA提取试剂盒提取细胞RNA,采用cDNA第一链合成试剂盒将RNA反转录为cDNA,利用荧光定量检测试剂盒对cDNA中的 Runx2、OCN、Col-Ⅰ、BMP5、BMP10及β-actin进行PCR扩增,根据扩增曲线计算Runx2、OCN、Col-Ⅰ、BMP5、BMP10的mRNA相对表达水平,引物序列见表1。

表1 qRT-PCR引物序列Tab.1 qRT-PCR primer sequence
1.6 Western blot检测
使用RIPA裂解缓冲液提取各组细胞总蛋白,将等量的蛋白质进行电泳、转膜、封闭后,将膜与一抗Runx2、OCN、Col-Ⅰ、BMP5、BMP10、GAPDH(1∶2 000)在4 ℃过夜孵育。用TBST缓冲液洗涤后,与HRP标记的山羊抗兔二抗(Abcam, 英国)(1∶1 500)在室温下孵育1 h。使用ChemiDoc成像系统对蛋白质进行可视化分析。
1.7 茜素红染色及定量分析
各组PDLSCs在成骨诱导分化培养基中诱导2周后,将其在4%多聚甲醛中固定30 min,室温下与茜素红染色溶液一起避光孵育30 min后,用PBS洗涤细胞以终止反应。使用显微镜观察钙化结节形成情况。茜素红染色后,用10%十六烷基吡啶溶液溶解钙结节并在37 ℃下孵育30 min。然后,将上清液转移至96孔板中,测定590 nm处的光密度用于茜素红定量分析。
1.8 双荧光素酶报告基因实验
starbase网站预测miR-155与BMP5、BMP10的结合位点,miR-NC组及miR-155组PDLSCs同时转染BMP5或BMP10的双荧光素酶报告基因,24 h后检测报告基因的海肾荧光值、萤火虫荧光值,将萤火虫荧光值/海肾荧光值作为报告基因的荧光值。
1.9 统计学方法
采用SPSS 22.0软件录入数据,计量资料以均数±标准差表示,2组间比较采用独立样本t检验,3组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 PDLSCs的鉴定
流式细胞仪检测细胞表面CD44及CD90的阳性表达率均超过99%,符合干细胞特性(图1)。茜素红染色显示,成骨诱导2周后,PDLSCs细胞间可见大量橘红色的矿化结节;油红O染色显示,成骨诱导3周后,PDLSCs细胞质中有较多的脂滴形成;阿尔辛蓝染色显示,成软骨诱导5周后,有较多的软骨细胞团形成,阿尔辛蓝染色阳性,以上结果表明PDLSCs具有多向分化潜能(图2)。

图1 流式细胞仪检测细胞CD44、CD90阳性表达情况Fig.1 Positive expression of CD44 and CD90 detected by flow cytometry

图2 PDLSCs的鉴定( ×200)Fig.2 Identification of PDLSCs( ×200)
2.2 炎症微环境下PDLSCs中各项指标变化
与对照组比较,TNF-α组PDLSCs中miR-155的表达水平明显升高,Runx2、OCN、Col-Ⅰ的mRNA和蛋白相对表达量以及钙结节形成量降低,差异有统计学意义(P<0.05)(表2~3、图3~4)。

表2 炎症微环境下miR-155及成骨标志基因mRNA相对表达水平的比较Tab.2 Comparison between relative expression levels of miR-155 and osteogenic marker gene mRNA in inflammatory microenvironment
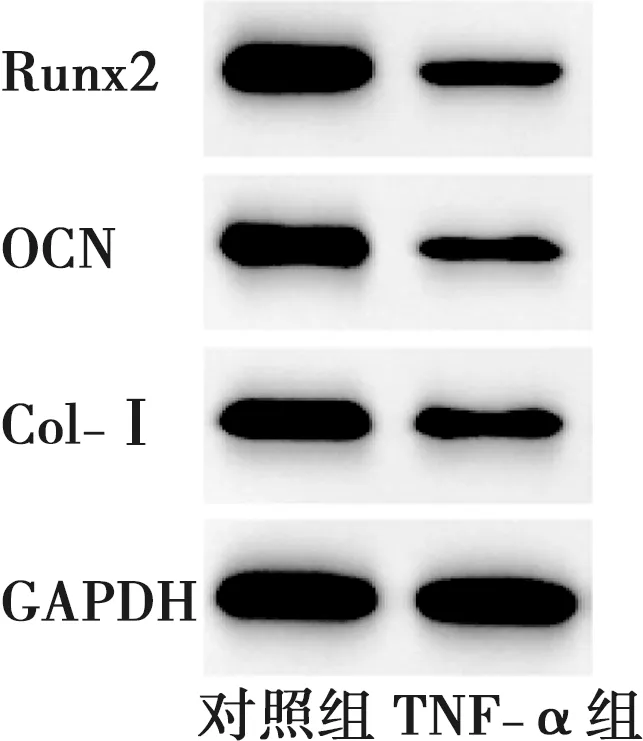
图3 炎症微环境下PDLSCs Runx2、OCN、Col-Ⅰ蛋白表达Fig.3 Expression of Runx2, OCN and Col-Ⅰ proteins in PDLSCs under inflammatory environment
2.3 转染miR-155抑制物对炎症微环境下PDLSCs中miR-155表达的影响
TNF-α+miR-NC组PDLSCs中miR-155的表达水平高于miR-NC组及TNF-α+miR-155抑制物组,差异有统计学意义(P<0.05)(表4)。
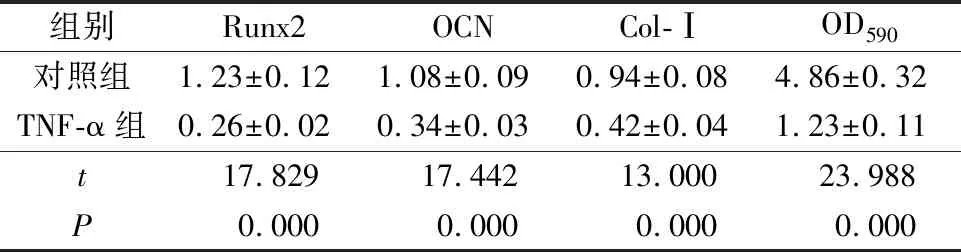
表3 炎症微环境下PDLSCs中成骨标志基因蛋白相对表达量及茜素红定量分析Tab.3 Relative expression of osteogenic marker gene protein and quantitative analysis of alizarin red in PDLSCs under inflammatory environment

图4 炎症微环境下PDLSCs的钙化结节形成结果( ×200)Fig.4 Results of calcified nodule formation of PDLSCs in inflammatory microenvironment( ×200)

表4 转染miR-155抑制物后炎症微环境下PDLSCs中miR-155表达水平Tab.4 Expression level of miR-155 in PDLSCs in inflammatory microenvironment after transfection of miR-155 inhibitor
2.4 敲低miR-155对炎症微环境下PDLSCs中成骨标志基因表达及钙结节形成的影响
与miR-NC组、TNF-α+miR-155抑制物组相比,TNF-α+miR-NC组PDLSCs中Runx2、OCN、Col-Ⅰ的mRNA和蛋白相对表达量及钙结节形成量明显降低(P<0.05)(表5~6、图5~6)。

表5 敲低miR-155后炎症微环境下PDLSCs中成骨标志基因mRNA相对表达水平的比较Tab.5 Comparison of mRNA expression levels of osteogenic marker genes in PDLSCs in inflammatory microenvironment after miR-155 knockdown
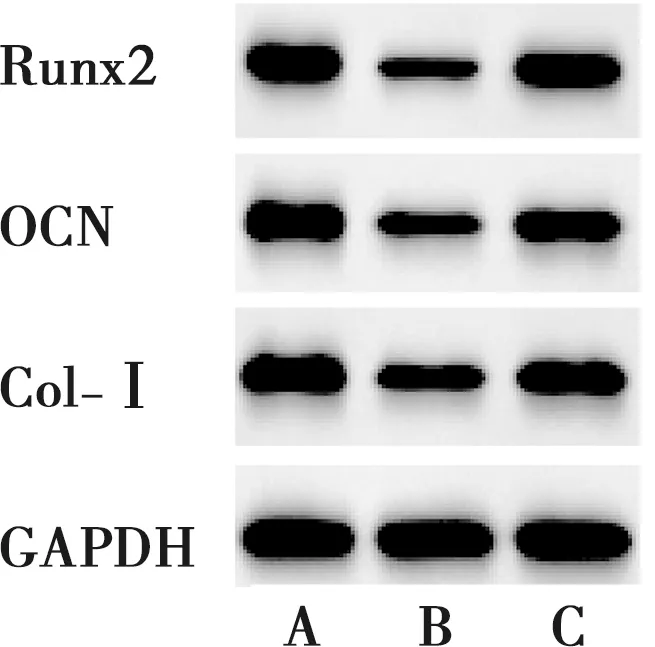
A:miR-NC组;B:TNF-α+miR-NC组;C:TNF-α+miR-155抑制物组
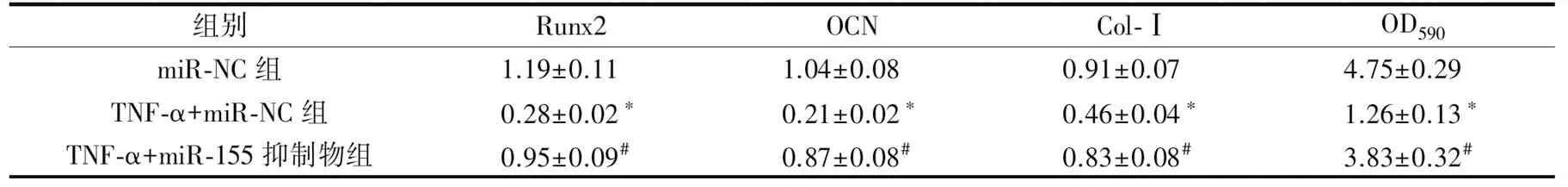
表6 敲低miR-155后各组PDLSCs中成骨标志基因蛋白相对表达量及茜素红定量分析比较Tab.6 Comparison of relative expression of osteogenic marker gene protein and alizarin red quantitative analysis in PDLSCs of each group after miR-155 knockdown

图6 敲低miR-155对炎症微环境下PDLSCs中钙结节形成的影响( ×200)Fig.6 Effect of miR-155 knockdown on calcium nodule formation in PDLSCs in inflammatory microenvironment ( ×200)
2.5 miR-155靶向BMP5、BMP10的验证
starbase网站预测miR-155与BMP5、BMP10的结合位点(图7)。miR-155组PDLSCs中BMP5、BMP10的mRNA和蛋白相对表达量及BMP5、BMP10报告基因的荧光值均明显低于miR-NC组(P<0.05)(图8、表7)。

图7 starbase网站预测miR-155与BMP5、BMP10的结合位点Fig.7 Starbase website predicts the binding sites of miR-155 with BMP5 and BMP10

图8 BMP5、BMP10蛋白表达Fig.8 Expression of BMP5 and BMP10 proteins
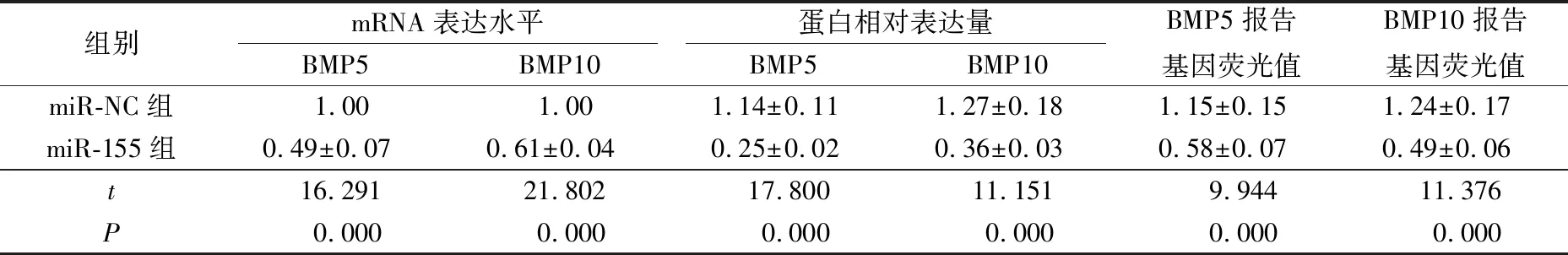
表7 PDLSCs中BMP5、BMP10mRNA和蛋白表达水平及报告基因荧光值Tab.7 Expression levels of BMP5, BMP10mRNA and protein and fluorescence value of reporter gene in two groups of PDLSCs
2.6 敲低miR-155对炎症微环境下PDLSCs中BMP5、BMP10 mRNA和蛋白表达的影响
TNF-α+miR-NC组PDLSCs中BMP5、BMP10 mRNA和蛋白相对表达量明显低于miR-NC组和TNF-α+miR-155抑制物组(P<0.05)(图9、表8)。
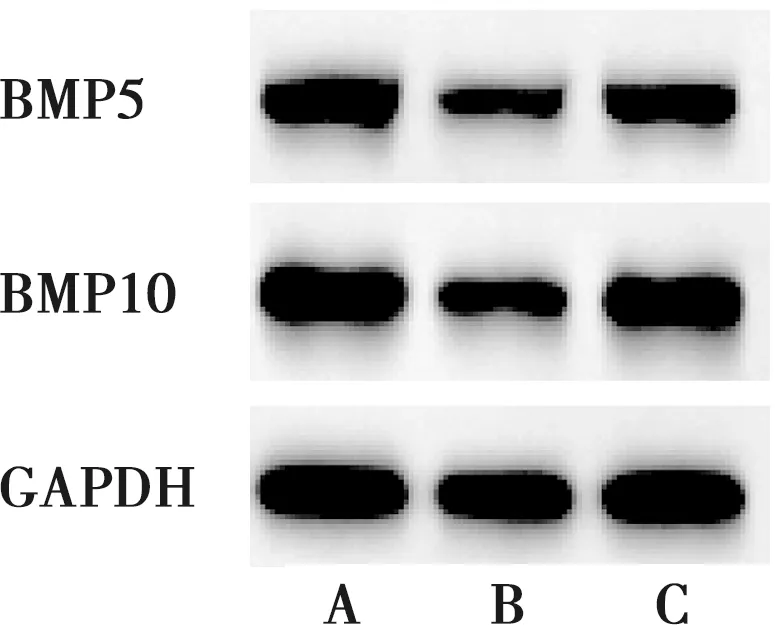
A:miR-NC组;B:TNF-α+miR-NC组;C:TNF-α+miR-155抑制物组
3 讨 论
随着组织工程技术的发展,PDLSCs等干细胞在牙周组织修复中的价值受到越来越多关注[7-8]。PDLSCs向成骨细胞分化后参与牙槽骨重建,可促进牙周组织再生修复。但近年来相关研究显示,牙周炎来源的PDLSCs成骨分化能力减弱,健康PDLSCs在TNF-α诱导的炎症微环境下成骨分化能力也明显减弱[9-10],提示炎症对PDLSCs的成骨分化具有抑制作用。因此,探究相关分子机制对于牙周炎治疗具有重要的意义。
已知有多种miRs参与干细胞成骨分化的调控,miR-155是一种能促进牙周炎发展的miRNA[5],有研究显示过表达miR-155能够抑制人主动脉血管平滑肌细胞成骨分化,而下调miR-155能够促进人骨髓间充质干细胞成骨分化[11-13]。此外,在多项牙周炎相关的研究中,炎症对牙周组织中miR-155的表达具有促进作用[5,14]。本研究利用TNF-α诱导炎症微环境后发现PDLSCs中miR-155的表达水平也明显增加。以上结果提示miR-155表达增加可能是PDLSCs在炎症微环境下成骨分化能力减弱的分子机制。
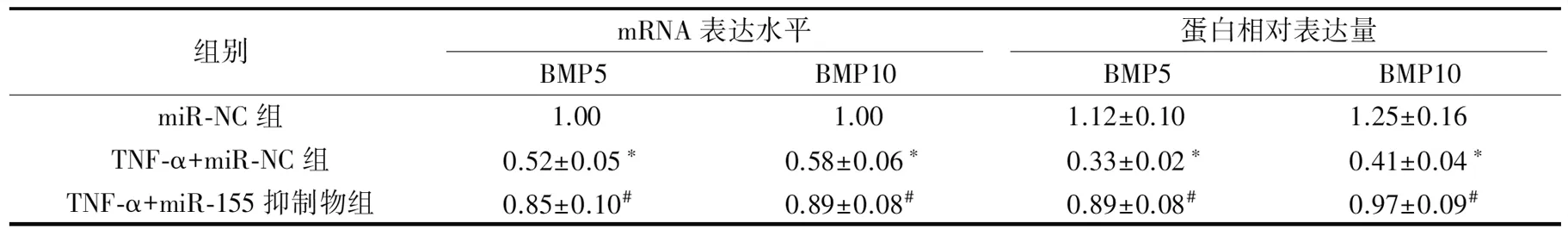
表8 敲低miR-155后炎症微环境下PDLSCs中BMP5、BMP10 mRNA和蛋白相对表达量Tab.8 Relative expression of BMP5 and BMP10 mRNA and protein in PDLSCs under inflammatory microenvironment after miR-155 knockdown
Runx2、OCN、Col-Ⅰ在成骨过程中发挥重要作用,是反映成骨分化的标志基因。Runx2直接调控成骨过程,通过调节细胞周期,加速细胞分化;OCN和Col-Ⅰ分别是成骨分化过程中产生的主要非胶原成分和胶原成分[15-16]。本研究结果显示:在炎症微环境下PDLSCs中Runx2、OCN、Col-Ⅰ的mRNA和蛋白表达水平以及钙化结节形成量降低,表明炎症抑制PDLSCs的成骨分化,与既往研究的报道一致[9-10]。在炎症微环境下敲低miR-155后,PDLSCs中Runx2、OCN、Col-Ⅰ的mRNA和蛋白表达水平以及钙化结节形成量增加,表明miR-155在炎症微环境下抑制成骨分化,敲低miR-155后PDLSCs的成骨分化能力增强。
miR的生物学作用是在转录后水平对基因表达进行负调控,通过前期的生物信息学分析,BMP5和BMP10基因含有miR-155的靶向调控位点。据报道,BMP可与骨形态发生蛋白受体结合激活BMP信号通路,促进成骨相关因子的表达,进而促进成骨分化,BMP5和BMP10作为BMP信号通路上的成员,对牙周疾病的进展具有调控作用,可加速骨细胞生成,改善牙齿缺损,修复损伤[17]。因此本研究选择BMP5和BMP10基因为miR-155靶向位点进行分析。已有研究报道,BMP5和BMP10参与干细胞的成骨分化,对骨髓间充质干细胞、PDLSCs等多种干细胞的成骨分化具有促进作用[18-19]。本研究进一步证实miR-155模拟物可通过靶向调控BMP5和BMP10,显著降低PDLSCs中BMP5和BMP10的mRNA、蛋白表达及报告基因的荧光值,表明miR-155直接靶向调控BMP5和BMP10,影响PDLSCs成骨分化。本实验在炎症微环境下PDLSCs中检测到BMP5和BMP10的mRNA和蛋白表达水平降低;在炎症微环境下敲低miR-155后,PDLSCs中到BMP5和BMP10的mRNA和蛋白表达水平增加,表明靶向BMP5和BMP10是miR-155在炎症微环境下调控PDLSCs成骨分化的可能分子机制。
综上所述,炎症微环境下PDLSCs中miR-155表达增加,敲低miR-155促进炎症微环境下PDLSCs成骨分化,靶向BMP5及BMP10是相关的分子机制。

