散养和圈养撒坝猪粪菌移植对小鼠脂肪沉积和粪便微生物区系的影响
胡天念 程燕东* 殷桦娟 茶光辉 王 璞 潘 琼 叶朋飞 林秋叶 曹振辉**
(1.云南农业大学动物科学技术学院,昆明650201;2.云南农业大学食品科学技术学院,昆明650201)
哺乳动物肠道中栖息着数量庞大、种类繁多的细菌、真菌、古菌和病毒等微生物,其中绝大多数是细菌。据统计,人类肠道中细菌数量是细胞数量的10倍以上,约为1014个、500~1 000种[1-2]。稳定、健康的微生物区系在促进营养物质的消化吸收、维持肠道黏膜屏障功能、促进肠黏膜免疫系统成熟、调节机体代谢以及维持机体健康方面发挥重要作用[3-4]。
粪菌移植(fecal microbiota transplantation,FMT)是指将健康动物粪便中的功能性微生物移植至病患受体,以修复肠道菌群失调的状态,达到重塑受体肠道菌群的目的。在我国,FMT技术治疗疾病的历史悠久,《肘后备急方》记载“饮粪汁一升,即活”,即用人的粪清治疗食物中毒、腹泻、发热并濒临死亡的患者[5];《本草纲目》中用“黄龙汤”(人粪)治疗严重腹泻和食物中毒[6]。近年来,美国学者将粪菌液移入患者体内,成功治愈了难辨梭状芽孢杆菌的感染[7-8],并将FMT技术写入美国复发性艰难梭菌感染的治疗指南[9]。目前,FMT多被用于治疗复发性艰难梭状芽孢杆菌感染(Clostridioidesdifficileinfection,CDI)[10]、炎症性肠病(inflammatory bowel disease,IBD)[11]和肠易激综合征(irritable bowel syndrome,IBS)[12]等肠道疾病。
近年来,FMT在调控猪肠道微生态方面也开展了相关研究,将猪的粪菌液移植至小鼠,小鼠表现出与供体猪相似的代谢表型。Diao等[13]将藏猪、约克夏猪和荣昌猪的粪菌液移植至无菌BALB/c小鼠肠道内,小鼠小肠绒毛高度、隐窝深度,空肠蔗糖酶、麦芽糖酶和胰蛋白酶等酶活性均与供体猪一致;Yan等[14]将瘦肉型约克夏猪和肥胖的荣昌猪的粪菌液移植至无菌小鼠,结果显示,与约克夏猪受体无菌小鼠相比,荣昌猪受体无菌小鼠有着较高的体脂、慢肌纤维比例和较强的腓肠肌生脂能力;李天天等[15]将不同饲料利用效率猪的粪菌液移植至伪无菌小鼠,结果表明高饲料利用效率猪粪菌液移植的受体小鼠在采食量、日增重及饲料利用率方面均高于低饲料利用效率猪粪菌液移植的受体小鼠,小鼠重现了猪的生长性能表型。以上结果表明,小鼠可作为猪FMT的受体动物,开展猪FMT的试验研究。
云南省地处低纬高原,地形复杂,生态环境多样,孕有丰富的地方猪资源。滇南小耳猪、撒坝猪和迪庆藏猪等9种地方猪种于2011年被列入《中国畜禽遗传资源志:猪志》[16]。作为云南省优良的地方猪种,撒坝猪具有体型适中、适应性好、繁殖力高、耐粗饲、抗病力强、肉质鲜嫩及肉风味独特等优点[17]。遗传、环境以及饲粮等因素均会影响猪的肠道微生物结构,而肠道菌群的变化与宿主生长、发育、代谢和疾病发展等密切相关。本文以散养和圈养2种不同饲喂方式的撒坝猪作为供体,将其粪便菌液灌胃昆明小鼠,研究散养和圈养撒坝猪FMT对小鼠脂肪沉积和粪便微生物区系的影响,以期为微生物饲料添加剂的研发提供参考。
1 材料与方法
1.1 撒坝猪粪菌液制备
选取3月龄无病史、无抗生素服用记录的健康散养和圈养撒坝猪各10头作为FMT供体,其中散养撒坝猪主要饲喂玉米面、香蕉杆等,圈养撒坝猪饲喂全价配合饲粮。分组采集新鲜粪便,混合均匀后及时装进无菌广口瓶中,加入无菌甘油完全溶解。采用过滤、离心方法制备菌液[18],制备好的菌液加入等体积30%甘油置于-80 ℃低温保存[19]。
正式试验前,将冷冻保存的菌液在37 ℃水浴解冻后,4 ℃、3 944×g离心15 min,弃上清液,再用1/2原菌液体积的无菌生理盐水重悬沉淀即得高剂量FMT菌液,高剂量FMT菌液稀释2倍为中剂量FMT菌液、稀释4倍为低剂量FMT菌液。
1.2 试验动物及试验设计
选用30只购自昆明医科大学实验动物中心的6周龄、体重为18~22 g的健康雄性昆明小鼠作为FMT受体,随机分为5个组,每组6只。对照(CON)组灌胃生理盐水,试验组分别灌胃散养撒坝猪低剂量FMT菌液(SY-L组)、散养撒坝猪中剂量FMT菌液(SY-M组)、散养撒坝猪高剂量FMT菌液(SY-H组)和圈养撒坝猪中剂量FMT菌液(JY-M组),连续灌胃14 d,每天1次,每次200 μL。试验期为28 d。
饲养试验在云南省动物营养与饲料重点实验室进行,饲养环境温度维持在23~26 ℃,相对湿度为50%~70%,昼夜循环设定为各12 h。小鼠自由采食、饮水,饮用水为经高温高压灭菌处理的自来水,饲粮为无抗颗粒饲料(饲粮组成及营养水平见表1)。每日观察小鼠的饮水量、采食量、粪便形状、活动及精神状态。

表1 饲粮组成及营养水平(风干基础)
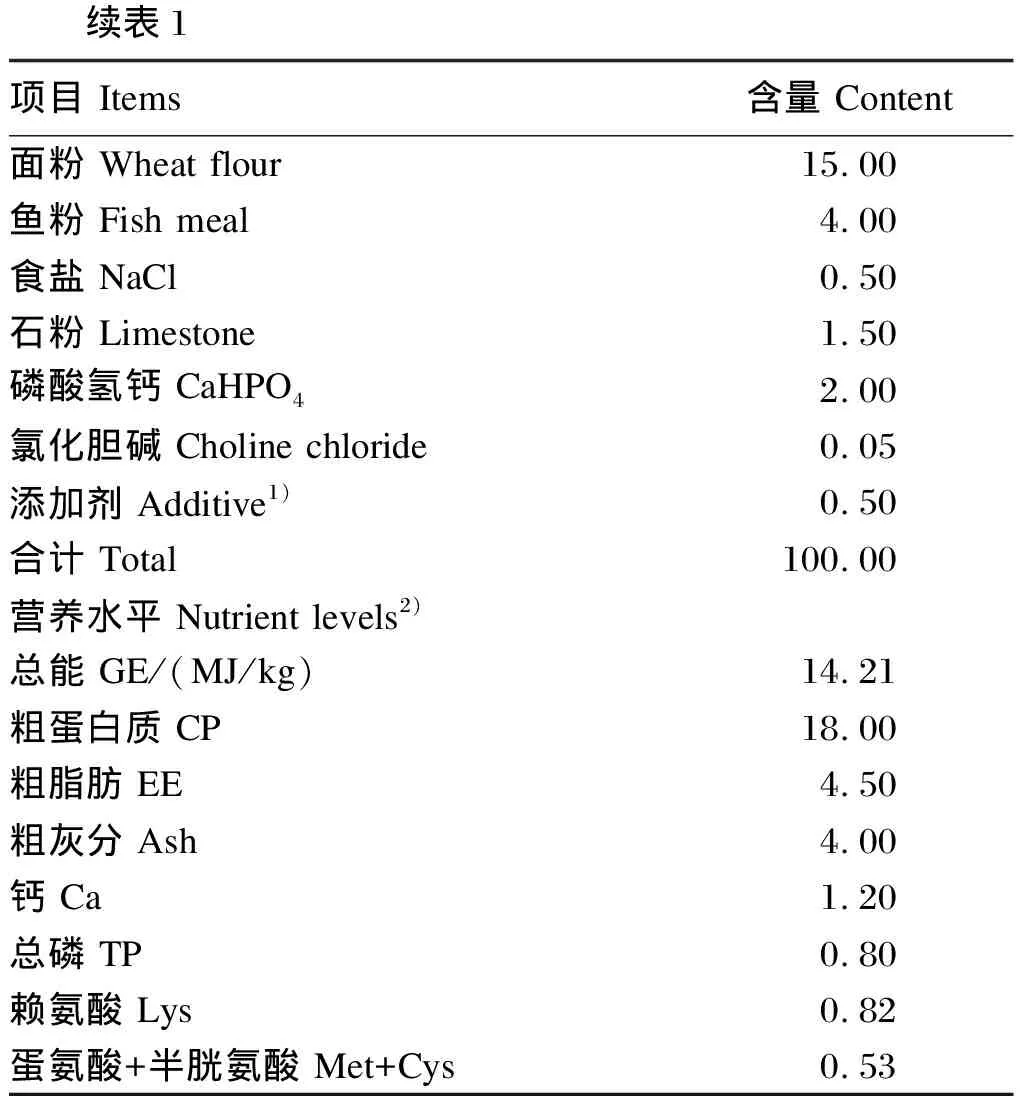
1 Items Content Wheat flour15.00 Fish meal4.00 NaCl0.50 Limestone1.50 CaHPO42.00 Choline chloride0.05 Additive1)0.50 Total100.00 Nutrient levels2) GE/(MJ/kg)14.21 CP18.00 EE4.50 Ash4.00 Ca1.20 TP0.80 Lys0.82+ Met+Cys0.53
1.3 样品采集
试验结束前1天在无菌环境下收集每只小鼠粪便3~5粒(约0.2 g)于无菌冻存管中,用于16S rDNA高通量测序。试验结束当天,称量每组小鼠体重,计算平均日增重(ADG),并根据采食量计算料重比(F/G);采用颈椎脱臼法处死小鼠并取附睾脂肪、腹股沟脂肪称重,计算脂肪指数。计算公式如下:
ADG(g/d)=总增重/试验天数;
平均日采食量(ADFI,g/d)=总耗料量/试验天数;
F/G=ADFI/ADG;
脂肪指数(%)=100×(脂肪重量/活体重)。
1.4 高通量测序分析和生物信息学分析
采用深圳华大基因股份有限公司提供的DNA提取试剂盒提取粪便基因组DNA,用引物对341F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rDNA基因的V3~V4区进行PCR扩增,PCR反应条件和混合体系参照Zhang等[20]。
采用Illumina HiSeq PE300高通量测序平台(武汉华大基因科技有限公司)对所有小鼠粪便样品进行16S rDNA测序分析。大致流程为:处理原始的测序数据,获得Clean Data[21],利用USEARCH软件将相似度在97%以上的tags聚类为一个操作分类单元(OTU)[22]。使用usearch_global方法[23]将所有tags比对回OTU代表序列,得到每个样品OTU的丰度统计表。得到OTU代表序列后,通过RDP Classifier软件(v2.2)将OTU代表序列与数据库比对进行物种注释,置信度阈值设置为0.8,并分别在界、门、纲、目、科、属和种水平统计菌群结构组成。通过GraphPad Prism 8.0软件计算差异微生物与脂肪指数之间的Spearman相关系数,并绘制相关性热图。
1.5 数据统计分析
采用SPSS 25.0软件对数据进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行多重比较,试验结果以“平均值±标准差”表示,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 FMT对小鼠生长性能的影响
由表2可知,与CON组相比,各试验组小鼠平均日增重均有所提高、料重比均有所降低,其中SY-L组和SY-M组差异显著(P<0.05);各试验组小鼠末重均有所提高,其中SY-M组差异显著(P<0.05)。与JY-M组相比,SY-M组小鼠平均日增重显著提高(P<0.05),料重比显著降低(P<0.05)。
2.2 FMT对小鼠脂肪沉积的影响
由表3可知,与CON组相比,各试验组小鼠附睾脂肪指数、腹股沟脂肪指数和总脂肪指数均有所降低,其中SY-M组附睾脂肪指数以及各试验组腹股沟脂肪指数和总脂肪指数均差异显著(P<0.05);与JY-M组相比,SY-M组小鼠附睾脂肪指数、腹股沟脂肪指数和总脂肪指数分别降低了12.32%、10.61%和11.76%(P>0.05)。
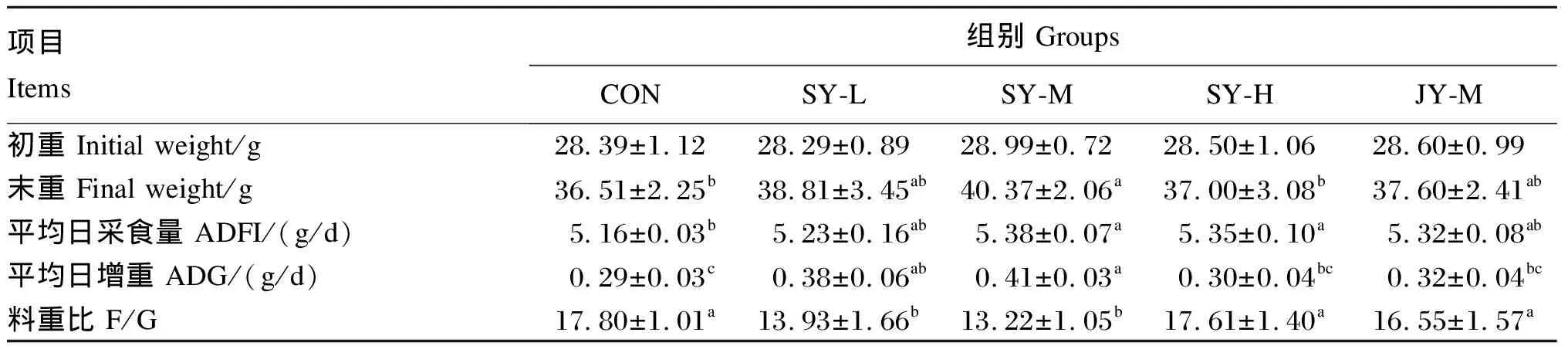
表2 FMT对小鼠生长性能的影响
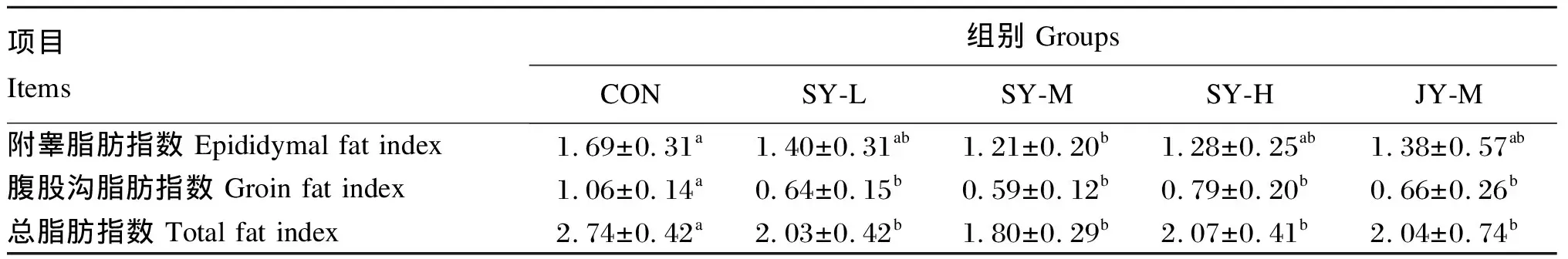
表3 FMT对小鼠脂肪沉积的影响
2.3 FMT对小鼠粪便微生物区系的影响
2.3.1 稀释曲线
以97%相似度对样本进行OTU分类构建稀释曲线,当曲线趋于平缓时,说明测序数据量合理,此时数据量的增加只会产生少量新的OTU;反之,则表明继续测序还会产生更多的新的OTU。从图1可以看出,本试验所有样本的稀释曲线均趋于平缓,表明测序数据量基本合理,高通量测序结果能够有效反映出试验中所有样本菌群结构的均匀度和丰富度。
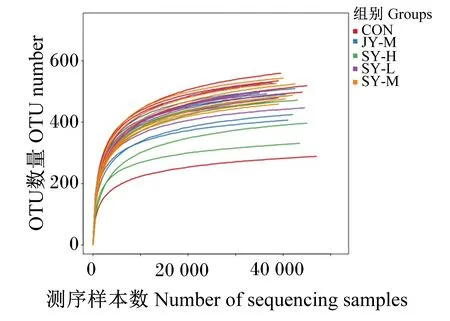
图1 稀释曲线
2.3.2 alpha多样性分析
alpha多样性分析结果见表4,与CON组相比,SY-L组、SY-M组和JY-M组小鼠粪便菌群OTU数量有所增加(P>0.05),SY-L组和SY-M组Ace指数均有所提高(P>0.05),各试验组Simpson指数均有所降低(P>0.05),SY-H组和JY-M组Chao1指数显著降低(P<0.05);与JY-M组相比,SY-M组小鼠粪便菌群OTU数量、Chao1指数和Ace指数均有所提高(P>0.05)。
2.3.3 OTU韦恩(Venn)图分析
韦恩图可以展示多个样品共有和特有的OTU数量,可直观地展示样品间OTU数量的重叠情况。由图2可知,各组共有561个OTU,CON组特有7个OTU,SY-L组特有8个OTU,SY-M组特有7个OTU,SY-H组无特有OTU,JY-M组特有3个OTU;与JY-M组相比,SY-M组特有OTU数量为59个,明显高于JY-M组相对于SY-M组的44个。
2.3.4 OTU偏最小二乘判别分析(partial least squares discrimination analysis,PLS-DA)
PLS-DA是一种用于判别分析的多变量统计分析方法,常用于来判断研究对象如何分类,比较各组样品之间的差异性,PLS-DA结果中各组别之间间距越大,组间差异越大。由图3可知,CON组与SY-L组和SY-M组完全分离,与SY-H组和JY-M组大部分分离;SY-L组、SY-M组和SY-H组与JY-M组完全分离;SY-M组与SY-L组和SY-H组完全分离。以上结果表明,粪菌液、粪菌液来源以及粪菌液剂量的不同均可能导致组间菌群结构产生差异。
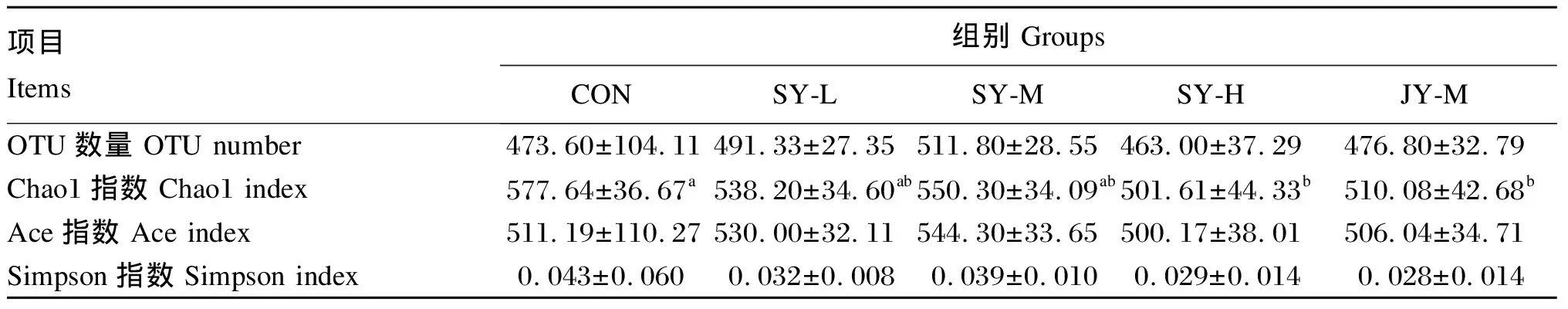
表4 alpha多样性分析
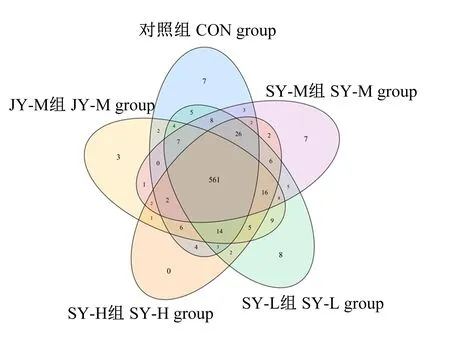
图2 OTU韦恩图
2.3.5 小鼠粪便菌群结构
由图4可知,各组小鼠粪便菌群在门水平上均以厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为主。由表5可知,与CON组相比,各试验组小鼠粪便菌群中厚壁菌门的相对丰度均降低,其中SY-L组、SY-M组和JY-M组差异显著(P<0.05);SY-L组、SY-M组和JY-M组拟杆菌门相对丰度均升高,其中SY-L组和JY-M组差异显著(P<0.05);各散养试验组变形菌门(Proteobacteria)相对丰度均升高,其中SY-H组差异显著(P<0.05);各试验组厚壁菌门/拟杆菌门值均降低(P>0.05)。与JY-M组相比,SY-M组小鼠粪便菌群中厚壁菌门、拟杆菌门和变形菌门相对丰度以及厚壁菌门/拟杆菌门值差异均不显著(P>0.05)。

图3 OTU PLS-DA图
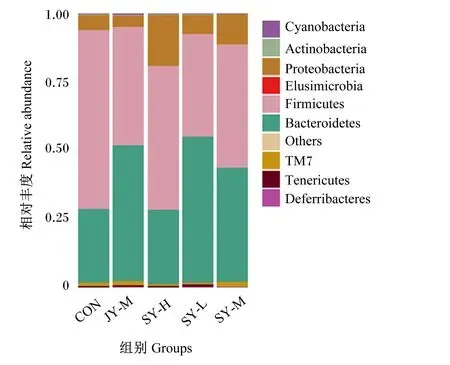
Cyanobacteria:蓝藻门;Actinobacteria:放线菌门;Proteobacteria:变形菌门;Elusimicrobia:迷踪菌门;Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Others:其他;Tenericutes:软壁菌门;Deferribacteres:脱铁杆菌门。
由图5可知,除其他(Others)菌属外,各组小鼠粪便菌群在属水平上均以螺旋杆菌属(Helicobacter)、普氏菌属(Prevotella)、乳杆菌属(Lactobacillus)和拟杆菌属(Bacteroides)等为主。由表6可知,与CON组相比,各试验组鼠粪便菌群中颤螺旋菌属(Oscillospira)相对丰度均显著降低(P<0.05);各试验组普氏菌属相对丰度均升高,其中SY-L组差异显著(P<0.05);各试验组乳杆菌属相对丰度均升高,其中SY-M组差异显著(P<0.05);SY-L组、SY-H组和JY-M组拟杆菌属相对丰度均升高,其中SY-L组差异显著(P<0.05)。与JY-M组相比,SY-M组小鼠粪便菌群中颤螺旋菌属、普氏菌属、乳杆菌属、拟杆菌属和螺旋杆菌属相对丰度均无显著差异(P>0.05)。
2.3.6 小鼠粪便菌群种水平上关键物种差异分析
选取种水平上相对丰度前10的物种,展示每组的平均相对丰度以及差异检验的显著性。由图6可知,小鼠粪便菌群中种水平上相对丰度排前10的物种有活泼瘤胃球菌(Ruminococcusgnavus)、产酸拟杆菌(Bacteroidesacidifaciens)、Butyricicoccuspullicaecorum、人体普氏菌(Prevotellacopri)、罗伊氏乳杆菌(Lactobacillusreuteri)、脱硫弧菌属_C21_c20(Desulfovibrio_C21_c20)、甲酸芽殖菌(Gemmigerformicilis)、狄氏副拟杆菌(Parabacteroidesdistasonis)、鹑梭状芽孢杆菌(Clostridiumcolinum)和产气荚膜梭状芽孢杆菌(Clostridiumperfringens)。Wilcox秩和检验结果显示,与CON组相比,各试验组罗伊氏乳杆菌相对丰度均升高,其中SY-M组差异显著(P<0.05);各试验组脱硫弧菌属_C21_c20相对丰度均显著降低(P<0.05)。与JY-M组相比,SY-M组罗伊氏乳杆菌相对丰度显著升高(P<0.05)。
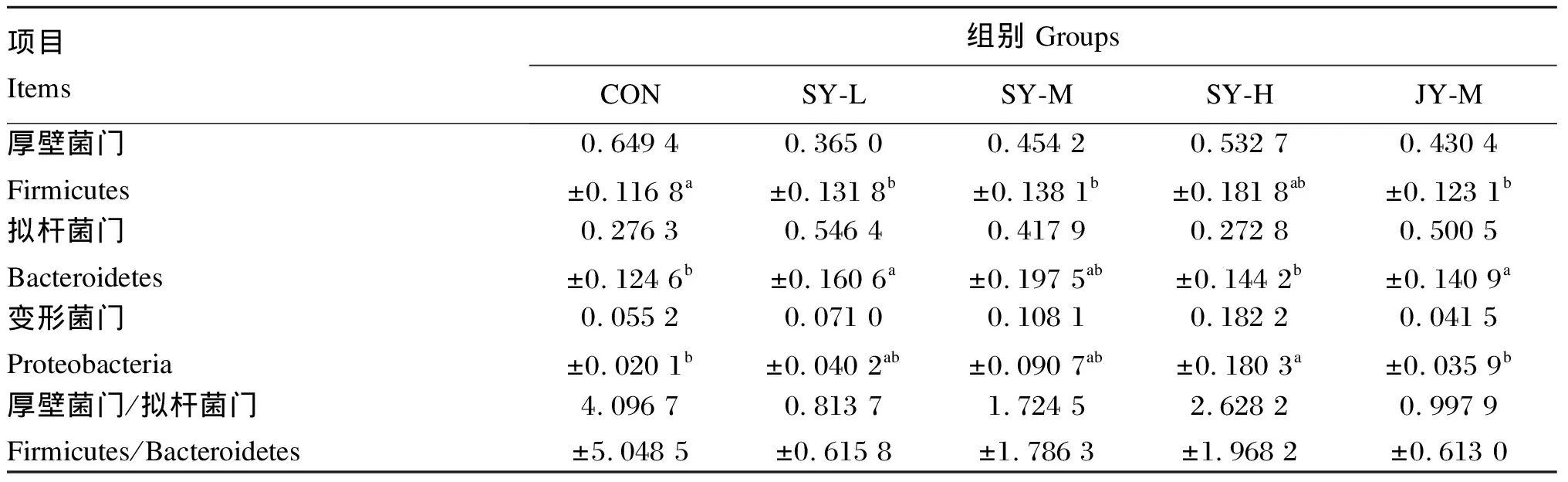
表5 小鼠粪便菌群在门水平上的相对丰度
2.4 小鼠粪便菌群差异属与小鼠脂肪指数的相关性分析
小鼠粪便菌群差异属与小鼠脂肪指数的相关性分析如图7所示,小鼠附睾脂肪指数、腹股沟脂肪指数和总脂肪指数与CON组小鼠粪便菌群中Wautersiella、罗氏菌属(Roseburia)、Adlercreutzia、颤螺旋菌属、Dehalobacterium、Anaeroplasma、粪球菌属(Coprococcus)和Odoribacter等相对丰度呈正相关;与SY-M组小鼠粪便菌群中乳杆菌属、CandidatusArthromitus、韦荣氏球菌属(Veillonella)和螺旋杆菌属相对丰度等呈负相关。
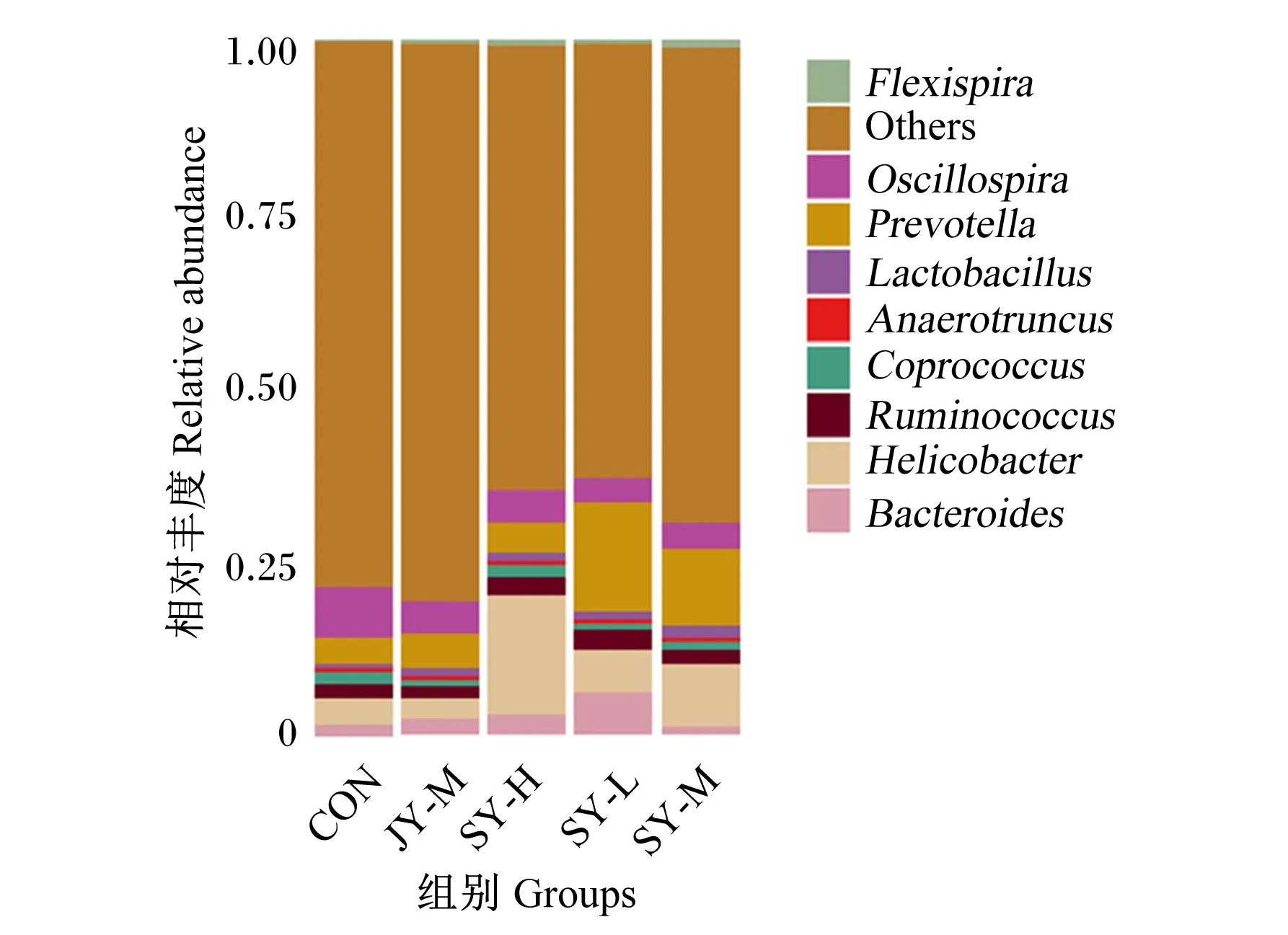
Others:其他;Oscillospira:颤螺旋菌属;Prevotella:普氏菌属;Lactobacillus:乳杆菌属;Coprococcus:粪球菌属;Ruminococcus:瘤胃球菌属;Helicobacter:螺旋杆菌属;Bacteroides:拟杆菌属。
3 讨 论
3.1 FMT对小鼠生长性能的影响

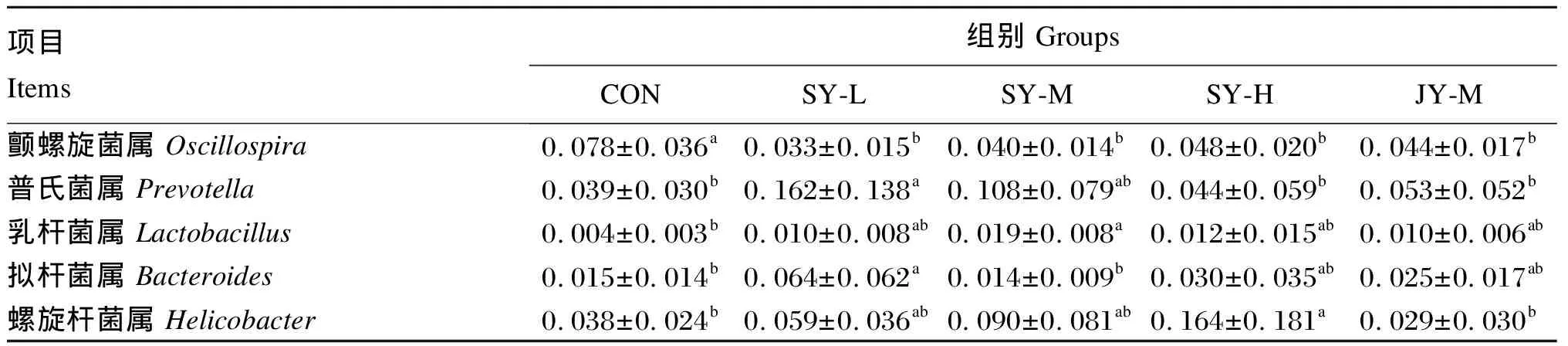
表6 小鼠粪便菌群在属水平上的相对丰度
本试验将散养和圈养撒坝猪粪菌液移植至昆明小鼠后,各试验组小鼠的平均日增重均提高、料重比均降低,表明散养和圈养撒坝猪FMT能在一定程度上提高小鼠的生长性能,这与耿世杰[28]、黄金华等[29-30]的研究结果相似。本试验中,SY-M组小鼠的平均日增重最高、料重比最低,表明SY-M组的生长性能最好。在浓度和剂量相同的情况下,SY-M组的平均日增重显著高于JY-M组、料重比显著低于JY-M组,这可能是因为散养撒坝猪所处环境的复杂性,从而提高了其FMT受体小鼠肠道菌群的多样性,肠道菌群能将机体难以利用的营养物质作为底物进行发酵,生成可以被机体直接吸收利用的物质,进而提高机体对饲粮营养物质的利用率,促进小鼠生长。
3.2 FMT对小鼠脂肪沉积的影响
动物体脂肪沉积主要与遗传背景、食物及能量的摄入和消耗有关。但也有研究证明,肠道微生物与机体脂肪之间可相互影响。Bao等[31]用高脂饲粮饲喂大鼠后,大鼠肝脏脂肪沉积明显,粪便样本中乳酸杆菌、双歧杆菌和拟杆菌的数量显著低于正常饮食组;用植物乳杆菌治疗能够显著抑制肝脏中的脂质沉积,提高粪便样本中乳酸杆菌、双歧杆菌和拟杆菌数量。Bäckhed等[32]将正常小鼠肠道中的多形拟杆菌灌胃至无菌小鼠后,无菌小鼠的总脂肪含量和附睾脂肪重量均显著增加。Ley等[33]比较了肥胖与瘦个体粪便中肠道微生物的组成,发现肥胖个体肠道中厚壁菌门丰度较高,而拟杆菌门丰度较低。有研究表明,拟杆菌和厚壁菌与体脂相关,并且拟杆菌丰度与体脂呈负相关[34]。
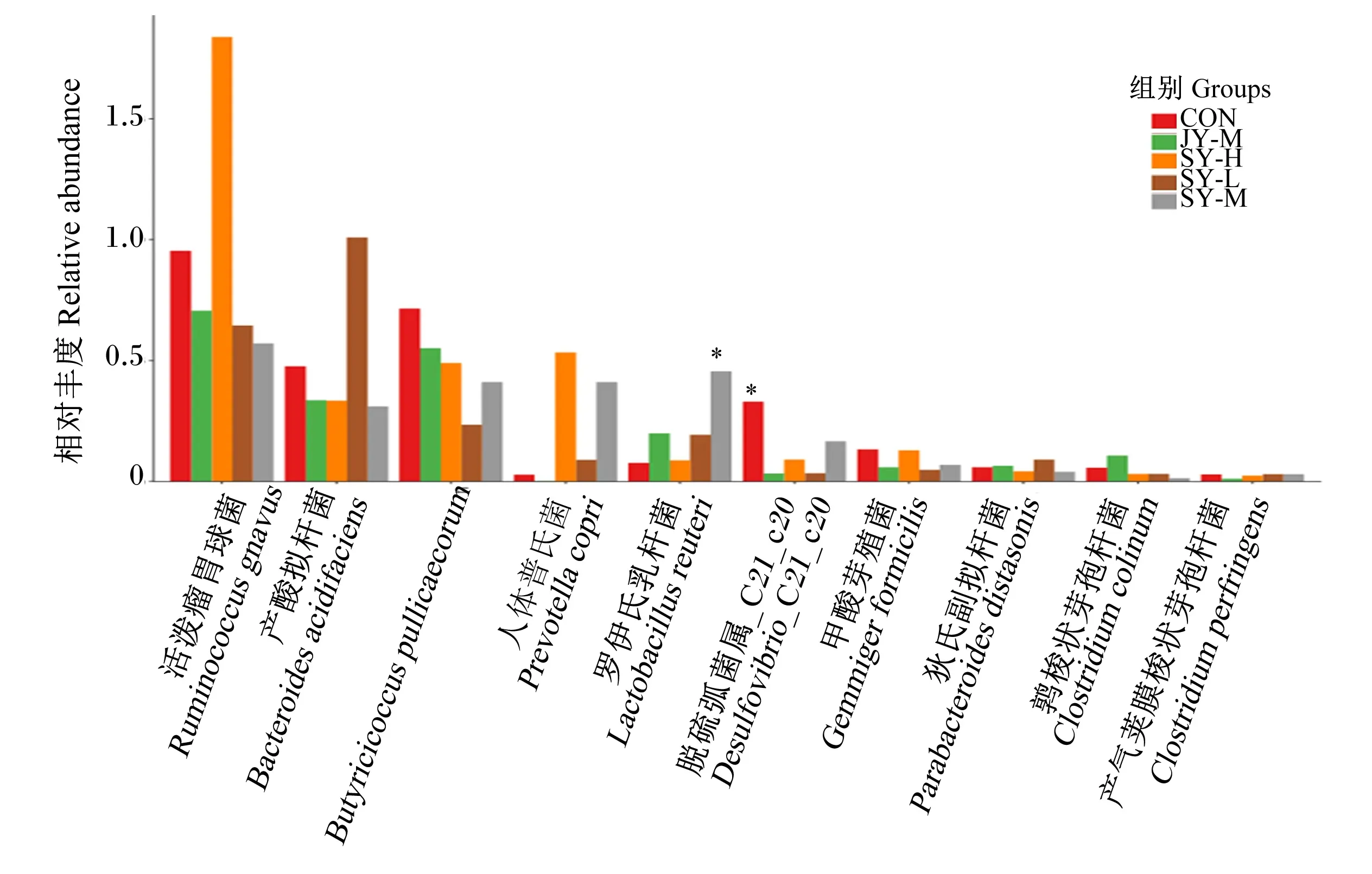
*表示与其他组存在显著差异(P<0.05)。
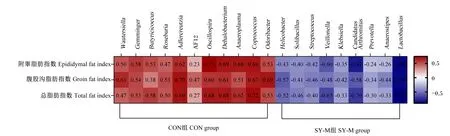
Butyricicoccus:丁酸球菌属;Roseburia:罗氏菌属;Oscillospira:颤螺旋菌属;Coprococcus:粪球菌属;Helicobacter:螺旋杆菌属;Solibacillus:土壤芽孢杆菌属;Streptococcus:链球菌属;Veillonella:韦荣氏球菌属;Klebsiella:克雷白氏杆菌属;Prevotella:普氏菌属;Lactobacillus:乳杆菌属。
本试验结果显示,与CON组相比,各试验组小鼠附睾脂肪指数、腹股沟脂肪指数和总脂肪指数均降低,且SY-M组差异显著,表明散养和圈养撒坝猪粪菌液移植能够改善肠道菌群结构,增强小鼠脂肪代谢能力,从而减少脂肪沉积,与郭上齐等[35]的研究结果相似。在粪菌液浓度和剂量相同的条件下,SY-M组小鼠各脂肪指数均低于JY-M组,表明SY-M组减少脂肪沉积的能力强于JY-M组。
3.3 FMT对小鼠粪便微生物区系的影响
猪的肠道微生物组成和丰度受品种、饲养模式以及饲粮等多种因素的影响。Diao等[13]对藏猪、约克夏猪和荣昌猪粪便进行16S rRNA高通量测序,结果显示,与约克夏猪相比,荣昌猪和藏猪厚壁菌门丰度较高,拟杆菌门丰度较低;与荣昌猪相比,藏猪拟杆菌门丰度较低;与藏猪相比,约克夏猪和荣昌猪软壁菌门丰度较高。刘瑶等[36]将健康断奶藏猪分为放牧组和舍饲组,饲养至7月龄,alpha多样性分析结果显示,放牧组藏猪的alpha多样性指数均高于舍饲组,表明放牧组藏猪肠道菌群的多样性高于舍饲组。FMT具有重塑肠道微生物菌群结构的功能,能够维护动物肠道微生态平衡。张卓等[37]将健康成年的杜长大公猪粪菌液移植至新生长荣二杂仔猪,16S rDNA测序结果显示,与对照组相比,FMT组仔猪结肠菌群中厚壁菌门的相对丰度略有降低,拟杆菌门和乳杆菌属的相对丰度略有提高。陈雪等[38]用母源粪菌液灌胃仔猪,结果显示,18日龄时仔猪粪便肠球菌属和普氏菌属的相对丰度显著提高。
撒坝猪作为云南省地方优良猪种,具有地方猪种的优良特性。本研究将散养和圈养撒坝猪粪菌液移植至小鼠体内,16S rDNA高通量分析结果表明,与CON组相比,SY-L组和SY-M组OTU数量、Ace指数均有升高趋势,SY-M组最高,且SY-M组高于JY-M组;PLS-DA结果显示,CON组和SY-L组和SY-M组完全分离,与SY-H组和JY-M组大部分分离;SY-L组和SY-H组与SY-M组完全分离;JY-M组与SY-L组、SY-M和SY-H组完全分离。门水平物种组成分析结果显示,小鼠粪便中以厚壁菌门和拟杆菌门为绝对优势菌门;与CON组相比,各试验组厚壁菌门相对丰度降低,拟杆菌门相对丰度(SY-H组除外)提高;SY-M组与JY-M组间无显著差异。本研究结果与刘瑶等[36]、张卓等[37]相似,表明FMT介导的外源微生物的植入能够增加肠道菌群的多样性,改善肠道菌群结构,而粪菌液来源及其剂量的不同可能是导致小鼠肠道菌群结构产生差异的原因,散养撒坝猪由于其生活环境和采食的复杂性,肠道菌群也相对多样丰富,从而导致其粪菌液受体的肠道菌群多样性增加。
乳酸杆菌作为一种最常见的益生菌,具有促进动物生长,调节胃肠道正常菌群,维持微生态平衡,改善胃肠道功能,抑制肠道内腐败菌生长,提高机体免疫力等作用[39];普氏菌在胃肠道内通过发酵产生丁酸[40],丁酸作为肠细胞的能量来源,能够促进肠道蠕动,维护肠道屏障功能[41]。本研究中,与CON组相比,各试验组乳杆菌属和普氏菌属相对丰度升高,且SY-M组高于JY-M组。这表明散养和圈养撒坝猪粪菌液移植均能够改善肠道菌群结构,增加肠道有益菌数量,增加能量来源,促进机体生长,且SY-M组的效果较佳。
3.4 小鼠粪便菌群与脂肪指数的相关性
研究表明,肠道微生物与脂肪沉积相互影响。贺凯[42]用高脂高胆固醇饲粮饲喂小鼠,结果显示,与饲喂普通饲粮的对照组相比,小鼠饲喂高脂高胆固醇饲粮后,体脂含量和血清中总胆固醇、甘油三酯和低密度脂蛋白胆固醇含量显著升高,肠道内脱硫弧菌属_C21_c20相对丰度显著提高,表明脂肪沉积可能会提高脱硫弧菌属_C21_c20的丰度。Lecomte等[43]用高脂饲粮饲喂小鼠,结果表明,与对照组相比,高脂饲粮小鼠肠道乳酸杆菌相对丰度显著降低,且乳酸杆菌相对丰度与脂肪量的变化呈负相关。Hussain等[44]在小鼠高脂饲粮中添加植物乳杆菌(Lactobacillusplantarum)LB818,能显著降低高脂饲粮肥胖小鼠的体脂沉积,提高小鼠肠道中拟杆菌和乳杆菌的相对丰度,降低厚壁菌门相对丰度。Ley等[45]研究表明,肠道内厚壁菌门与拟杆菌门比例的升高会促进小鼠脂肪沉积,而改变肠道内厚壁菌门与拟杆菌门的比例可能调控体内的脂肪沉积。Yang等[46]将肥胖型金华猪和瘦肉型长白猪粪菌液移植至小鼠,结果表明,与长白猪粪菌受体小鼠相比,金华猪粪菌受体小鼠厚壁菌门与拟杆菌门的比例提高,乳酸杆菌的相对丰度降低。以上研究表明,降低厚壁菌门与拟杆菌门比例、提高乳酸杆菌丰度可减少脂肪沉积。
本试验结果显示,与CON组相比,各试验组厚壁菌门/拟杆菌门值均降低,乳杆菌属和罗伊氏乳杆菌相对丰度提高,脱硫弧菌属_C21_c20相对丰度降低,其中SY-M组乳杆菌属和罗伊氏乳杆菌相对丰度显著提高,且SY-M组高于JY-M组,相关性分析结果表明SY-M组乳杆菌属与小鼠附睾脂肪指数、腹股沟脂肪指数和总脂肪指数呈负相关。以上结果表明,散养和圈养撒坝猪粪菌液移植能够改变动物肠道菌群结构,减少脂肪沉积,且SY-M组的效果较优。
4 结 论
① 将健康的散养和圈养撒坝猪粪菌液移植至昆明小鼠,能通过增加肠道菌群多样性和乳杆菌属相对丰度,降低厚壁菌门/拟杆菌门值,从而促进小鼠生长、减少脂肪沉积。
② 本试验条件下,对于昆明小鼠,散养撒坝猪中剂量FMT菌液效果较佳。

