两种分子药物敏感性试验与表型药物敏感性试验检测结核分枝杆菌耐药性的效能比较
孙雯娜 张俊仙 张秀爽 王晓朦 林文 梁艳 王杰 吴雪琼
早诊断、早治疗是预防和控制耐药结核病传播的重要手段[1]。目前,我国临床常用的结核分枝杆菌(Mycobacteriumtuberculosis,MTB)药物敏感性试验(简称“药敏试验”)方法主要有两种:表型药敏试验和分子药敏试验。表型药敏试验作为MTB耐药性检测的标准,可检测多种一、二线抗结核药物的敏感性及耐药程度;而分子药敏试验可快速检测MTB耐药相关基因的突变,目前已在我国上市的主要有反向杂交技术、基因芯片法(简称“芯片法”)[2]、实时荧光定量PCR法(GeneXpert MTB/RIF)[3]、荧光定量PCR探针熔解曲线法(简称“熔解曲线法”)[4],以及基因测序技术等[5]。笔者以表型药敏试验绝对浓度法检测结果为标准,比较芯片法和熔解曲线法直接检测临床标本中MTB耐药性的诊断效能,评价其临床应用价值。
资料和方法
一、研究材料
选取中国人民解放军总医院第八医学中心结核病医学部结核科住院且确诊为结核病的44例患者的临床样本。其中,痰标本29例,支气管肺泡灌洗液13例,颈部淋巴结结核脓液标本1例,骨关节结核组织标本1例。每例样本同时分为2份,1份进行传统的分枝杆菌培养、菌种鉴定和表型药敏试验,另1份提取核酸后进行耐药基因芯片检测,以及熔解曲线法耐药性检测。
二、仪器与试剂
改良罗氏培养基、对硝基苯甲酸(PNB)、噻吩-2羧酸肼(TCH),以及表型药敏试验绝对浓度法利福平(RFP)、异烟肼(INH)、左氧氟沙星(Lfx)含药培养基购自珠海银科医学工程股份有限公司;核酸提取试剂、晶芯ExtractorTM36 核酸快速提取仪、结核分枝杆菌耐药基因芯片检测试剂盒和晶芯微阵列芯片杂交扫描系统为博奥生物集团有限公司产品;MTB的RFP、INH和Lfx药物荧光定量PCR探针熔解曲线法耐药性检测试剂盒、实时荧光定量PCR仪(SLAN-96S型)及熔解曲线分析软件为厦门致善生物科技股份有限公司产品。
三、试验方法
1. 分枝杆菌培养、菌种鉴定和表型药敏试验:对临床标本进行处理后,接种于改良罗氏培养基,置37 ℃进行分枝杆菌培养。分枝杆菌培养阳性的分离株经PNB和TCH含药培养基进行鉴别培养,鉴定为MTB后进行表型药敏试验绝对浓度法。以上实验步骤按照《结核病实验室检验规程》[6]进行。INH、RFP和Lfx等3种含药培养基低、高浓度分别为(1,10) μg/ml、(50,250) μg/ml和(1,10) μg/ml,在对照培养基生长良好的前提下,低浓度含药培养基上菌落数大于20个即判定为耐药。
2. DNA制备:临床标本经液化和洗涤处理后,采用晶芯ExtractorTM36 核酸快速提取仪和核酸提取试剂,按照说明书进行DNA提取,然后置于-20 ℃储存备用。
3. 耐药基因芯片检测:将提取好的核酸应用结核分枝杆菌耐药基因芯片检测试剂盒,按照说明书进行RFP和INH耐药基因检测,将芯片载入晶芯微阵列芯片扫描仪自动判读结果。该芯片检测MTB的RFPrpoB基因6个位点、13种突变基因型;检测MTB的INHkatG基因315位2种突变类型和inhA基因启动子-15位C→T突变基因型。
4. 熔解曲线法耐药性检测:将提取好的核酸应用荧光定量PCR探针熔解曲线试剂盒,按照说明书进行MTB对RFP、INH和Lfx耐药性检测,该方法检测MTB的RFPrpoB507~534核心区位点的突变情况;检测MTB的INHkatG315密码子、inhA94密码子、inhA启动子区(-17~8位点)以及ahpC启动子区(-44~-30及-15~3位点)的突变情况;检测MTB的LfxgyrA88~94位密码子突变。
四、统计学处理
用SPSS 24.0软件对数据进行统计学分析。以表型药敏试验绝对浓度法为标准,计算芯片法和熔解曲线法的敏感度、特异度、准确度和Kappa值。Kappa值介于0.41~0.60时为两者之间有较好一致性,介于0.61~0.80时为高度一致;介于0.81~1.00时为完全一致。
结 果
一、绝对浓度法药敏试验
表型药敏试验绝对浓度法结果显示,44株MTB临床分离株中,RFP高水平耐药14例,低水平耐药2例,敏感28例;INH高水平耐药3例,低水平耐药11例,敏感30例;Lfx高水平耐药17例,低水平耐药3例,敏感24例。
二、芯片法耐药性检测
应用芯片法直接检测44例临床标本对MTB的耐药性,结果显示,RFP耐药15例,其中531位密码子TCG→TTG突变10例,526位密码子 CAC→TAC突变1例,531位密码子TCG→TGG突变1例,533位密码子CTG→CCG突变1例,511位密码子CTG→CCG突变1例,526位密码子CAC→CGC突变1例;RFP敏感29例。INH耐药13例,其中katG315位密码子AGC→ACC突变9例,inhA-15碱基 C→T 突变3例,katG315位密码子AGC→ACC 合并inhA-15碱基 C→T联合突变 1例;INH敏感31例。
三、探针熔解曲线法耐药性检测
应用熔解曲线法直接检测44例临床标本中MTB的耐药性,结果显示,RFP耐药17例,其中529~533位点突变12例,521~528位点突变1例,513~520位点突变1例,507~512、513~520、521~528多位点突变1例;检测出耐药但突变位点不明确2例;敏感27例。INH耐药17例,katG315位点突变12例,inhA启动子区突变3例,ahpC启动子区突变1例,ahpC启动子区合并inhA启动子区突变1例;敏感27例。Lfx耐药17例,均在gyrA基因88~94位密码子区域,敏感27例。
四、三种药敏试验方法的比较
以绝对浓度法药敏试验检测结果为标准,芯片法和熔解曲线法检测RFP、INH和Lfx耐药的敏感度、特异度、准确度和Kappa值见表1和表2,检测结果见表3~5。
以芯片法和熔解曲线法检测RFP的耐药性,有6例结果不一致,符合率为86.4%(38/44),4例为芯片法敏感、熔解曲线法耐药,2例为芯片法耐药、熔解曲线法敏感;在检测INH耐药性时,有4例结果不一致,符合率为90.9%(40/44)。
从表3可以看出,RFP耐药大多数是高水平耐药(87.5%,14/16),而且主要位于531位密码子(78.6%,11/14)和526位密码子(7.1%,1/14)。表4显示,INH耐药大多数是低水平耐药(78.6%,11/14),主要位于katG315位密码子(63.6%,7/11),少数位于inhA-15位碱基(18.2%,2/11)。
本研究中共检测出3例INH高水平耐药,其中katG315位密码子和inhA-15位碱基双位点联合突变1例,katG315位密码子突变2例。

表1 以绝对浓度法药敏试验为标准判断芯片法对结核分枝杆菌耐药性检测的效能
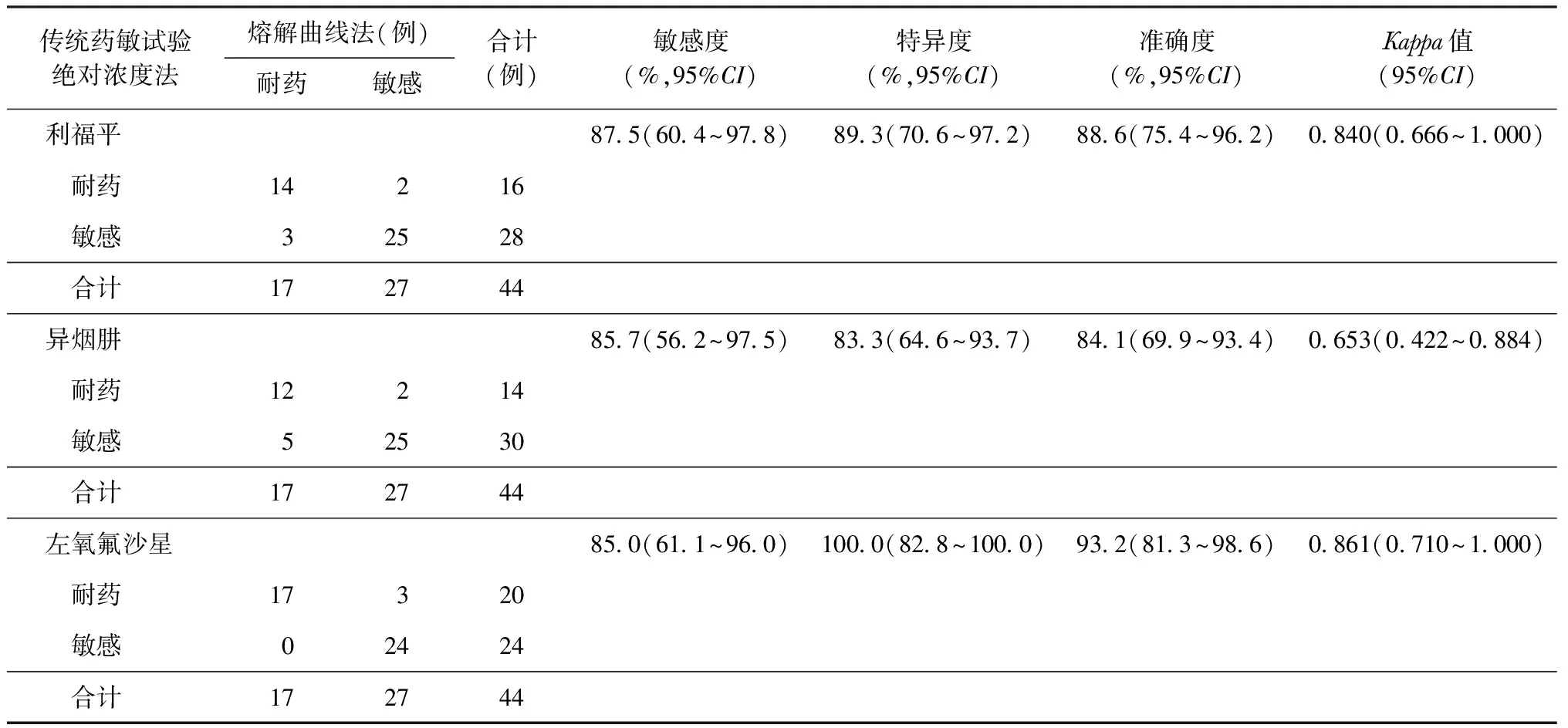
表2 以绝对浓度法药敏试验为标准判断熔解曲线法对结核分枝杆菌耐药性检测的效能

表3 三种药敏试验方法检测临床标本中结核分枝杆菌对利福平的耐药性 [突变情况(例)]
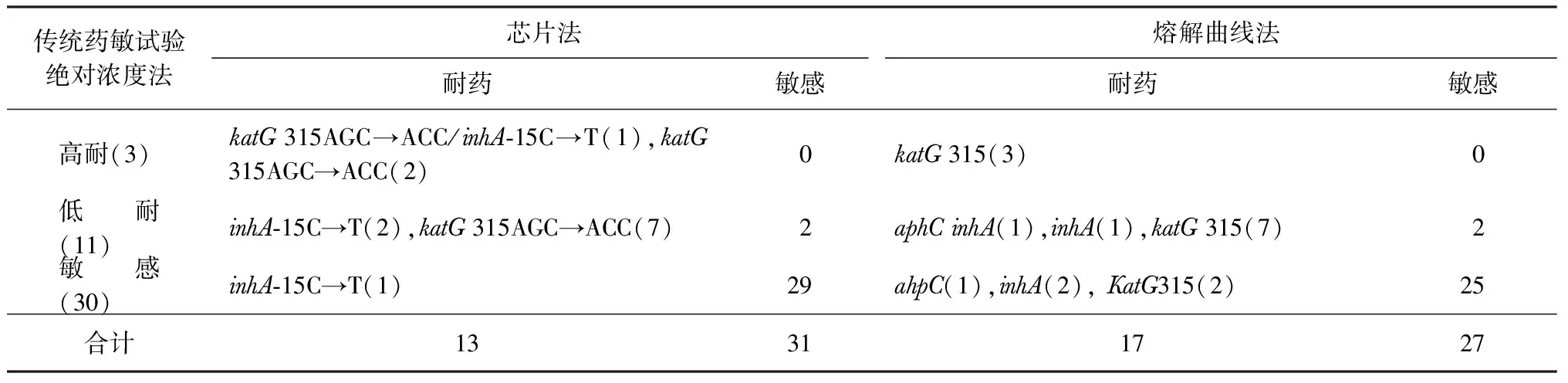
表4 三种药敏试验方法检测临床标本中结核分枝杆菌对异烟肼的耐药性 [突变情况(例)]

表5 二种药敏试验方法检测临床标本中结核分枝杆菌对左氧氟沙星的耐药性 [突变情况(例)]
讨 论
我国是耐药结核病高负担国家之一。目前在我国临床上应用的MTB分子药敏诊断方法主要有GeneXpert MTB/RIF、芯片法和探针熔解曲线法。本研究以传统的绝对浓度法药敏试验为对照,比较芯片法和探针熔解曲线法检测MTB耐药性的诊断效能。
一、诊断效能研究
本研究应用芯片法和探针熔解曲线法直接检测临床标本中MTB对RFP、INH和Lfx的耐药性,敏感度均在85%以上,芯片法检测RFP和INH的耐药性均具有较高的特异度(96%),与相关文献报道相似[7-8];而探针熔解曲线法检测RFP和INH的特异度虽然均超过80%,低于目前大多数的文献报道[7,9],但是也基本能满足临床耐药结核病快速诊断的需求。
二、芯片法和熔解曲线法不一致的原因
本研究结果显示,芯片法和熔解曲线法检测RFP的耐药性,有6例结果不一致,符合率为86.4%;检测INH耐药性,有4例结果不一致,符合率为90.9%。芯片法和熔解曲线法检测RFP和INH耐药性的敏感度相同,但芯片法检测的特异度和准确度均高于熔解曲线法。分析其原因可能是:(1)熔解曲线法较芯片法检测覆盖的突变位点更广泛,用来检测丰度低的异质性耐药样本时可能占有更多优势,但某些与耐药无关的密码子(如507~509、517、523、532位)突变也能被检出[10-11];(2)本研究中两种分子生物学方法均是直接检测临床样本中提取的MTB DNA模板,可能受核酸提取方法、提取效率、DNA纯度及标本中耐药异质性、抑制因子的影响,导致与其他文献报道的检测分离株的分子药敏试验方法结果的差异;(3)本研究表型药敏试验使用的是绝对浓度法,与其他研究中使用的对照方法(如比例法药敏试验、BACTEC MGIT 960药敏试验)不同,在结果上可能存在一定的差异;(4)研究所纳入的样本类型不同,本研究的研究对象包括了肺结核和肺外结核患者的标本,而上述报道是以肺结核标本为研究材料,结果可能会存在一定差异;(5)由这些基因其他区域或其他耐药相关基因引起的突变,以及其他耐药机制引起的耐药,应用这两种分子药敏试验方法不能检出,也可能是导致分子药敏试验敏感度低于表型药敏试验的原因[12]。
三、耐药基因突变与耐药水平的关系
从表2可以看出,RFP耐药大多数是高水平耐药(87.5%),而且主要位于531位密码子(78.6%)和526位密码子(7.1%),与目前研究结果一致,提示临床结核病患者一旦出现RFP耐药,大多数患者治疗效果不佳,需停用利福霉素类药物,更换有效的化疗方案。表3显示,INH耐药大多数是低水平耐药(78.6%),主要位于katG315位密码子(63.6%),少数位于inhA-15位碱基(18.2%),且这些低水平耐药在传统药敏试验方法中不易被检出,通常表现为敏感;少数患者katG315位密码子和inhA-15位碱基双位点联合突变会导致高水平耐药,本研究中共检测出3例INH高水平耐药,其中katG315位密码子和inhA-15位碱基双位点联合突变1例(1/3),katG315位密码子突变2例(2/3),这些结果与刘银萍等[13]的研究结果一致,与Rivière等[14]的结果不同,分析其原因如下:(1)katG315位密码子突变只是导致过氧化氢酶和过氧化物酶活性降低,使INH转换为异烟酸的能力降低[15-16],不同菌株的最低抑菌浓度差异很大,因此,传统药敏试验时可能表现为低、中、高水平耐药或药物敏感,使得不同研究报道的结果存在差异[17]。本研究使用绝对浓度法显示的低水平耐药,也有可能与绝对浓度法选取的临界浓度较高有关[18],提示临床应根据药物最低抑菌浓度结果决定调整INH的剂量或停用INH;(2)结核分枝杆菌inhA-15位碱基突变也通常导致INH低、中水平耐药[13, 19];(3)本研究选取的作为对照的表型药敏试验方法为绝对浓度法,仅选取2个药物浓度作为对照,而Rivière等[14]参照的是药物最低抑菌浓度法,具备多种浓度梯度的检测结果,因此在耐药程度的判断上可能会有一定差异,造成研究结果的不一致。Lfx耐药大多数是高水平耐药(94.1%),均由gyrA88~94位密码子突变所致(100.0%);这与文献报道一致[20]。本研究中3例样本Lfx表型药敏试验显示耐药,而分子药敏试验检测为敏感,可能的原因是:(1)可能存在异质性耐药,分子生物学方法通常只能检测丰度高于20%的耐药结核分枝杆菌,从而造成部分低丰度耐药样本漏检;(2)熔解曲线法针对氟喹诺酮类药物耐药基因gyrA88~94密码子的突变状况进行检测,由其他基因(如gyrB)或gyrA基因其他区域引起的突变,以及其他氟喹诺酮类药物耐药机制引起的耐药,本试验不能检出。
本次研究所选取的作为对比的传统药敏试验方法为绝对浓度法,与标准方法——比例法结果可能存有一定差异。此外,本研究只检测了44例患者的样本,样本量偏少,且未对不一致样本使用测序方法进行验证,因此也存在一定的局限性。
总之,传统的绝对浓度法药敏试验可检出多种药物不同程度的耐药情况,但需较长的时间,不能满足临床早期诊断的需求;芯片法在检测RFP和INH时具有较高的特异度和一致性,熔解曲线法在检测Lfx耐药性时表现出了较好的效能,且操作更为简便和快速。两种分子药敏试验方法均可早期、快速检出耐药MTB,指导临床合理用药和开展有效治疗。
利益冲突所有作者均声明不存在利益冲突
作者贡献孙雯娜和张俊仙:酝酿和设计实验,论文撰写和修改;张秀爽、王晓朦和林文:实施研究并收集整理数据;梁艳:行政、技术支持;王杰:数据录入;吴雪琼:获取研究经费,技术和材料支持,文章修改和指导

