m6A 甲基化修饰及其影响动物脂肪生成的分子机制研究进展
宋兴亚,彭 巍,刘 贤,姚 治,张子敬,雷初朝,王二耀,黄永震*
(1.西北农林科技大学动物科技学院,陕西杨凌 712100;2.青海省畜牧兽医科学院,青海大学,青海西宁 810016;3.河南省畜牧总站,河南郑州 450008;4.河南省农业科学院畜牧兽医研究所,河南郑州 450002)
RNA 表观遗传修饰是转录后水平对RNA 调控的关键所在,发生在转录组中,对于动物体内多种生命进程发挥着极其重要的作用。现有研究发现了170 余种RNA 修饰,能够改变RNA 中所含碱基的电荷以及碱基配对特性,使RNA 发生空间构象上的变化。mA 甲基化修饰在真核生物mRNA 的甲基化修饰形式中丰度最高,是目前RNA 表观遗传修饰的热门研究方向之一。本文综述了mA 甲基化修饰和脂肪生成的基本过程以及mA 甲基化修饰影响脂肪生成的机制,以期为研究动物脂肪调控提供新思路。
1 m6A 甲基化修饰概述
mA 甲基化修饰是指发生在RNA 中腺苷酸第6 位N 通过甲基转移酶催化形成的甲基化修饰,其出现在高度保守的序列上,主要发生在RRACH(R 为A/G;A 为mA 甲基化修饰位点;H 为A/U/C)序列的腺嘌呤上,且其主要分布在终止密码子附近、3’-非翻译区(3'-UTRs)、mRNA 外显子及编码区(CDS)。mA 甲基化修饰主要依靠甲基转移酶(Writers)、去甲基化酶(Erasers)和结合蛋白(Readers)多种蛋白共同调控来完成,图1 较为直观地呈现了这一过程,并包括了mA 酶系统的主要成员和其各自发挥的作用。
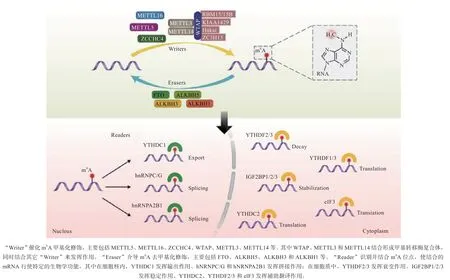
图1 m6A 甲基化修饰酶系主要蛋白及分子机制示意图[10]
1.1 mA 酶系统
1.1.1 甲基转移酶 mA 修饰由甲基转移酶复合体(MTC)所介导,也被称为甲基转移酶。其中的主要成分有甲基转移酶样3(METTL3)、METTL14、METTL16、RNA 结合模体蛋白15(RBM15)、成肾细胞瘤1-结合蛋白(WTAP)、CCCH 型锌指蛋白13(ZC3H13)等。
METTL3、METTL14 和WTAP 是甲基转移酶复合体中的重要组分。METTL3 是在哺乳动物中第1 个被鉴定出来的mA 甲基转移酶,其对应的基因高度保守,在大量不同物种中都存在其同源蛋白。METTL14 可与METTL3 等比例形成二聚体,相互之间起到协同作用,增强两者的催化能力。WTAP 再与METTL3 和METTL14 的二聚体结合形成复合体,加快mA 甲基化进程,并对该过程进行动态调控。有研究表明,WTAP对胚胎发育起着非常重要的作用,其缺失会引起细胞分化能力减弱甚至丧失,使胚胎无法存活。敲除小鼠胚胎干细胞中的基因,显著降低了mRNA 整体的mA 水平,并且影响干细胞的自我修复,进而影响干细胞分化。
1.1.2 去甲基化酶 去甲基化酶的催化作用实现了RNA主动完成去甲基化过程。去甲基化酶主要包括同属于AlkB 家族的肥胖关联蛋白(FTO)、AlkB 同源蛋白5(ALKBH5)、ALKBH1 和ALKBH3。基因被发现之初,人们把它当作肥胖关联基因,之后研究发现FTO 也在mA 甲基化修饰中发挥着去甲基化酶的功能,且FTO 是最早被发现的mA 去甲基化酶,该发现证实了mA 甲基化修饰这一过程是可逆的。FTO 广泛存在于全年龄段生命的组织细胞中,在中枢神经系统中的表达水平尤其高,能够有效去除mRNA 上的mA 修饰;ALKBH5 存在于大部分组织的细胞核内,通过调控mRNA 运输过程发挥其去甲基化的作用。有研究表明,这些去甲基化酶都是通过相同的途径发挥作用,即先把mA 氧化为N-羟甲基腺苷(hmA),然后转变为N-甲酰腺苷(fA),最后变为腺苷。
1.1.3 结合蛋白 含有mA 甲基化修饰的蛋白质若想行使其特殊的功能,需要先与结合蛋白结合,才能实现其特定的功能。已知哺乳动物中存在的mA 结合蛋白主要包括YTH 结构域包含蛋白(YTHDC)、核不均一核糖核蛋白(hNRNPs)、胰岛素样生长因子2 mRNA 结合蛋白(IGF2BPs)和真核起始因子3(elF3)等。有研究证明,YTH 结构域通过特异性识别达到结合蛋白与mRNA 上的mA 位点特异性结合的目的,使结合蛋白发挥相应的功能,从而对mRNA 的选择性剪接与结构改变进行直接调控或间接调控。
1.2 mA 在动物中的生物学功能 mA 甲基化修饰在动物的转录组中广泛存在,使得生长发育、癌症治疗、畜禽育种等多领域工作者对mA 甲基化修饰的关注度提高,mA 更多的生物学功能也逐渐浮现在大众的视野当中。
1.2.1 调控干细胞分化 细胞分化是生物生长发育最重要的生命过程之一,而多种发育调控因子对应的mRNA 的稳定性与mA 甲基化修饰的水平呈负相关,Geula 等研究发现,敲除小鼠胚胎干细胞中的基因,细胞中的mA 甲基化修饰水平降低,胚胎干细胞的自我更新能力和分化能力也随之受到抑制,胚胎的早期发育会极度受限,导致死亡。
1.2.2 调控器官发育 在所有器官中,大脑是mA 甲基化修饰水平及其相关蛋白表达丰度最高的器官之一。有研究表明,敲除小鼠中枢神经系统中的基因会高度抑制大脑皮层及小脑发育,而敲除基因会严重影响大脑皮质发育。
1.2.3 影响癌症发生 mA 甲基化修饰在癌症发生的过程中扮演着极其重要的角色。METTL14 在急性骨髓白血病(AML)中抑制AML 细胞系的终末髓样分化,并促进其增殖,通过对致癌基因与的mA 甲基化修饰水平进行调控使其发挥致癌作用。Barbieri等研究证明,启动子结合的METTL3 在相关mRNA对应的编码区内诱导 mA 甲基化修饰,并通过缓解核糖体停滞来加强其翻译,从而影响急性骨髓白血病的发展,该研究将甲基转移酶METTL3 确定为AML 的潜在治疗靶点。
1.2.4 影响生殖性能 Yuan 等运用全基因组关联分析(GWAS)筛选出包括去甲基酶ALKBH5 在内的许多候选基因会对小鼠睾丸的大小和发育产生较大影响。mA 的高水平存在是弱精子症的危险因素并影响精子活力,而甲基转移酶,尤其是 METTL3,在增加精子RNA 中的mA 含量方面起着关键作用。
1.2.5 影响肌肉发育 丁浩等通过对比鸡骨骼肌细胞各个时期去甲基化酶基因和的表达水平,以及对应时期mA 甲基化修饰水平,推测ALKBH5 和FTO 可能通过调控mA 水平来影响鸡的骨骼肌发育。
2 动物脂肪生成概述
动物的脂肪组织主要分布在机体的皮下、肌肉组织或内脏周围等。皮下过多地生成脂肪会大幅降低动物的饲料转化率,进而影响畜牧生产的经济效益。而脂肪含量与肉产品质量存在密切关系,会影响动物肉质的色泽、风味以及嫩度等,因此调节不同部位的脂肪组织生成与沉积一直是肉用动物研究的热门。
2.1 脂肪细胞生成过程 脂肪细胞是由起源于中胚层的间充质干细胞分化而来,其生成需要经过以下几个步骤:首先由多能的间充质干细胞“定型”分化专能的前脂肪细胞,然后前脂肪细胞再向脂肪细胞进行“终末分化”,最后以聚酯的形式形成成熟的脂肪细胞。脂肪细胞的生长包括脂肪细胞数量的积累以及体积的变化。成熟的脂肪细胞不具备分裂和分化的功能,因此脂肪细胞数量上的积累是依靠前体脂肪细胞的增殖分化来完成,而脂肪细胞体积的增大主要是因为胞内甘油三酯含量升高所导致。
2.2 脂肪细胞生成的调控因子 在脂肪生成和分化的过程中,许多调控因子发挥了调节作用,如过氧化物酶体增殖物激活受体(PPAR)、CCAAT/ 增强子结合蛋白(C/EBPs)等。PPAR是脂肪生成和调控的主要作用因子之一,脂肪细胞中激活的PPAR保证了脂肪细胞因子(脂联素和瘦素)的平衡和充分分泌,同时在机体内的糖脂代谢和胰岛素信号传导也扮演着重要角色。对于C/EBP,它是C/EBPs 异构体之一,其表达对自身有着正反馈效应,即C/EBP表达增多后,可诱导自身表达,形成正反馈。同时,数据汇总的结果显示,缺乏PPAR的成纤维细胞即使在添加了高水平C/EBP的情况下仍无法向脂肪细胞分化,由此可得,C/EBP在脂肪生成中发挥的作用是辅助PPAR完成成脂过程。
3 m6A 甲基化修饰影响脂肪生成的机制
mA 会对动物机体的脂肪生成产生影响,主要是去甲基化酶FTO、甲基转移酶复合体及其组分METTL3、mA 结合蛋白IGF2BP1 以及其他重要成脂基因通过mA 甲基化修饰在动物脂肪生成中发挥作用。
3.1 FTO 表达水平与脂肪生成呈正相关 依赖于去甲基化酶FTO 的mA 脱甲基过程不仅是mRNA 修饰加工的新机制,该过程在脂肪分化、形成的调节中也发挥着尤为关键的作用。
Zhao 等运用基因组学、细胞生物学技术等生物技术发现mA 酶体系中的重要组分——FTO 缺失会阻碍前体脂肪细胞(3T3-L1)的分化:在3T3-L1 分化过程中,mA 修饰区域集中在外显子剪切位点附近,并且和mRNA 剪接加工的重要元件SR 蛋白结合序列具有空间重叠性;干扰表达可以增加富含丝氨酸/精氨酸剪接因子(SRSF2)对RNA 的结合能力,促进SRSF2靶基因的外显子保留,这一过程在图2 中有详细说明;FTO 调控剪接位点附近的mA 甲基化修饰水平来控制成脂调节因子RuNt 相关转录因子转位1(RUNX1T1)的剪切产物,调控了3T3-L1 的分化。脂肪形成的过程中,FTO 的表达水平与mA 修饰水平成反比,FTO的活性降低会阻止成脂过程,只有具有催化活性的FTO才能激发脂肪的形成。

图2 FTO 依赖性m6A 甲基化修饰和SRSF2 介导的RUNX1T1 的可变剪接示意图[26]
Jiao 等通过构建基因敲除和过表达的前体脂肪细胞3T3-L1,对比分析得出FTO 可抑制3T3-L1 细胞增殖,并使线粒体膜电位和ATP 水平降低;实验还检测了几种脂质代谢相关转录因子的表达水平,结果显示敲除后,除抑制了AKT 磷酸化和4 型葡萄糖转运蛋白(GLUT4)的表达之外,还降低了PPAR的表达水平。Wang 等敲除小鼠基因,发现自噬相关蛋白5(ATG5)与自噬相关蛋白7(ATG7)的表达降低,YTHDF2 与mA 甲基化修饰水平较高的ATG5 与ATG7 mRNA 结合,导致转录产物被降解,蛋白质表达减少,从而抑制了自噬与脂肪形成。为确定YTHDF2 是否是FTO 在3T3-L1 细胞形成脂肪中发挥作用的主要因素,实验进行沉默,结果显示与对照细胞相比,细胞周期蛋白A2(CCNA2)和细胞周期蛋白依赖性激酶2(CDK2)的mRNA 水平升高,G1 期和S 期细胞周期阻滞消失,G2 期细胞数量明显增多,并且沉默会使敲除给成脂标记物PPAR,C/EBP和脂肪酸结合蛋白4(FABP4)带来的抑制作用减小或逆转。表明FTO 与YTHDF2 协同作用通过影响甲基化介导CCNA2 和CDK2 的表达途径,进一步调控细胞周期和脂肪生成过程。
3.2 METTL3 表达水平与脂肪生成呈负相关 Yao 等通过进行qPCR 与Western blots 技术,发现沉默基因可显著促进猪骨髓间充质干细胞(pBMSC)的成脂分化:当METTL3 受到干扰时,JAK1 mRNA 的mA修饰水平下降,从而使其mRNA 的稳定性得到增强,激活了Janus 激酶1(JAK1)/ 信号转导和转录因子5(STAT5)/C/EBP途径,使得脂肪生成增多,同时成脂标记物PPAR、C/EBP和FABP4 的表达受到激发,表达水平升高;相反,细胞中METTL3 的过表达明显抑制了pBMSC 的脂肪生成:当METTL3 过表达时,观察到脂质滴减少,并且成脂标记物PPAR,C/EBP和FABP4 被明显抑制。
Kobayashi 等通过单独敲除或过表达WTAP、METTL3 和METTL14,发现这三种组分协同工作,生成的甲基转移酶复合体通过影响在促进脂肪细胞分化的有丝分裂扩增(MCE)过程中的细胞周期来正向调控脂肪形成。
3.3 IGF2BP1 表达水平与脂肪生成呈正相关 IGF2BP1是mA 甲基化修饰的“reader”,属于单链RNA 结合蛋白,可以与胰岛素样生长因子2(IGF2)mRNA的5' UTR 结合并调节IGF2 的翻译,在细胞内多个过程中都发挥着重要作用。已有研究表明IGF2 的过表达与儿童肥胖相关,IGF2 降低了脂肪细胞中胰岛素受体的 mRNA 表达,并下调了胰岛素受体亚型A(IR-A)和GLUT4 的丰度以及内脏脂肪细胞中相应的葡萄糖摄取。IGF2 在小鼠肝脏的过表达会降低体脂。Chen等研究其结合蛋白IGF2BP1 与鸡脂肪生成的关系,结果显示IGF2BP1 可以促进脂肪细胞的增殖和分化,其过表达会增加脂质滴含量。并且在鸡肝相关细胞系Leghorn 株M 鸡肝癌(LMH)细胞中的异位表达表明,IGF2BP1 可以调节与脂肪酸代谢相关的基因的表达,促进脂肪细胞增殖分化,增加脂滴积累。
3.4 其他成脂相关基因的mA 甲基化修饰影响脂肪生成线粒体载体同源物2(MTCH2)是一种线粒体外膜蛋白,MTCH2 高表达水平细胞具有更强的脂肪沉积能力。Jiang 等从金华猪的背最长肌中已知脂质氧化代谢相关的102 个mA 甲基化修饰基因选出mA 水平差异最显著的,研究其mA 甲基化修饰水平对金华猪脂肪生成的影响,结果显示高水平的mA 甲基化修饰可以促进金华猪肌内前体脂肪细胞分化过程中的表达,可能是通过增强自身mRNA 的翻译,促进对应蛋白的表达,从而促进脂肪生成。Jiang 等的研究仅在组中发现敲除基因会减少MTCH2蛋白的水平,而在同义的mA 位点突变组中没有发现,基因的过表达会增加MTCH2 蛋白的水平;后续通过RIP 实验揭示了YTHDF1 和MTCH2 mRNA 之间的直接相互作用,表明由mA 介导的翻译依赖于mA 结合蛋白——YTHDF1(图3)。

图3 MTCH2 以m6A-YTHDF1 依赖性机制促进肌内脂肪生成示意图[38]
4 小 结
随着RNA 表观遗传学不断发展,mA 甲基化修饰更多的生物学功能逐渐被发掘出来,其在组织器官发育、细胞分化、癌症发生及脂肪生成等方面都扮演着不可或缺的角色。就现有研究看来,mA 相关调节蛋白影响脂肪生成主要是依靠其与RNA 相结合来发挥功能,其关键作用意味着它们对应的基因有望成为调节畜禽机体脂肪含量的筛选位点,但其中还存在着一些值得深入思考的地方:一些成脂基因在不同物种中具有序列保守性,那么这些基因发生mA 甲基化修饰产生的影响是否具有结果的一致性;同种动物不同组织器官的mA 甲基化修饰水平存在差异,是否与该部位的脂肪含量呈一致性。若能通过mA 甲基化修饰水平来调控畜产品中的脂肪含量,将会助力畜牧生产向前跨进一大步,这对于科研工作者来说仍是一项巨大的挑战,研究前景一片光明。

