n-3 多不饱和脂肪酸在羊肉中沉积规律的研究进展
张钊阳,张博彦,罗海玲,王 炳
(动物营养学国家重点实验室,中国农业大学动物科学技术学院,北京 100193)
羊肉营养丰富、肉质鲜嫩、风味独特,深受消费者喜爱。脂肪酸是影响羊肉品质的一个重要因素,其中n-3多不饱和脂肪酸(N-3 Polyunsaturated Fatty Acids,n-3 PUFAs)在羊肉中含量丰富,是评价羊肉营养价值的重要指标。n-3 PUFAs 在调节胆固醇、降低血压、预防肝病和心血管疾病以及各种慢性疾病和癌症等方面也显示出有益作用。因此,提高羊肉中n-3 PUFAs 含量不仅可以改善羊肉的营养品质,也有益于人类营养健康。然而,羊肉中的n-3 PUFAs 仅占总脂肪酸的0.4%~3.1%,不同饲喂模式和不同品种羊肉中n-3 PUFAs 的含量不同。羊肉脂肪酸沉积的来源主要有2 个,一个是饲粮中脂肪酸消化吸收后直接沉积,另一个是脂肪酸从头合成。本文综述了n-3 PUFAs 的来源、n-3 PUFAs 在羊体内的合成与代谢规律、影响n-3 PUFAs 在羊肉中沉积的因素以及相关微生物和分子调控机制,为进一步了解n-3 PUFAs 在羊肉中的沉积规律、生产富含n-3 PUFAs 的羊肉及后续的相关研究提供参考。
1 n-3 多不饱和脂肪酸的来源和功能
n-3 PUFAs 主要包括-亚麻酸(-Linolenic Acid,ALA)、二十碳五烯酸(Eicosapentaenoic Acid,EPA)、二十二碳六烯酸(Docosahexaenoic Acid,DHA)和二十二碳五烯酸(Docosapentaenoic Acid,DPA)。n-3 PUFAs 的来源广泛,存在于各种天然食物中,如深海鱼和植物籽实。目前,牧草和植物籽实是饲料中n-3 PUFAs 的主要来源。紫苏籽富含ALA,紫苏籽油是迄今为止发现含有ALA 最高的食用油。菜籽油、亚麻籽油、大豆油、南瓜籽和核桃油中也含有丰富的ALA。EPA和DHA 主要来源于藻类和深海鱼油,EPA 和DHA 也可以由ALA 作为前体物转化生成,但转化效率较低。DPA 是ALA 在体内生成EPA 和DHA 的中间产物,主要存在于海洋哺乳动物的油脂中。
n-3 PUFAs 具有增加细胞膜稳定性、调节免疫功能和脂质代谢等功能,对人类健康至关重要。例如,增加n-3 PUFAs 的摄入可以预防和治疗怀孕期抑郁症发生;EPA 和DHA 可以改善胎儿大脑和视网膜发育,降低心血管疾病和阿尔茨海默症的发生风险。
2 n-3 多不饱和脂肪酸的合成与代谢
2.1 n-3 多不饱和脂肪酸合成代谢途径及相关酶 在反刍动物中,多不饱和脂肪酸(Polyunsaturated Fatty Acids,PUFAs)优先沉积在磷脂中,在磷脂的代谢、功能和生理状态中发挥主要作用。一般而言,饲粮中PUFAs 含量升高可在一定范围内提高动物食品(肉、奶)中ALA、EPA 和DPA 的积累,但对DHA 的富集非常有限。脂肪酸去饱和酶1(FADS1)和脂肪酸去饱和酶2(FADS2)对n-3 PUFAs 的偏好性高于n-6 PUFAs,但亚油酸(Linoleic Acid,LA)的摄入量升高会干扰ALA 向EPA、DPA 和DHA 的延伸和去饱和过程。ALA 和LA 之间存在竞争FADS2 的现象,但其具体机制仍不清楚。研究发现,0.2% 的ALA 可以转化为EPA,65%的EPA 可以转化为DPA,37%的DPA 可以转化为DHA。n-3 PUFAs 和n-6 PUFAs 的代谢途径见图1。
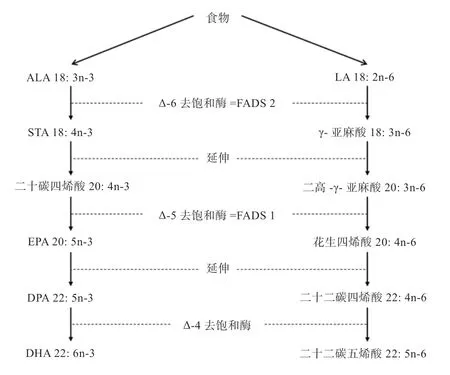
图1 n-3 PUFAs 和n-6 PUFAs 的代谢途径
与肉中脂肪酸沉积相关的酶统称为脂肪酸代谢相关酶。脂肪酸合成酶(Fatty Acid Synthetase,FASN)控制长链脂肪酸的从头合成,是一种关键限速酶。FASN协助催化乙酰辅酶A 和丙二酰辅酶A 转化为棕榈酸的反应(图2)。已知9 种脂肪酸结合蛋白(Fatty Acid-Binding Protein,FABP)的亚型(FABP1~FABP9),FABP4 也被称为脂肪细胞脂肪酸结合蛋白。FABP4 在脂肪酸代谢、运输和吸收中发挥重要作用,用于促进脂肪酸转运和调控脂类物质的合成与分解。乙酰辅酶A 羧化酶(Acetyl-CoA Carboxylase,ACC)属 于脂肪酸合成酶,用于催化脂肪酸合成的第一步反应。脂蛋白酯酶(Lipoprotein Lipase,LPL)属于调控脂肪分解代谢的关键酶,将富含甘油三酯的脂蛋白水解为脂肪酸和单酰甘油。肉碱脂酰转移酶(Carnitine Acyl Transferase,CPT1)属于脂肪酸转运酶,是脂肪酸-氧化的关键限制酶,可以影响脂肪沉积。过氧化物酶体增殖物激活受体(Peroxisome Proliferators-Activated Receptors,PPARs)既是配体活化的核转录因子,也是核激素受体之一。PPARs 具有控制长链脂肪酸氧化、诱导脂肪细胞分化等功能。硬脂酰辅酶A 去饱和酶(Stearyl-CoA Desaturase,SCD)是调控脂肪转化的关键酶,在动物脂肪细胞中催化饱和脂肪酸(Saturated Fatty Acids,SFAs)转化为单不饱和脂肪酸(Monounsaturated Fatty Acids,MUFAs),并影响n-6/n-3 PUFAs 的比例。脂肪酸脱氢酶(Fatty Acid Dehydrogenase,FADS)主要用于PUFAs 的合成,催化脂肪酸链上的特定位置形成双键,调节脂肪酸的不饱和度,并直接参与PUFAs 的代谢。然而,目前关于羊肉中n-3 PUFAs 代谢相关酶的研究还较为缺乏。

图2 n-3 PUFAs 在羊肌肉肉中沉积的潜在微生物和分子调控路径
2.2 脂肪酸代谢microRNA 调控因子 近年来,研究发现microRNA(micro Ribonucleic Acid,miRNA)与脂肪酸代谢存在密切联系,其作用机制是通过结合脂肪酸代谢相关基因的靶向来调控脂肪酸的代谢。miR-126 可预防由脂肪酸代谢异常所造成的动脉硬化;miR-196 用于调控皮下脂肪组织中相关基因的表达,同时用于改变脂肪的分布;miR-21 可以预防肥胖的发生,是脂肪生成和代谢过程中的关键调节因子;miR-33、miR-122、miR-370 和miR-378 都被认为是脂肪酸代谢的调控因子,用于预防肝脏脂肪酸代谢异常引发的系列疾病;而miR-133a、miR-141 等与由肥胖引起的胰岛素异常性糖尿病密切相关;miR-21、miR-27a、miR-106b和miR-181a 在转录后调控水平可以直接调节PPAR,从而参与饥饿状态下肝脏的脂肪酸代谢。这些对脂肪酸代谢相关miRNA 的研究,有利于探明脂肪酸代谢的分子调控机制。然而,目前关于靶向调控肌肉中n-3 PUFAs 沉积相关的microRNA 调控因子还未见报道。
3 影响羊肉中n-3 多不饱和脂肪酸沉积的因素
3.1 饲料 在实际生产中,饲料原料(亚麻籽、紫苏籽、土豆渣、棉秆)或外源添加剂(甜菜碱、藻类补充剂、鱼油、ALA)对羊肉n-3 PUFAs 沉积影响效果已有广泛探究。在饲料原料方面,米晓民等研究表明,添加8%亚麻籽可以提高萨×寒杂交一代去势断奶公羔羊肌肉中n-3 PUFAs 含量;樊懿萱等在湖羊日粮中添加10%紫苏籽可提高湖羊肌肉中n-3 PUFAs 含量,并显著降低n-6 PUFAs 含量和n-6/n-3 PUFAs;薛树媛等研究表明,饲喂含48%土豆渣的发酵饲料对小尾寒羊DHA 的合成有不同程度的促进作用,并提高了肌肉中DHA 含量;桑断疾等研究发现,添加40%棉秆可以增加绵羊羊肉中ALA 含量,提高总n-3 PUFAs 含量。在外源添加剂方面,Dong 等在湖羊饲料中添加2.2 g/d 甜菜碱可以提高羊肉中n-3 PUFAs 含量;Fan 等研究表明,在标准饲粮或高能饲粮中添加3%藻类均可以增加绵羊肉中总n-3 PUFAs 含量(主要是EPA 和DHA);在巴美肉羊添加2.4%鱼油可以提高羊肉中n-3 PUFAs 含量,并降低n-6/n-3 PUFAs;Nguyen 等在饲粮中添加6% 以下的ALA 可以促进羔羊肌肉内的n-3 PUFAs 沉积。综上所述,通过饲喂一些特定的饲料原料或添加一定剂量的添加剂可以提高羊肉n-3 PUFAs 含量,其主要原因可能是由于饲料中富含n-3 PUFAs,经肠道吸收入血后直接沉积到羊肉中。
3.2 饲养方式 肉羊生长发育受到当地自然环境、动物存栏量、饲料资源、管理等因素影响。在饲养模式方面,袁倩等研究发现,放牧模式下苏尼特羊羊肉的n-3 PUFAs(ALA、共轭亚油酸、EPA 和DHA)相对含量显著高于舍饲模式,n-6/n-3 PUFAs 显著低于舍饲模式;Martin 等研究发现,放牧制度下断奶羔羊肉中n-3 PUFAs 的比例更高;近期本团队Wang 等研究发现,人工草场放牧条件下滩羊肉中n-3 PUFAs(EPA、DHA 等)组成和含量都表现为放牧模式显著优于舍饲模式,并且放牧模式滩羊肉中n-6/n-3 PUFAs低于5,符合WHO 对人类饮食的推荐标准。在天然草场上也发现相似结果,进一步分析天然草场滩羊采食组分后发现羊肉中n-3 PUFAs 的沉积与所采食的植物群细枝雾冰藜(Bassia scoparia)、地锦草(Euphorbia humifusa)、软紫草(Arnebia euchroma)和猪毛菜属(Salsola sp.)有关。在饲养时间方面,藏羔羊肉中PUFAs 含量高于成年藏羊肉,其中ALA、EPA、DHA含量均高于成年藏羊肉。然而,由于放牧模式下羊只的生长速度较慢,因此需要更多研究来实现饲养模式之间优化组合,制定出兼顾动物生长效率以及羊肉品质的饲养方式,最终促进羊肉中n-3 PUFAs 沉积和生长效率的协同提高。
3.3 品种 不同品种羊肉的n-3 PUFAs 含量有所不同。Zhang 等研究发现,在饲喂相同饲粮的条件下,杜泊羊肉中n-3 PUFAs 含量显著高于滩羊和湖羊;韩娜等研究表明,与平川羊肉和玉门羊肉相比,清泉羊肉中ALA、DHA 和EPA 含量更丰富;丁武研究表明,与关中奶山羊相比,波尔山羊与关中奶山羊的杂交羊肌肉中ALA 含量增加。然而,到目前为止,仍缺乏系统且详细的围绕我国乃至世界各地肉羊品种的n-3 PUFAs 含量分析与差异机制探讨,是否存在调控羊肉n-3 PUFAs 含量的靶基因仍需更多研究来揭示。
3.4 瘤胃微生物 瘤胃微生物是宿主对饲粮进行脂质代谢过程的主要媒介,通过与饲粮和宿主间的互作来影响羊肉中n-3 PUFAs 的沉积。瘤胃微生物通过脂肪分解和生物氢化2 个主要过程对饲粮中的脂质化合物进行转化。进入瘤胃的脂质首先被微生物脂肪酶转化为游离脂肪酸和甘油。其中,产生的不饱和脂肪酸在瘤胃微生物的作用下进行生物氢化,进而转化为饱和脂肪酸。LA 和ALA 在瘤胃生物氢化中的最终产物为硬脂酸。当生物氢化未完成时,会积累中间产物(主要是共轭亚油酸和共轭亚麻酸的各种异构体),可吸收入血并沉积在肌肉、奶等反刍动物畜产品中(图2)。PUFAs在瘤胃中的生物氢化作用会生成大量SFAs,进而造成PUFAs 在反刍动物产品(肉、奶等)中的沉积减少。而n-3 PUFAs 的多不饱和程度越高,参与生物氢化作用的瘤胃微生物数量和种类就越多。超过85% 的饲粮ALA 在瘤胃中氢化,EPA 和DHA 在瘤胃内被广泛氢化。利用体外瘤胃培养技术发现EPA 和DHA 可在瘤胃发酵过程中完全消失。EPA 和DHA 在瘤胃生物氢化时会产生中间代谢物,进而抑制ALA 的生物氢化过程。因此,可以使用包被等保护措施使饲粮中的n-3 PUFAs 免于瘤胃降解,使其更多地流向小肠,进而沉积到羊肉中。
n-3 PUFAs 对瘤胃微生物具有毒性作用,在瘤胃中容易被微生物氢化。瘤胃微生物主要由原虫、厌氧细菌、厌氧真菌和古菌组成。其中一些细菌具有生物氢化功能(图2),例如,可促进亚油酸生物氢化生成CLA 和trans-11-C18:1;细菌会将LA 生成硬脂酸,会生产C18:0。瘤胃中大约四分之三的微生物脂肪酸存在于原虫中。原虫的脂肪酸组成较细菌的脂肪酸含有更多的不饱和脂肪酸,特别是原虫含有丰富的PUFAs、CLA、trans-11-C18:1,是肉和奶的前体物。如含有超过细菌10 倍的CLA。而中的CLA、trans-11-C18:1 的含量很少。因此,这些PUFAs 在动物中的沉积主要取决于原虫的流量。而厌氧真菌在瘤胃微生物生物量中只占一小部分,瘤胃真菌可以将硬脂酸转化为C18:1n-9,将LA 和ALA 形成相应共轭产物,如和可以降解LA 形成cis-9,trans-11-CLA。到目前为止,对瘤胃脂肪分解和生物氢化过程发生的微生物机制认知仍不甚清晰。
4 小结与展望
富含n-3 PUFAs 的优质羊肉生产是实现羊肉市场的高质量健康发展和改善人类营养健康的重要渠道之一。饲料、羊品种和饲养方式是影响n-3 PUFAs 在羊肉中沉积的重要因素,而其潜在调控机制主要是受到饲粮脂肪酸在胃肠道中的消化代谢(如胃肠道微生物和生物氢化作用)以及动物机体脂质代谢相关的分子调控网络影响。目前,通过营养调控策略和育种技术对羊产业的转型升级和优质羊肉生产已展现出巨大潜力。目前,参与和决定n-3 PUFAs 从头合成及其在羊肉中沉积的调控网路尚不明确,在后续羊肉n-3 PUFAs 沉积规律的研究中要更加关注瘤胃微生物作用与宿主基因功能,构建n-3 PUFAs 在肌内沉积的分子调控网络。并将瘤胃微生物菌群靶向调控技术和过瘤胃技术相结合,共同调节羊肉n-3 PUFAs 沉积,最终生产出富含n-3 PUFAs 的优质功能性羊肉,促进羊产业优质高效发展,为人类健康饮食和高品质生活助力。

