蒙脱石-CO2溶液反应实验研究*
唐洪明,王文卓,彭东宇,王子逸,王 昭,周 翊
(1.西南石油大学地球科学与技术学院,四川成都 610500;2.中海石油(中国)有限公司湛江分公司,广东湛江 524057;3.西南石油大学油气藏地质及开发工程国家重点实验室,四川成都 610500)
0 前言
超临界CO2在地质、油气、环保等领域应用广泛,如成岩作用与孔隙演化、基于混相理论的强化油/气开采(CO2-EOR/EGR)、基于吸附理论的驱替煤层气/页岩气开采(CO2-ECBM/ESGR)等,同时在压裂、钻井等领域都有突破性进展,对实现2030 年碳达峰和2060 年碳中和的“双碳”目标也具有重要意义。“CO2注入法”和“CO2驱油法”被认为是开发中最为绿色的方法[1]。CO2注入沉积储层后与沉积岩矿物存在相互作用,在向地层注入CO2过程中,其形成的弱酸性环境对储层中的矿物产生一定的影响,尤其是分布在颗粒表面和孔喉处的黏土矿物,外来流体率先与其接触,若反应剧烈且产生固相,可能对储层造成一定损害。
有关蒙脱石在碳酸中的行为,前人进行过一系列研究。Luisa 等[2]研究了25 ℃下pH 对蒙脱石溶蚀速率的影响,pH值介于5和10之间时发生了Al、Fe的溶解与沉淀。Köhler等[3]认为硅酸盐与CO2的反应分为3 个阶段:即快速溶解、独立溶解、固相饱和。Daval 等[4]认为在硅酸盐反应(90 ℃)过程中,产生的无定型SiO2层的钝化效应是控制反应速率的重要因素。Romanov[5]认为蒙脱石对CO2的捕集能力强,CO2不可逆的“嵌入”层间域中使其膨胀,膨胀程度取决于阳离子水化程度和CO2分压,导致CO2与H2O 在层间混合形成碳酸而非CO2置换H2O的过程,最终H+与碱金属阳离子发生化学反应。Serhatkulu等[6]发现CO2还可以作为输送流体,以协助在黏土中嵌入其他离子。Paul等[7]发现当层间域中存在少量H2O时,钠蒙脱石与CO2接触可使其膨胀9%,d(001)晶面间距由11.3 Å增至12.3 Å,且受压力影响较小。Botan[8]发现CO2在蒙脱石层间域中较稳定,且未发现层间域的膨胀或收缩。Schaef等[9]在50 ℃下将CO2与钙蒙脱石反应后,d(001)晶面间距从14.48 Å降至12.52 Å,且含结晶水越多下降幅度越大。
综上所述,作为层状硅酸盐的蒙脱石与CO2反应的研究总体相对较少,且手段单一。针对相关实验研究相对较少、机理阐述不明等情况,为避免受不同矿物间结构和组成差异的影响,评价不同单矿物在CO2水溶液中的化学特征。本文优选蒙脱石为实验研究对象,利用X射线衍射仪(XRD)、X射线荧光光谱仪(XRF)、电感耦合等离子光谱(ICP)等多种手段,结合电镜能谱,深入探讨其在CO2-盐水体系中的变化特征,可为成岩演化提供依据,为矿场试验开展气/水交替驱的可行性提供重要参数。
1 实验部分
1.1 材料与仪器
实验用气体为CO2,99.9%。实验用水为取自新疆530 井区克下组的地层水,矿化度为24 000 mg/L,主要离子质量浓度(单位mg/L):K++Na+9 302、Ca2+214.3、Mg2+39.13 Cl-13 507、SO42-630.99、HCO3-1 209.79、CO32-178.52,水型为NaHCO3型。实验用蒙脱石取自钠基膨润土,粒径44~75 μm,XRF测试矿物中Al含量29.56%,Si含量61.87%,另含有少量K、Ca、Mg 等元素,XRD 测试中矿物的主要成分为钠蒙脱石,富含Na 元素,纯度>85%,d(001)晶面间距为15 Å。
CWYF-1 型高温高压反应釜,江苏海安石油科研仪器公司;Agilent-5110 型等离子体发射光谱仪(ICP-OES),美国Agilent 公司;Agilent-7900 型电感耦合等离子体质谱仪(ICP-MS),美国Agilent公司;PANalytical-PW2424 型X 射线荧光光谱仪(XRF),荷兰帕纳科公司;Smartlab 9K 型X 射线衍射仪,日本理学公司。
1.2 实验方法
反应温度取储层温度65 ℃,为使反应中的CO2超过超临界态达到液态,反应压力取10 MPa。以10 MPa 压力将高温高压反应釜中的样品浸泡于CO2中,为保证充分接触,地层水与岩粉质量比设为1∶3,反应设置7、30 d两个时间节点,依据中国石油天然气行业标准SY/T 5163—2010《沉积岩中黏土矿物和常见非黏土矿物X 射线衍射分析方法》、国家标准GB/T 14506.28—2010)《硅酸盐岩石化学分析方法》、中国石油天然气行业标准SY/T 5523—2016《油田水分析方法》,分别利用XRD、XRF、ICP-OES方法测试反应前后晶面结构、固相元素、离子浓度变化。
具体实验步骤如下:①将典型单一矿物样品研磨至100 目后抽提烘干,制得粉样(200 目);②反应前先对岩心样进行XRD 及XRF 测试,以石英d(101)峰为标志峰标定初始衍射曲线及元素;③将固相和液相以质量比1∶3 混合均匀后装入试管中,然后放入反应釜中加温加压(加压气源为CO2)充分反应,实验装置图见图1。7 d 后和30 d 后分别取出,并将岩粉与流体分离。测试反应后固相元素、晶面结构以及反应液离子浓度。

图1 静态反应实验装置图
反应前后参数变化幅度(率)K由式(1)计算:

其中,Ai—反应后参数;A0—反应前参数。A可代表反应物质量(g)、特征峰强度(扣除基线后,cts)、元素相对含量(%)等。
2 结果与讨论
2.1 蒙脱石结构与性质
蒙脱石属蒙皂石族矿物,理想分子式为(Na,Ca)0.33(Al,Mg)2(Si4O10)(OH)2·nH2O,Si/Al 为2∶1,中间为铝氧八面体,上下为硅氧四面体所组成的2∶1 层状结构(TOT 型)的黏土矿物,属于单斜晶系层状结构硅酸盐矿物,阳离子交换容量(CEC)为80%~150%,比表面积为34.9 m2/cm3,层间距0.96~4 nm。结构单元层中较高价阳离子被较低价阳离子替代时造成的正电荷亏损,将由层间的交换性阳离子Mg2+、Ca2+、Na+等来补充,电荷主要分布于Al—O 八面体中。在蒙脱石结构单元层中,四面体和八面体片以氧原子相连,Si4+、Al3+主要赋存于四面体片和八面体片中心,不易被外来离子置换,而层间主要充填Na+、Ca2+、Mg2+等。而层间以范德华力连接为主而无氢键,连接力弱,层间Na+、Ca2+、Mg2+易被半径更小、化学性质更稳定的离子从中置换出。
2.2 液相成分的变化
与反应前地层水中离子浓度相比,反应30 d内K+、Ca2+、Mg2+、Al3+浓度先上升后下降,Si4+浓度先上升后趋于平稳。其中在0~7 d 内,K+浓度由0 增至293 mg/L,Ca2+浓度由214.3mg/L 增至1935 mg/L;Mg2+浓度由39.1 mg/L增至473.0 mg/L,Al3+浓度由0增至2.8 mg/L,Si4+浓度由0 增加41 mg/L;反应7~30 d内,K+浓度由293 mg/L降至170 mg/L,Ca2+浓度由1935 mg/L降至459 mg/L,Mg2+浓度由473.0 mg/L降至228.0 mg/L,Al3+浓度由2.8 mg/L 降至0.8 mg/L,Si4+、Al3+浓度整体变化较小。一方面,随着体系到达平衡,反应速率减慢,有Al(OH)3沉淀产生;另一方面,生成物SiO2覆盖岩心表面使反应“钝化”。蒙脱石中Al以Al—O八面体形成存在,Si以四面体形成存在,液相中Al3+、Si4+分别来自Al—O 八面体和Si—O 四面体的溶解。而Al—O 八面体和Si—O四面体较为稳定,在酸中被溶蚀破坏程度较弱,因此液相中Al3+、Si4+浓度增加幅度较小,但溶液中Si4+浓度增幅明显大于Al3+,这是由于黏土矿物由细分散含水层状硅酸盐和含水非晶质硅酸盐矿物组成,其本身富含一定量非晶态硅(如硅胶铁石等),尤其对于蒙脱石,其为非晶质火山尘未完全转化的产物,这些非晶硅质的稳定性远不及硅氧四面体中的硅,易于被酸溶蚀。Mg2+在Al—O八面体中心,在酸性条件下通过离子交换形式释放到水溶液中。层间以Na+、Ca2+等活性阳离子为主,在酸性环境下易被H+置换出,因此Na+、Ca2+浓度变动幅度较大。酸性条件下样品粉末中K+溶出,随后K+进入TOT结构的层间域中替代原先的Na+,故7~30 d内为减少趋势。
2.3 固相成分的变化
为进一步明确在实验条件下蒙脱石与CO2反应强弱程度,对其中固相组分进行分析。反应前后固相成分变化包括蒙脱石粉末固相元素及晶面结构变化。
反应前后同一样品的XRD 衍射曲线见图2,特征峰相对强度变化见表1。蒙脱石粉末在反应后d(001)峰明显削弱,峰减小幅度为30.61%,其余峰变化较小。反应后石英的峰有所增加,增幅为10.27%。早先的研究普遍认为酸性环境中蒙脱石溶解过程是通过破坏晶体边缘的桥氧键(Si—O—Al)进行的[2]。当结构单元层中的高价阳离子Si4+及Al3+被低价阳离子(如Mg2+等)替代时造成的正电荷亏损,将由层间的活性阳离子(Ca2+、Na+、Mg2+等)来补充。由于结构单元层内类质同象发生在Al—O八面体内,正电荷亏损形成的作用力很弱,层间阳离子极易被半径更大、电负性更大的离子置换,从而使(001)面极易被破坏。Jeon 等在45~65 °C,10~15 MPa 条件下对CO2-盐水-蒙脱石体系中的溶解反应及结构变化进行了动力学研究,发现蒙脱石的(001)晶面在溶解反应后发生了变形,如式(2)所示[10]。
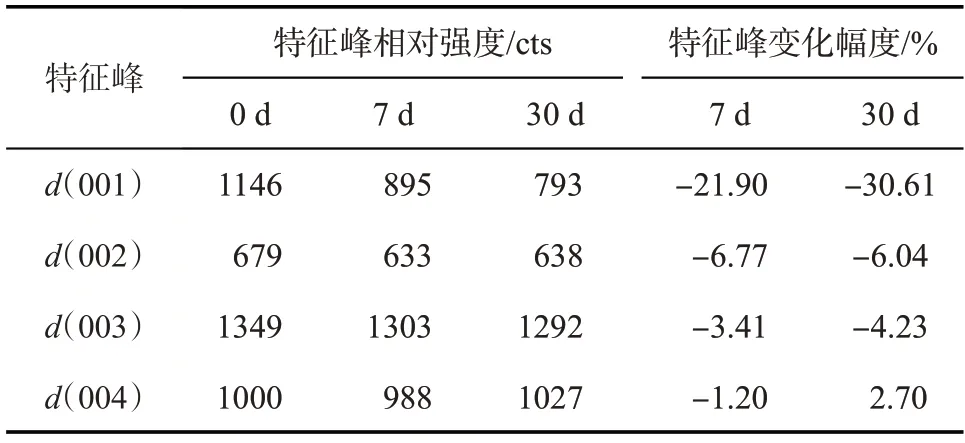
表1 反应前后蒙脱石粉末(44~75 μm)的特征峰相对强度变化
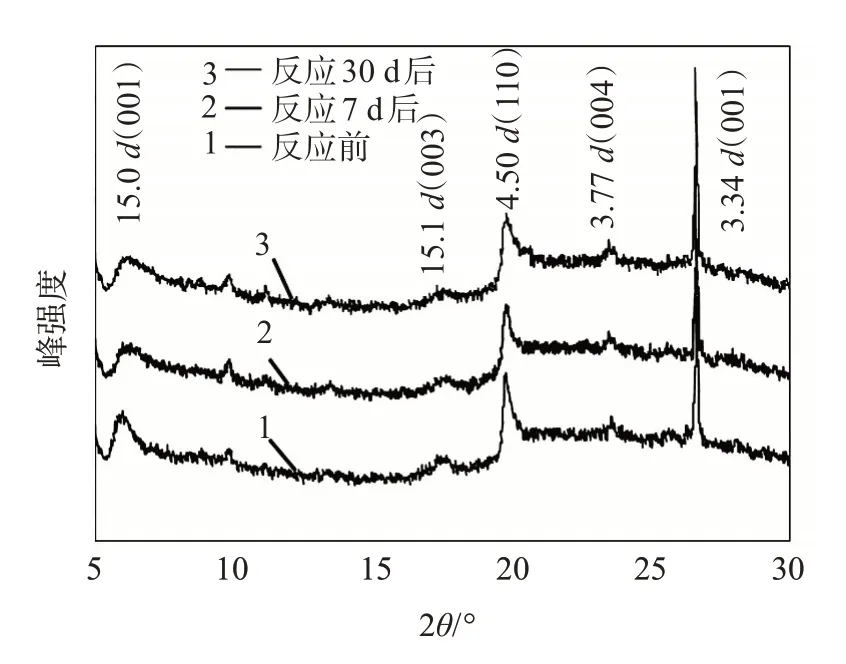
图2 反应前后蒙脱石粉末(44~75 μm)的XRD曲线
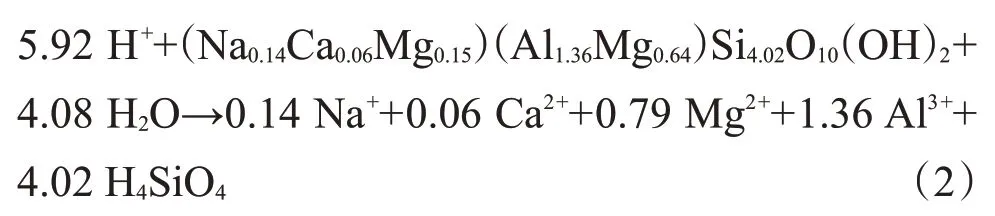
XRF 测试结果(表2)表明,反应前后固相元素整体变化不大。蒙脱石粉末反应0~7 d~30 d 中Si/Al 由2.09 上升至2.12 再下降至2.08。在酸性环境中羟基与H+结合,使黏土带正电性,电荷分布于Al—O 八面体(Al-OH+H+→Al++H2O),此时Si—O四面体本应比Al—O 八面体更稳定,而蒙脱石中非晶态的Si 则使Si 元素含量的变化大于Al 元素的。在实验反应条件(60 ℃、10 MPa)下CO2饱和盐水的pH 值约为4~5.5[11],结合pH 及液相离子浓度变化(见图3)分析,溶出的Si4+在7~30 d 内未产生沉淀,而Al3+则会产生Al(OH)3沉淀。

表2 反应前后蒙脱石粉末(44~75 μm)的元素含量变化
2.4 蒙脱石与CO2反应机理分析
CO2超临界压力为7.1 MPa,在10 MPa、60 ℃下,CO2在水中的质量分数约为4.6%,水溶液的黏度约为0.04 mPa·s,密度为0.3 g/cm3。CO2溶于水中存在4 个平衡,根据Le Chatelier 原理,使平衡(3)向右移动,CO2(aq)的增加又会导致平衡(4)的产生。碳酸的形成又会显著增加质子(H+)浓度,从而显着降低体系的pH值。
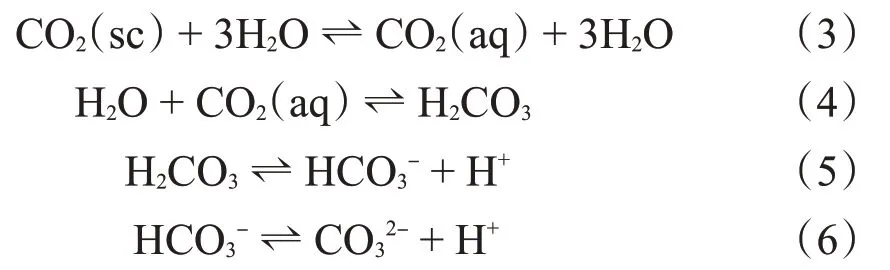
酸性条件下蒙脱石表现为非膨胀性,阳离子交换量(CEC)较低[13],但由于蒙脱石层间作用力为较弱的范德华力,且比表面积大,使得H+易于进入层间产生反应。部分研究认为在高压CO2条件下,湿CO2的吸附导致蒙脱石的结构变形。Oelkers等将反应分为硅酸盐溶解、碳酸盐沉淀两部分,其中硅酸盐溶解释放出无定型的SiO2附着在矿物表面,阻碍后续反应,从而降低反应速率[14-16]。Huertas认为蒙脱石的溶解速率强烈依赖于溶液的pH,并利用表面络合理论解释溶解机理[17]:酸性条件下蒙脱石溶解速率r与Al(OH)2+的表面浓度及质子的活性有线性关系,即溶解速率r=c[Al(OH)2+]×10-8或αH+0.34×10-11.39(pH 值<8)。蒙脱石与CO2反应机理较为复杂:首先,由于蒙脱石与水的亲和力更强,极易水化分散,先与水发生反应呈碱性,有利于CO2的溶解[18];其次,钠、钙、镁等金属阳离子极易脱离层间域产生离子交换,反应过程中半径较小的H+将Na+、Ca2+、Mg2+等阳离子置换出,从而破坏(001)晶面,Si4+、Al3+则相对较为稳定,其中CO2对蒙脱石晶体结构中硅、铝元素反应强度不同,Al—O八面体易于被强酸所破坏,而Si—O 四面体相对比较稳定。结合前人研究成果,本实验中蒙脱石与CO2反应机理分两步,如式(7)和(8)所示:

蒙脱石与CO2的反应对于注CO2改造储层有极为重要的意义:一方面,CO2直接通过化学反应使岩石表面和孔隙中的蒙脱石含量减少,从而增大孔隙体积和渗流空间;另一方面,弱酸中H+增加蒙脱石端面正电荷,降低其CEC,而H4SiO4脱水产生的SiO2也具有极低的CEC,可有效抑制蒙脱石水化膨胀[19-21],从而极大地避免因黏土膨胀引起的孔喉缩小。同时,由于页岩中黏土矿物以同为2∶1 型的伊利石为主,研究CO2在黏土矿物中的吸附作用,也可为提高页岩气采收率机理研究提供参考。
3 结论
蒙脱石与CO2反应后离子浓度及固相元素总体变化较小。反应后液相中Ca2+、Mg2+、Al3+浓度先上升后下降,Si4+浓度先上升后趋于平稳;蒙脱石d(001)峰下降约30%,对应晶面在溶解反应后遭到破坏。
相对于Al、Si,反应过程中Mg、Ca、Na元素的变化幅度相对较大。一方面,由于蒙脱石阳离子交换量较大,层间Na+、Mg2+、Ca2+等半径较大的活性阳离子易被半径较小的H+置换;另一方面,蒙脱石层间分子间作用力为范德华力,相对于静电力较弱,结构易被破坏。在酸性条件下,蒙脱石带正电且电荷分布于Al—O 八面体中,此时Si—O 四面体和Al—O 八面体多余的电荷被H+所平衡,因此较为稳定。蒙脱石中非晶态Si易溶解,使Si的变化幅度大于Al的变化幅度。

