IGT基因家族调控作物株型研究进展
徐崟海,刘佳
1.中国农业科学院油料作物研究所,农业农村部油料作物生物学与遗传育种重点实验室,武汉430062;
2.长江大学农学院,湿地生态与农业利用教育部工程研究中心,主要粮食作物产业化湖北省协同创新中心,湖北 荆州434000
作物的形态结构是在幼苗到成株的全生命周期中不断发展变化的产物,而对作物植株构型分子遗传调控的了解主要来自于模式植物拟南芥和水稻。此外,作物构型具有物种特异性,地上部分的空间结构是重要农艺性状的集合,是栽培期间茁壮成长能力、产量、质量及收获效率的主要决定因素[1]。作物具有不同的地上部形态,例如单子叶作物水稻的分蘖角(水稻垂直线与倾斜度最大侧分蘖之间的角度)反映了水稻株型的撑开程度[2],同样还有小麦的分蘖角度和玉米的叶片夹角。双子叶模式植物拟南芥地上部分枝角通常是指主茎与侧枝之间的角度,油菜和大豆等作物的地上部结构与拟南芥株型相似,有学者结合多种实验方法和技术研究植株的分枝性状[3]。不同作物的株型结构决定了作物的繁殖成功率和产量,过度扩张型和紧凑型的株型都不利于最终产量形成,极度紧凑的植株容易患病导致减产,而匍匐生长的植株会占用更多的空间,导致单位面积作物产量降低。因此,适当的分蘖(枝)角度能够增加光合面积,提高作物的光合能力和光照利用率,且可以通过增加种植密度,较大幅度提高作物产量,同时有利于在高密度种植条件下机械化收割,降低人工成本,提升经济效益。因此,合适的株型和深根系是提高作物品种产量和抗逆性,以及适合机械化收获的重要农艺性状,对作物的高密度种植和粮食安全至关重要。单双子叶作物的地下部根系结构也各有差异,水稻玉米地下部根系为须根系,油菜和大豆地下部根系为主根系结构。较深的根系结构除了有助于为植株提供锚固和稳定作用外,还能吸取更多的营养和水分,更好地为地上部传送营养,在提升作物抗旱性和资源利用率方面具有潜在应用价值[4]。油菜是我国重要的油料作物,油菜籽常用来榨油和饼粕,同时也是重要的工业原料。分枝角度是油菜的重要株型农艺性状,培育理想株型油菜也是我国油菜遗传改良方向之一[5],选育株型紧凑、抗病抗倒性强、抗裂角等理想型农艺性状油菜新品种[6],再搭配对应合理的高密植栽培等生产技术,能够显著提高我国油菜的经济系数和产量。
1 IGT基因家族研究概况
IGT基因家族普遍存在于植物体内,是一类调节植物生长素不对称分布和侧器官定向生长的功能性基因。该家族共享4个保守结构域,其中以高度保守的“IGT”氨基酸基序命名,包括3个不同 的进化 枝LAZY1、TAC1和DRO1。LAZY1和DRO1类基因有C端的CCL结构域Ⅴ,CCL结构域包含一个乙烯响应因子转录抑制基元EAR(图1A),该基因的突变会在不影响亚细胞定位的情况下严重破坏蛋白质功能[7],在调控植物侧向器官定向的遗传机制和提高植株抗逆性等方面均有不同的贡献[8],通过系统发育分析表明LAZY1比TAC1和DRO1更古老(图1B)。本文收集整理了所有在单双子叶作物中已报道的IGT成员(表1)。LAZY1和TAC1基因是调节植物分蘖(枝)角度的基因家族成员。AtTAC1响应光信号,促进茎尖向水平方向定向生长[25],而AtLAZY1通过响应重力刺激改变生长素运输促进茎尖向地性生长[7]。在重力作用下,从水稻中克隆出的OsLA-ZY1基因通过调控植株体内的极性生长素运输(polar auxin transport,PAT)以及茎尖中内源性生长素(indole acetic acid,IAA)的分布改变水稻分蘖角度,la1是OsLAZY1基因功能缺失的水稻突变体,能促进生长素的极性运输,导致分蘖角度增大,从而使植株表现为较为松散的株型[9]。而Os-TAC1基因被定位于水稻9号染色体35 kb区域,由单显性基因控制,通过定量分析表明OsTAC1基因主要在叶枕、分蘖节和分蘖基部高表达(图2),使株型变得较为开张,而当AGGA突变成GGGA,OsTAC1表达降低导致茎尖不对称生长,最终使水稻植株呈现紧凑的分蘖结构[11]。有研究发现LAZY1基因相对TAC1具有上位性,可能负调节TAC1基因表达,从而促使枝条向重力方向生长[27]。在水稻中,OsDRO1基因只在根尖组织中表达(图2),并会受到生长素信号下游关键转录因子的直接负调控,控制根尖中细胞伸长,导致根部不对称生长以及响应重力而使根向地性弯曲生长,通过减小根系的垂直角度而造成深根系结构,从而提高作物抗逆性[4]。AtNGR1是功能未知的蛋白质,又称AtLAZY2,属于LAZY亚族,该基因能使作物的根发生向地反应,参与侧根角度形成,NGR已经被证明其可以调控水稻的根系结构,例如在苜蓿和拟南芥中,NGR基因的缺失会逆转根向地性,导致根系向上生长[35]。可见IGT基因家族可能具有提高作物产量、增加密植、机械化收获等特点,在作物生产中扮演着十分重要的角色。
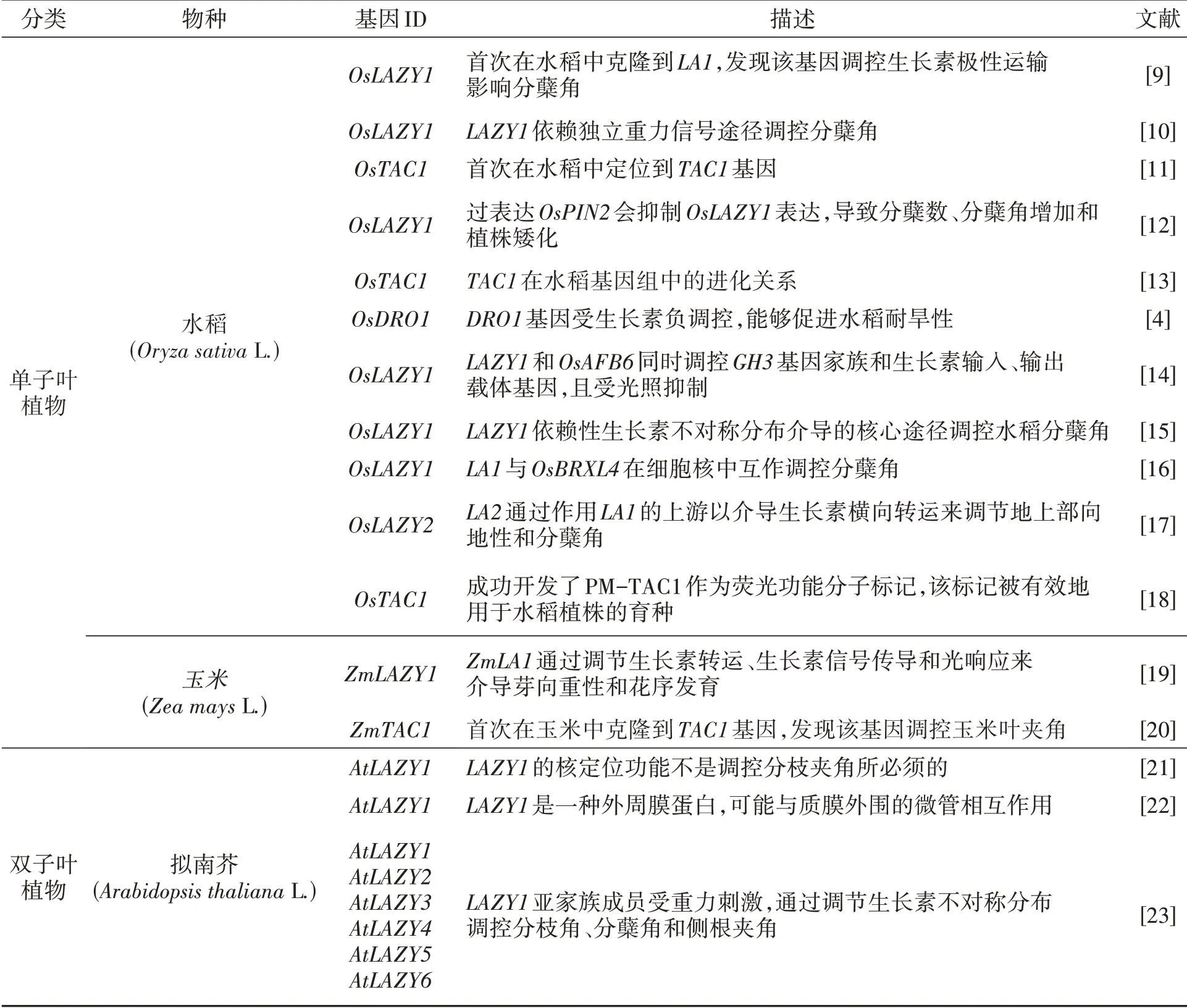
表1 模式植物和单双子叶作物中已鉴定出的IGT基因家族成员Table 1 IGT gene family members identified in model plants and monocotyledon and dicotyledon crops
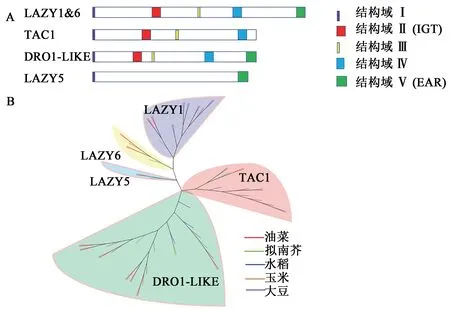
图1 IGT基因家族的代表成员基序结构和其他作物中IGT家族成员聚类图Fig.1 Motif structure diagram of IGT gene family representative members and cluster diagram of IGT family members in other crops
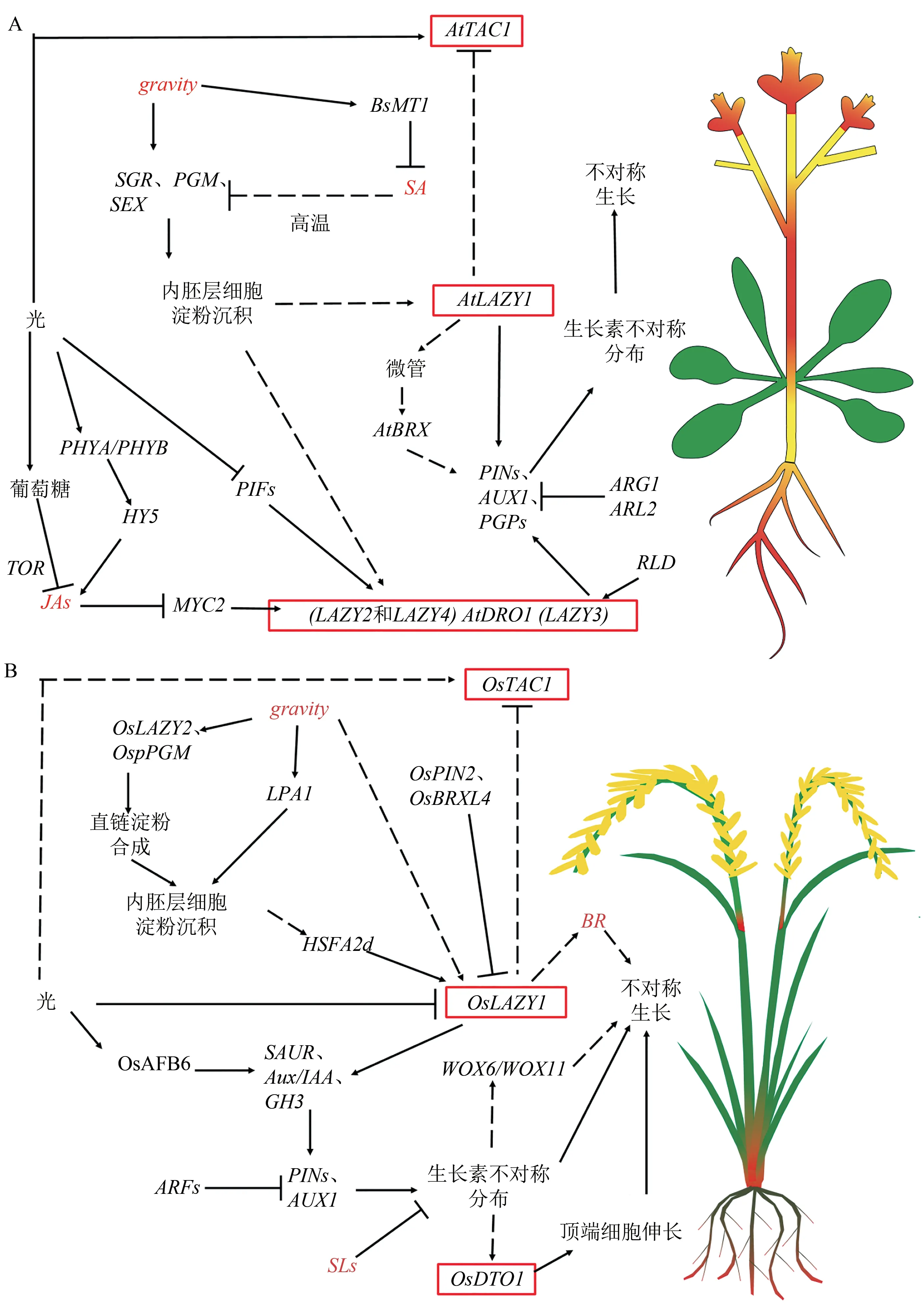
图2 IGT基因家族参与调控株型的基因网络图Fig.2 Gene network diagram of IGT gene family involved in regulating plant ideotype.
1.1 光影响IGT基因家族成员的表达
光和重力会影响植物的株型结构,植株会根据光和重力信号调整其生长方向,以最大化利用光合作用获取养分,因此植物对光和重力的反应对于它们的正常发育和生存至关重要。同时,持续变化的光质和光强、光的持续时间以及光周期对于植物的株型结构也具有重要的调控作用。此外,光也能调节IGT家族成员的表达水平,有研究发现OsLAZY1基因的启动子区域有多个光响应顺式元件,且OsLAZY1基因的表达会受到光照的抑制[14]。玉米中ZmLA1基因受光周期影响改变表达水平,从而调控玉米的向地性[19],而在拟南芥中AtDRO1基因也受到光和重力的影响,促进PIFs和HY5蛋白积累,使根和下胚轴不对称生长[29],HY5也能通过抑制拟南芥分枝关键负调控因子BRC1的转录,促进拟南芥的分枝发育[36]。AtTAC1基因表达也受到光和重力的影响,但具体的调控机制尚不清楚,深度挖掘IGT基因家族受光和重力的调控途径有助于分析其分子机制。
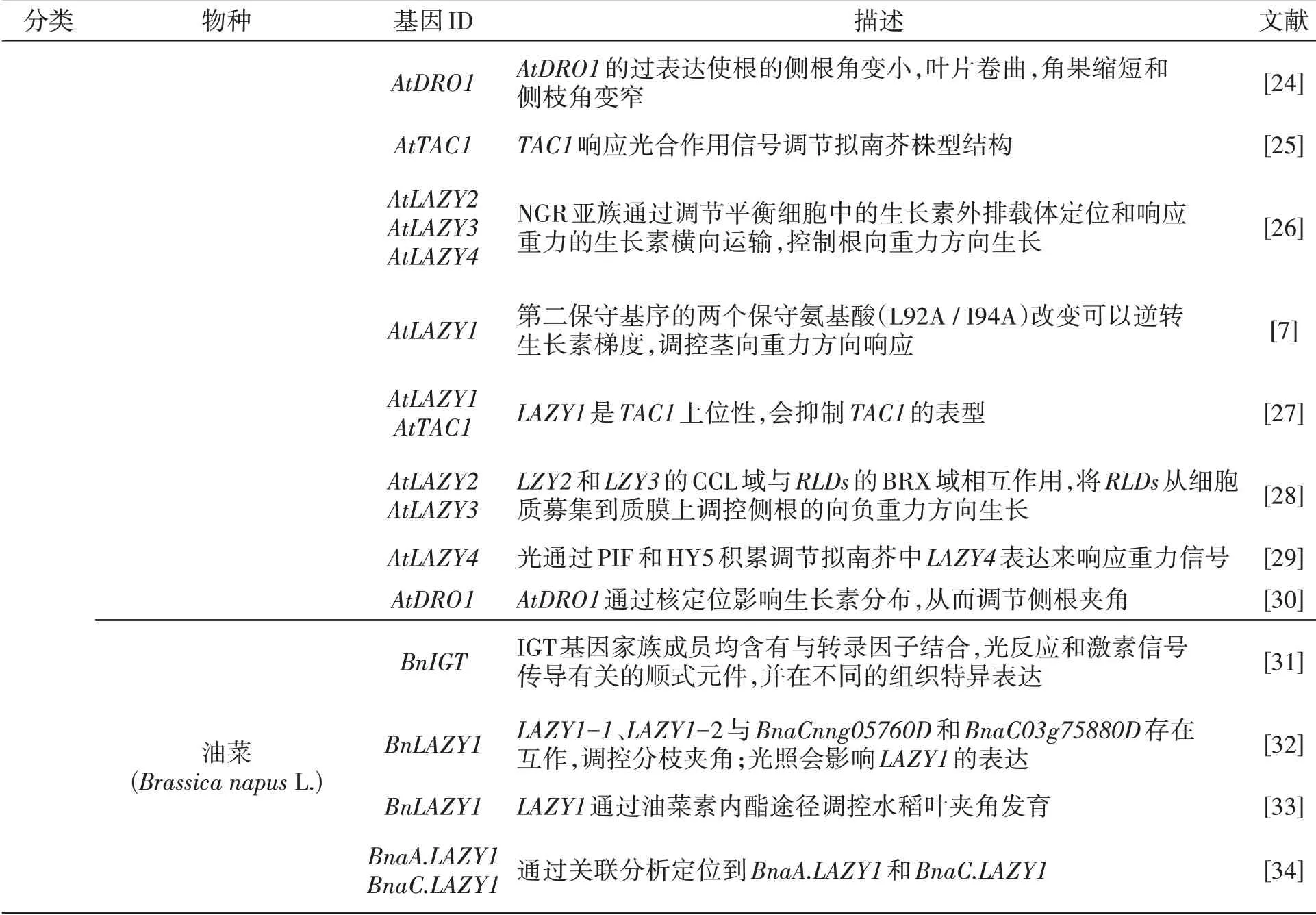
续表
1.2 重力刺激IGT基因家族的表达
重力是一种作用于地球上所有生物的基本物理力,重力感应是植物向地性响应的第一步,是高等植物向地性响应的重要环节。经典的淀粉平衡石假说提出,重力是通过淀粉粒沉降在特定组织平衡细胞中感知的,向地性是高等植物最重要的环境响应之一。植物常由重力感知部位感受重力刺激方向,造成淀粉粒的沉降并产生重力信号,再将其信号转导到相应组织,在根冠的小柱细胞和芽的内胚层细胞中感受重力信号,并刺激组织器官内的生长素及其他激素不对称分布和重力相关基因(IGT基因家族成员)的表达,根据重力信号调节生长素不对称生长,导致响应组织部位发生向重力或负重力方向弯曲生长,从而形成不同的株型结构[37]。有研究发现水稻la2突变体的平衡细胞内基本没有淀粉粒,对重力感应缺失,通过生长素的横向运输,调控水稻分蘖角,但la2幼苗只表现出地上部向地性的部分缺陷[17],因此淀粉粒是感应重力刺激的重要物质,但并不是必须的。综合研究发现光和重力相互影响植物器官定向生长[38]。
1.3 温度影响株型结构
温度也会影响植株地上部和地下部的株型结构。在小麦中,苗期分蘖角度受温度影响较大,温度越低分蘖角越大,从而增强小麦在冬季的抗冻性[39]。在拟南芥中,低温抑制其花序茎的伸长,而高温则抑制花序茎的重力信号,导致花序茎向地性的响应减弱,从而影响分枝角度[40]。IGT基因家族的三大亚族在侧器官中对重力、光信号和温度都会产生响应,然而各响应表达均有差异。IGT基因家族能优化作物地上部和地下部器官的定向,空间上合理利用资源使农作物获得更大的收益,对作物形态的发展和生产具有深远的影响。
2 IGT基因家族成员调控株型的机制
2.1 LAZY1
地上部分蘖(枝)角是作物冠层结构的关键性状,它决定了作物的种植密度,同时可以通过影响光合作用效率进一步调控生物量产量。
2.1.1 单子叶作物中LAZY1的调控机制LAZY1和TAC1都是调控植物分枝或分蘖角度的基因[41]。在水稻中首次克隆到OsLAZY1基因,通过序列分析发现其具有一个跨膜结构域TMD和一个核定位信号NLS结构,该结构能使LAZY1蛋白定位在质膜和细胞核中,其缺失的la1突变体使向重力性应答机制减弱,增强了生长素极性运输,导致分蘖角度增大[5]。有学者发现水稻OsLAZY1基因主要在茎基部和分蘖节处有特异高表达(图2B),通过酵母双杂交筛选并鉴定出LA1的互作蛋白Brevis Radix Like 4(OsBRXL4),是植物特有的BRX家族成员。OsBRXL4通过与LA1互作影响水稻LA1的核定位,过量表达OsBRXL4可以减少LA1在细胞中的定位,影响水稻的重力响应,导致水稻植株分蘖角度增大,呈现半散生表型[16]。由此可见跨膜结构域和核定位信号功能对水稻的LAZY1基因调控分蘖角起着至关重要的作用。
OsLAZY2编码一个叶绿体定位蛋白,该蛋白对水稻重力感应叶鞘基淀粉体中淀粉合成至关重要。OsLAZY2作用于OsLAZY1上游,与淀粉生物合成酶OspPGM互作,通过la1介导的生长素不对称分布共同调控水稻分蘖角和茎向地性,从而揭示了依赖于淀粉平衡石的茎向地性调控途径框架[17]。而拟南芥AtSGR5的同源基因PGM也参与淀粉体的合成,并发现pgm突变与lzy2;3;4三突变体存在上位性[42]。有学者发现水稻OsLPA1基因过表达能激活PIN1a的表达,促进水稻平衡细胞的淀粉体沉降,导致OsLAZY1基因表达增强,分蘖角减小[43]。而生长素转运蛋白OsPIN1和OsPIN2表达差异导致水稻分蘖角度的改变,过表达OsPIN2会抑制OsLAZY1表达,导致IAA在根、茎,尤其是在根冠交界处发生自由分布变化,从而使分蘖角增大、分蘖数增多和不定根减少[12]。因此,PINs蛋白在催化细胞内生长素的流出速度中起作用,其不对称的细胞定位决定了细胞间流动的方向,这是生长素调节生长过程的核心[44]。此外,有学者发现OsLAZY1基因可通过油菜素内酯途径改变水稻的叶夹角[33],同时OsLAZY1基因会受到上游热应激转录正调控因子HSFA2D调控,促进OsLAZY1介导生长素的不对称分布途径,且在生长素胁迫下致使两个功能冗余的转录因子WOX6和WOX11不对称表达,从而调控水稻向地性反应[15]。已有研究结果表明,水稻分蘖角的核心调控基因OsLAZY1会受到重力信号转导和生长素不对称分布途径调控水稻分蘖角[2],还有学者发现存在重力信号独立调控途径调控株型结构[10,45],这些结果表明可通过多种途径调控水稻株型结构,但具体的调控途径还有待进一步探索。有研究发现玉米ZmLA1基因可与核中IAA17及质膜上PKC调节因子直接相互作用,光照中下调表达,而在黑暗中则会促进表达,从而调控玉米的向地性和花序发育[19]。水稻中发现光能促进OsAFB6的表达,且负调控OsLAZY1表达[14],但没有相关研究发现拟南芥AtLAZY1基因受到光的调控。
激素独脚金内酯(strigolactone,SL)是最近发现的一类萜类内酯,被认为是第二信使,能与生长素一起调节植株地上部株型结构。SL生物合成和信号转导的突变体可通过降低局部生长素含量来缓解la1突变体植株茎尖向地性和扩散表型。SLs能够抑制生长素的生物合成,降低局部生长素含量,导致生长素不对称分布而减弱茎的向地性,从而使水稻分蘖角增大。SLs不改变茎中的生长素横向运输,而是通过不同分子遗传途径调控茎中生长素的极性运输,从而调节分蘖角[46]。挖掘SL调控途径的基因是一种很有前途的策略,可以促进作物分蘖角或分枝角的改良。
2.1.2 双子叶中LAZY1的调控机制 双子叶模式植物拟南芥中AtLAZY1基因是水稻LAZY1的功能直系同源物,在茎向地性的重力信号中起作用。AtLAZY1定位在质膜和细胞核上,通过核定位信号突变降低细胞核中AtLAZY1的表达并不影响其分枝表型,所以AtLAZY1的核定位不是其控制分枝向重力方向所必需的[21]。研究表明AtLAZY1是一种外周膜蛋白,其羧基末端片段可能与微管相互作用共同定位在质膜上,通过调节蛋白或复合物来影响趋向性[22]。拟南芥AtSGR5基因可以调节淀粉体的沉降速率,使向地性的敏感性降低[40],同时研究发现AtLAZY1基因高表达时水杨酸异常偏高,转录组分析结果表明拟南芥受到重力刺激后BSMT1基因的表达量会降低,猜测BSMT1可能对水杨酸有负调控作用[47],而水杨酸在作物生长过程中一直处于十分重要的地位,能够促进自身产热,为植物体增强抗冻性,但有研究猜测AtSGR5基因能影响内胚层细胞淀粉体的沉降速率,高温会抑制重力信号,减弱花序的向地性,对AtSGR5基因有负调控作用[40],导致AtLAZY1对重力的响应减弱,使分枝角增大。
拟南芥中的LAZY1主要在主茎中高表达(图2A)。油菜作为双子叶植物,与拟南芥类似,也在主茎中特异高表达。对油菜BnIGT基因家族进行分析,发现16条染色体上共有27个BnIGT家族成员。对BnIGT家族成员的顺式元件进行预测分析,发现了与转录因子结合、光反应和激素信号转导相关的3种顺式元件,表明该基因会受到光、重力和激素等环境的影响。此外,共表达网络分析显示LAZY1与细胞壁生物合成基因有很强的关联[31],猜测与微管蛋白存在相互作用。有学者通过全基因组关联分析共定位到25个与油菜分枝角相关的基因,其中在A03和C03染色体上初步定位到BnLAZY14个同源基因中的2个BnaA10g19550D和BnaC03g06250D[34,48]。随后对该基因进行功能验证,利用亚细胞定位发现LAZY1蛋白的N端定位在细胞核,C端则定位在细胞膜上瞬时表达,同时核内蛋白互作发现该蛋白与另外两蛋白对应的基因BnaCnng05760D和BnaC03g75880D存在互作,证明油菜BnLAZY1基因A03和A10染色体上的同源基因能够调控油菜分枝角度[32]。其中BnaCnng05760D在拟南芥中的同源基因分子功能主要负责阴离子跨膜转运,可能通过调节膜内外电压差,引导LAZY1发挥功能,而BnaC03g75880D基因属于泛素样结构域超家族,负责RNA加工。因此,在不同植物体内,LAZY1基因功能具有一定相似性,然而发挥功能的调控途径会有较大差异,需要进一步深究油菜BnLAZY1基因调控分枝角度的机理,以便为油菜育种提供方向。
2.1.3LAZY类基因研究进展 拟南芥的同源基因AtLAZY5和AtLAZY6也属于IGT基因家族成员,除了AtLAZY5基因无保守的第Ⅱ基序IGT,其他IGT家族成员均含有保守的IGT基序[8],AtLAZY6和AtLAZY1基因在叶柄中均有一定的表达[45],可以控制叶片角度改变株型结构。而在油菜中,LAZY5和LAZY6基因的表达量极低,与之相关的研究也比较少,还有很大的挖掘空间。
2.2 TAC1
2.2.1 单子叶作物中TAC1的调控机制 在水稻中发现控制分蘖角的另一个关键基因是Os-TAC1[11]。通过对OsTAC1基因序列和构建进化树分析,发现OsTAC1在水稻驯化过程中是高度保守的,可能由OsLAZY1基因进化而来。而栽培稻及其祖先在TAC1序列编码区几乎没有自然突变和修饰,具有高度保守性,且核苷酸多态性仅在粳稻基因组中[13]。研究发现OsTAC1中第4个内含子3'剪接点处从A到G的SNP变异能够改变植株结构,并以此SNP成功开发荧光功能分子标记,有助于水稻植株结构的分子育种[18]。随后在玉米中其同源基因ZmTAC1被克隆,并发现该同源基因能够调控玉米叶夹角[20]。TAC1在水稻、小麦和玉米等作物中对株型的调控作用相似,均会导致分蘖角或叶片角度变大,株型松散。然而TAC1在不同作物组织中的表达量有差异,例如水稻中Os-TAC1主要在茎基部和分蘖节表达,而在穗中有微量表达(图2B)[11],可能会影响穗夹角或者水稻和玉米的穗大小。
2.2.2 双子叶中TAC1的调控机制 拟南芥中发现AtTAC1基因的表达受到光合作用信号的影响,且AtTAC1基因在黑暗和光照中表现出一定的表达规律。在黑暗或远红色光下,AtTAC1过表达会部分抑制拟南芥分枝角度变窄,而在长时间黑暗处理后AtTAC1基因表达受到抑制,使植株分枝角度增大[25]。TAC1能够响应光信号,在茎尖上除了观察到植物生长素激素水平表达较野生型高之外,水杨酸含量也显著偏高[27]。多数情况下,水杨酸被认为是一种植物抗逆性物质,而水杨酸与植物侧枝生长有关的研究较少。
虽未见关于TAC1基因受到重力信号转导的报导,但TAC1在调节植株株型结构上具有重要作用,尚不清楚TAC1调控株型的核心途径,因此具有很大挖掘空间。研究发现AtTAC1基因只在花瓣和花梗中高表达,茎中有少量表达(如图2A)[31],而在油菜中初步定位到C04染色体的候选基因BnaC04g00780D,该基因是TAC1的同源基因[49]。通过转录组数据进行组织特异性分析,发现油菜中的TAC1基因在根中基本不表达或者表达量很低,在花瓣和花梗中特异表达[31],这与拟南芥的同源基因AT2G46640表达部位相类似。TAC1作为调控分枝角的基因,也可能在花序等其他方面具有功能,其变异能够导致物种中多个农艺性状差异以及不同组织部位的特异性表达,因此该基因的功能鉴定在油菜育种中具有重要价值。
2.3 DRO1
根系通常顺着重力方向从上向下生长到土壤中,植株通过根系的深浅吸收生长和发育所需的水分和营养物质,以此调节植株地上部发育。主根通常垂直向下生长,而侧根通常遵循重力设定点的角度,以便它们探索周围的环境。这些反应可以被发育和环境改变。植株根系在自然界中具有高度可塑性,其主要生长方向至关重要,它指导植株对水分和养分的固定和吸收,可通过外源和内源信号的影响来改变其构型[50]。
2.3.1 单子叶作物中DRO1的调控机制DRO家族成员包括DRO1(LAZY4)、DRO2(LAZY3)、DRO3(LAZY2)。DRO1和DRO3在茎和根中均有表达,而DRO2只在根尖中微量表达,它们均在重力感应组织中响应向重力性,调控侧根向地性角度[31]。DRO1基因亚族能调节侧枝或侧根细胞中造粉体的沉降,以及由外排蛋白PIN产生的非对称生长素的分布[26]。自然条件下PIN蛋白位于根尖的细胞核内,当地下部重新定向后,PIN蛋白通过重力感应小柱细胞的极性定位,从而调节生长素分布[30]。研究发现水稻OsDRO1受生长素负调控,通过极性运输作用定向输送到根尖细胞中,生长素由TIR1/AFB蛋白和Aux/IAA蛋白组成瞬时共受体复合物感知,与共受体结合导致Aux/IAA的降解和ARF转录因子的抑制[51]。其转运是由不同生长素膜载体的不对称分布导致的,参与根尖细胞伸长,导致根系不对称生长和根系向下弯曲[4]。因此,生长素响应不同环境因素的下胚轴伸长,参与植物整个生命周期过程的生长发育,是分枝角度调控的重要植物激素。
2.3.2 双子叶中DRO1的调控机制 有研究表明,拟南芥中AtDRO2和AtDRO4的CCL结构域能够与RLD基因的BRX结构域发生互作,其中CCL域的βB与BRX域的β3相结合共定位在小柱细胞的质膜上,RLD1-4冗余在平衡小柱细胞中参与侧生根的角度控制和向地性,使PIN感受重力刺激发生重定位,从而调节PIN的生长素运输,导致不对称的生长素分布[28]。DRO1类亚族基因能够介导平衡细胞下侧造粉体沉降的重力信号传导,是因为DRO1类蛋白含有保守C端区域,能逆转突变体初级根的生长方向,在atlazy2;3;4多个突变体侧根尖端调节PIN3和生长素不对称分布,从而调节生长素极性运输的方向[23]。atdro1突变体会使侧根水平方向生长,在组成型启动子下At-DRO1的过表达导致更窄的侧根角度,包括地上部叶片卷曲和短小的角果,这些异位表型在IGT基因家族中的发现,与保守的C端EAR基序有关[24]。TOPLESS蛋白能与AUX/IAA蛋白的EAR基序结合,该蛋白可抑制植物生长素应答基因[7]。AtDRO1基因调控会受到光调节,一方面通过光照增加植株体内葡萄糖的积累,TOR途径抑制茉莉酸酯的合成,有研究发现茉莉酸甲酯(MeJA)是决定拟南芥LRs分枝角度的关键激素。MeJA使LRs向更垂直的方向倾斜,这依赖于规范的JAR1-COI1-MYC2,3,4信号。同时光信号能增强JA的生物合成,导致根构型直立;而葡萄糖靶向TOR信号通路拮抗MeJA反应,诱导更宽的侧根夹角[50]。因此光能拮抗Glc信号调节拟南芥的侧根夹角。另一方面促进HY5蛋白的积累来调节茉莉酸酯水平,抑制MYC2表达,从而调控AtDRO1的表达,同时通过光信号抑制PIFS蛋白降解,调控AtDRO1的表达,从而导致根和下胚轴的生长[29,50]。DRO1亚族在拟南芥中表达量极低,在油菜中的表达也很低[31],说明可能微量表达就能调控侧根生长方向和侧根的向地性,形成深根系结构。目前该亚族研究较少,其挖掘空间还很大,深入研究BnDRO1基因功能及其调控机制,有助于为研究深根系结构和提升作物抗旱性创造条件。
3 展望
作物分蘖(枝)和侧根角度调节是一个复杂的过程,内在因素、外部环境因素及其相互作用均对植物地上部和地下部形态构建产生影响。IGT基因家族是调控植株侧枝或侧根角度的功能性基因,其中LAZY1基因与TAC1基因均可以调节植株地上部株型形态,两者作用途径类似而调控功能相反,它们通过调节植株体内生长素极性运输和横向运输,导致生长素不对称分布。LAZY1基因主要响应重力信号,使植株体内生长素不对称分布,导致植株弯曲生长,过表达能使植株呈现紧凑的株型。TAC1基因主要响应光信号,过表达会使植株呈现松散的株型。DRO1基因主要响应重力信号,调节地下部根系结构功能,使侧根角度减小,产生深根表型,以此提高作物抗旱性,增加产量。此外DRO1亚家族成员也能响应光信号,具有部分调节地上部株型结构的能力。
本文总结了模式植物单子叶作物水稻和双子叶植物油菜、拟南芥在IGT基因家族调控中的差异和相关研究进展,发现IGT基因家族在单双子叶植物体内的功能类似,均能调节植株形态,但调控途径存在差异。单子叶作物主要在细胞核中与互作蛋白发挥LAZY1功能,而双子叶植物主要是在质膜上通过微管蛋白与LAZY1发生相互作用,调控株型结构。油菜作为双子叶作物,虽然在IGT基因家族中的研究较少,但油菜和拟南芥均属于十字花科植物,通过模式植物拟南芥分子调控途径猜测,油菜中核心调控基因BnLAZY1也会在质膜上通过微管互作蛋白调节分枝角和根夹角,为油菜株型形态研究提供理论基础。
LAZY1和TAC1基因通过单基因或多基因调控株型结构改变植物地上部株型。一方面紧凑的株型有利于油菜高密度种植、机械化收获和减少病虫害的发生,保证粮食生产安全,如OsDRO1基因在非生物胁迫环境中提高水稻产量[52];另一方面,松散的株型结构有利于造型植物提升欣赏价值,如彩花油菜,在观赏植物行业具有广泛的适用性。这为育种计划中开发分子辅助标记选择合适株型结构奠定了理论基础。DRO1基因能够产生深根系结构,增加地下部营养和水分的吸收,提升油菜抗旱性和抗倒伏能力。IGT基因家族可用于农作物理想株型形态改良,通过调控分枝角和侧根角度,培育高产、密植、适合机械化收获以及耐旱性优良理想品种,不仅为进一步深入研究理想株型形态奠定理论基础,还为农业高产和提升经济价值提供有利途径。

