葡萄籽原花青素及其柔性纳米脂质体的抗氧化及对酪氨酸酶活性的抑制作用*
窦 晨,丁 雄,潘 蕊,赵声兰,程 欣,3△
(1.云南中医药大学中药学院,云南 昆明 650500;2.云南省高校外用给药系统与制剂技术研究重点实验室,云南 昆明 650500;3.云南省傣医药与彝医药重点实验室,云南 昆明 650500)
人体黑色素的合成受黑色素生成途径中的多种黑素体蛋白和酶的调控[1],包括酪氨酸酶、酪氨酸酶相关蛋白1和多巴色素互变异构酶等。酪氨酸酶可催化2个黑色素生成的限速步骤,即酪氨酸羟基化为3,4-二羟基苯丙氨酸(L-DOPA)和将L-DOPA氧化为多巴醌[2],故黑色素的产生主要依赖于酪氨酸酶的表达和激活[3]。生理剂量的自由基在黑色素生成的最后阶段能加速5,6-二羟基吲哚和吲哚醌之间的反应,从而刺激黑色素的生成,增加皮肤的色素沉着[4]。葡萄籽原花青素(GSP)是从葡萄籽中提取的多酚化合物,是天然、低成本的抗氧化剂,具有抗氧化[5]、清除自由基[6]等药理学活性,但分子结构中的不饱和键降低了其储存的稳定性[7]。将GSP包载于柔性纳米脂质体(FL)中,可增加其稳定性和功能性。本研究中探讨了GSP及GSP-FL的抗氧化活性,以及对酪氨酸酶活性的影响,为制备具有美白功效的化妆品制剂提供参考。现报道如下。
1 仪器、试剂与细胞
1.1 仪器
OSB-2100型旋转蒸发仪(倍捷科技<上海>有限公司);90Plus型纳米激光粒度仪(美国布鲁克海文仪器公司);Sorvall ST 8R型高速冷冻离心机,Multiskan型酶标仪(美国Thermo Fisher Scientific公司);Discovery DV215CD型分析天平(美国奥豪斯公司,精度为0.0001 g);Scientz-IID型超声波细胞破碎仪(宁波新芝生物科技股份有限公司);PI80H型超声波处理器(德国Elma公司)。
1.2 试剂
GSP(天津市尖峰天然产物研究开发有限公司,批号为002200604028,纯度不低于95%);大豆卵磷脂(批号为1112J021),四甲基偶氮唑盐(MTT,批号为715F051),均购自北京索莱宝科技有限公司;胆固醇(批号为624J033),脱氧胆酸钠(批号为909P021,纯度大于99%),均购自北京兰杰柯科技有限公司公司;L-酪氨酸(批号为RH221350),酪氨酸酶(批号为R002875),三吡啶三吖嗪(TPTZ,批号为R012773),均购自上海凛恩科技发展有限公司;L-DOPA(美国Sigma公司,批号为WXBD0797V);曲酸(上海阿拉丁生化科技股份有限公司,批号为12002059);1,1-二苯基-2-三硝基苯肼(DPPH)自由基(上海源叶生物有限公司,批号为S28J12M138964);2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS,梯希爱<上海>化成工业发展有限公司,批号为KZTCI-AE);曲拉通X-100(TritonX-100,美国Amresco公司,批号为21B1756838);2-苯基-4,4,5,5-四甲基咪唑啉-1-氧基-3-氧化物(PTIO,九鼎化学<上海>科技有限公司,批号为YCLQJNY);七 水 合 硫 酸 亚 铁(FeSO4,批 号 为20200918),过氧化氢(H2O2,批号为20210201),均购自广东光华科技股份有限公司;水为超纯水。
1.3 细胞
小鼠永生化黑色素细胞系Melan-a细胞来源于广州医科大学,由云南中医药大学药剂教研室培养。
2 方法与结果
2.1 GSP-FL的制备(薄膜分散-超声法)
称取卵磷脂250 mg、胆固醇17 mg,精密称定,分别溶于15 mL氯仿;称取脱氧胆酸钠15 mg,溶于5 mL甲醇,超声溶解。将上述3种溶液置圆底烧瓶中,混匀。40℃水浴条件下以旋转蒸发仪去除有机溶剂,直至烧瓶内壁形成干燥、透明的均匀薄膜。称取GSP 80 mg,溶于6 mL水,置圆底烧瓶中,40℃水浴条件下继续旋转30 min,冰浴条件下超声(功率为150~180 W,频率为20~25 kHz)处理5 min,0.22 μm微孔滤膜滤过,4℃条件下密封保存。在前期优化制备工艺的基础上制备GSP-FL[8],采用超速离心法测定,其包封率为(70.79±0.02)%,载药量为(1.16±0.01)%,粒径为(156.47±7.03)nm,多 分 散系数为0.26±0.01,Zeta电位为-(42.35±4.00)mV。
2.2 GSP及GSP-FL的抗氧化活性
2.2.1 DPPH自由基清除率测定
取DPPH自由基2 mg,精密称定,置50 mL容量瓶中,用无水乙醇定容,即得质量浓度为0.04 mg/mL的DPPH自由基溶液,避光保存,现配现用。采用80%乙醇溶解维生素C(VC),采用无水乙醇溶解GSP及GSP-FL,配制成质量浓度分别为3.13,6.25,12.5,25,50 μg/mL的待测试样溶剂。于96孔板[9]中加入各反应液,50 μL待测试样溶剂和150 μL DPPH自由基溶液为A0,150 μL DPPH自由基溶液及50 μL待测试样为A1,50 μL待测试样和150 μL待测试样溶剂为A2。37℃条件下反应30 min,采用酶标仪于519 nm波长处测定吸光度。VC为阳性对照,A2为空白对照,以空白柔性纳米脂质体(EL)排除脂质体对吸光度的干扰。DPPH自由基清除率(%)=[1-(A1-A2)/A0]×100%。采用SPSS 26.0统计学软件进行回归分析,并计算半数抑制浓度(IC50)。
结果见图1。可见,在3.13~50 μg/mL质量浓度范围内,VC,GSP,GSP-FL对DPPH自由基的清除率均逐渐增加;对DPPH自由基的IC50分别为(15.277±2.392)μg/mL、(9.791±0.615)μg/mL、(9.271±0.424)μg/mL。GSP与GSP-FL表现出比VC更好的DPPH自由基清除活性。EL对DPPH自由基的活性无影响。

图1 GSP,GSP-FL,VC对DPPH自由基的清除率Note:Compared with Vc,aP<0.05(for Fig.1-4).Fig.1 Scavenging rates of GSP,GSP-FL and VC on the DPPH free radical
2.2.2 ABTS+自由基清除率测定[10]
取过硫酸钾13.40 mg和ABTS 38.40 mg,精密称定,分别置25 mL容量瓶中,用纯水充分溶解并定容,置烧杯中1∶1混匀,室温避光放置12 h,即得ABTS+自由基贮备液;使用前用纯水稀释10~20倍,直至吸光度为0.70±0.02,即得ABTS+自由基工作液。采用80%乙醇溶解VC,采用无水乙醇溶解GSP及GSP-FL,配制成质量浓度分别为1.56,3.13,6.25,12.5,25 μg/mL的溶液。于96孔板中加入各反应液,75 μL待测试样溶剂和75 μL ABTS+自由基工作液为A0,75 μL ABTS+自由基工作液及75 μL待测试样为A1,75 μL待测试样和75 μL待测试样溶剂为A2。室温下反应6 min,采用酶标仪于734 nm波长处测定吸光度。VC为阳性对照,A2为空白对照。ABTS+自由基清除率(%)=[1-(A1-A2)/A0]×100%。
结果见图2。可见,在1.56~25 μg/mL质量浓度范围内,VC,GSP,GSP-FL对ABTS+自由基的清除率均逐渐增加;对ABTS+自由基的IC50分别为(12.387±1.79)μg/mL、(10.722±1.80)μg/mL、(10.403±2.33)μg/mL。GSP,GSP-FL,VC的ABTS+自由基清除活性相似。EL对ABTS+自由基的活性无影响。
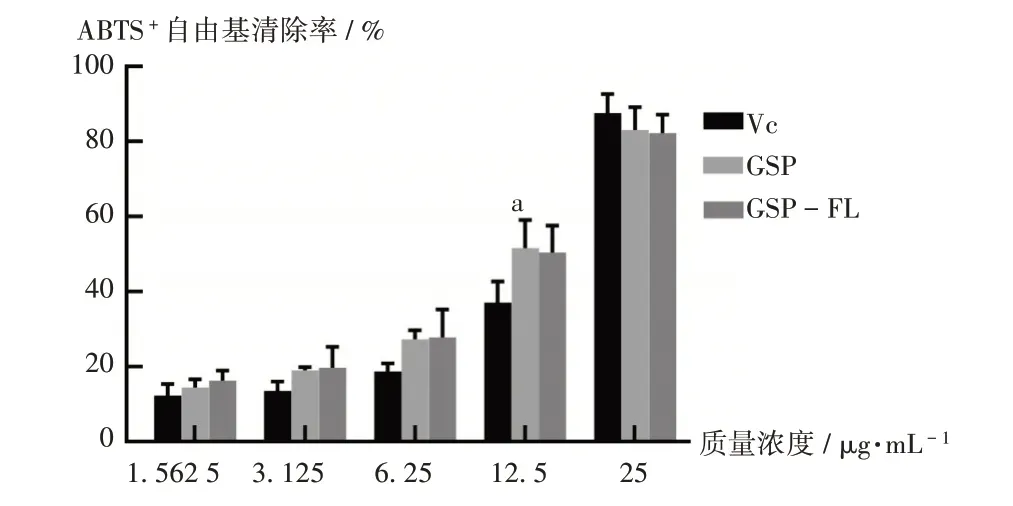
图2 GSP,GSP-FL,VC对ABTS+自由基的清除率Fig.2 Scavenging rates of GSP,GSP-FL and VC on the ABTS+free radical
2.2.3 PTIO自由基清除率测定[11]
取PTIO自由基10 mg,精密称定,置50 mL容量瓶中,用纯水定容,即得PTIO自由基工作液。用纯水溶解VC,GSP,GSP-FL,配制成质量浓度分别为0.0125,0.025,0.05,0.1,0.2,0.4 mg/mL的溶液。于96孔板中加入各反应液,40 μL纯水和160 μL PTIO自由基工作液为A0,160 μL PTIO自由基工作液及40 μL待测试样为A1,40 μL待测试样和160 μL纯水为A2。37℃条件下静置30 min,采用酶标仪于557 nm波长处测定吸光度。以VC为阳性对照。PTIO自由基清除率(%)=[1-(A1-A2)/A0]×100%。
结果见图3。可见,在0.0125~0.4 mg/mL质量浓度范围内,VC,GSP,GSP-FL对PTIO自由基的清除率均逐渐增加;对PTIO自由基的IC50分别为(0.097±0.001)mg/mL、(0.220±0.056)mg/mL、(0.187±0.037)mg/mL。GSP与GSP-FL表现出对PTIO自由基的清除活性,但效果不如VC。GSP-FL质量浓度为0.0125~0.1 mg/mL时,对PTIO自由基的清除率显著高于VC(P<0.05)。EL对PTIO自由基的活性无影响。
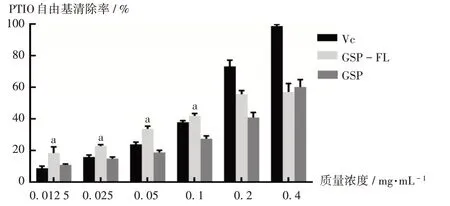
图3 GSP,GSP-FL,VC对PTIO自由基的清除率Fig.3 Scavenging rates of GSP,GSP-FL and VC on the PTIO free radical
2.2.4 铁离子(Fe3+)还原能力测定[10]
取TPTZ粉末7.8 mg,精密称定,溶于2.5 mL 40 mmol/L盐酸溶液中,超声(功率为80 W,频率为40 kHz)使其完全溶解,即得10 mmol/L TPTZ溶液;取27.029 mg氯化铁,精密称定,置10 mL容量瓶中,用纯水溶解并定容,即得10 mmol/L氯化铁溶液;将300 mmol/L醋酸盐缓冲液、10 mmol/L TPTZ溶液和10 mmol/L氯化铁溶液按10∶1∶1混匀,即得Fe3+抗氧化能力工作液。取FeSO450.59 mg,精密称定,置25 mL容量瓶中,用纯水溶解并定容,梯度稀释成浓度分别为0.5,1,1.5,2,2.5,3,3.5 mmol/L的FeSO4标准溶液。在96孔板中加入不同浓度的FeSO4溶液20 μL,再加入180 μL Fe3+抗氧化能力工作液,在37℃条件下恒温孵育6 min,采用酶标仪于593 nm波长处测定吸光度。以FeSO4溶液的浓度为横坐标(X)、吸光度为纵坐标(Y)进行线性回归,得标准曲线Y=1.009X+0.2084(R2=0.9927,n=7)。在96孔板中加入20 μL质量浓度分别为0.05,0.1,0.2 mg/mL的GSP,GSP-FL,VC溶液,再加入180 μL Fe3+抗氧化能力工作液,37℃条件下恒温孵育6 min,采用酶标仪于593 nm波长处测定吸光度。样品溶液对Fe3+的还原能力以FeSO4含量表示,以VC为阳性对照。根据标准曲线测定GSP,GSP-FL,VC溶液对Fe3+的还原能力。
结果见图4。可见,在0.05~0.2 mg/mL质量浓度范围内,GSP,GSP-FL,VC对Fe3+的还原能力均逐渐增强,但GSP和GSP-FL的还原能力不如VC。EL对Fe3+的还原能力无影响。
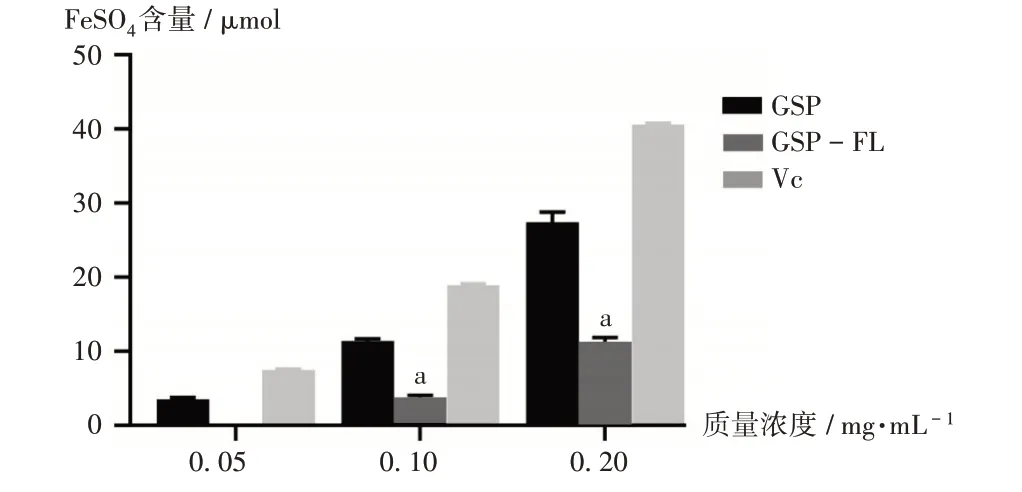
图4 GSP,GSP-FL,VC对Fe3+的还原能力Fig.4 Reduction abilities of GSP,GSP-FL and VC on the Fe3+
2.3 GSP对H2O2诱导Melan-a细胞氧化损伤的保护作用
2.3.1 GSP及GSP-FL对Melan-a细胞的毒性(MTT法)
取处于对数生长期的Melan-a细胞,胰蛋白酶消化,离心(转速为800 r/min)3 min,采用血细胞计数法调整细胞悬液的密度为7.5×105/mL,接种于96孔板,每孔100 μL,置细胞培养箱(温度为37℃,CO2浓度为5%,下同)中培养24 h,弃去细胞培养基;每孔分别加入100 μL质量浓度分别为0.0125,0.025,0.05,0.1,0.2,0.4,0.8 mg/mL的GSP及GSP-FL溶液,每个质量浓度设5个复孔,重复试验3次。另设阴性对照组(等量的细胞+细胞培养液)与空白对照组(等量的细胞培养液),于细胞培养箱中分别培养24 h和48 h。加入20 μL质量浓度为5 mg/mL的现配MTT溶液,于细胞培养箱中孵育4 h,弃去上清液。每孔加入150 μL二甲基亚砜,振摇10 min,充分溶解,采用酶标仪于490 nm波长处测定吸光度。细胞抑制率(%)=[1-(AGSP/GSP-FLA空白对照组)/(A阴性对照组-A空白对照组)]×100%。
结果见图5。可见,与GSP-FL相比,给药24 h后,GSP质量浓度为0.0125~0.8 mg/mL时的细胞毒性较强,且48 h时的细胞毒性更强。给药24 h和48 h后,GSP-FL的平均IC50为(0.443±0.09)mg/mL和(0.137±0.00)mg/mL,显著高于GSP的(0.140±0.40)mg/mL和(0.049±0.01)mg/mL(P<0.05)。GSP-FL降低了游离药物的细胞毒性,提高了细胞的存活率。故推测将GSP包载于FL中可显著增加药物的安全性。EL质量浓度为0.8 mg/mL时,对Melan-a细胞的抑制率为(25.2±9.99)%,随着其不断稀释,抑制率降低,故EL毒性较低。
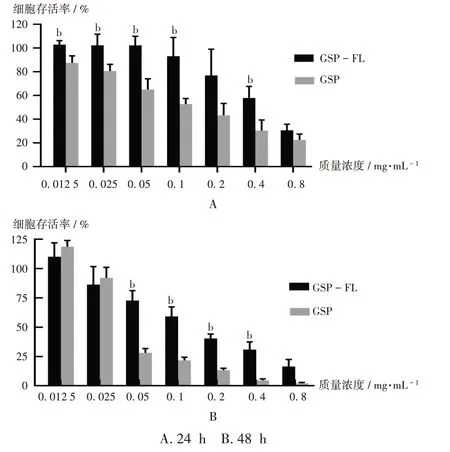
图5 加入GSP和GSP-FL后Melan-a细胞的存活率(n=3)A.24 h B.48 hNote:Compared with those with GSP,bP<0.05.Fig.5 Survival rates of Melan-a cells after adding GSP and GSP-FL(n=3)
2.3.2 H2O2诱导Melan-a细胞氧化损伤模型的建立
取处于对数生长期的Melan-a细胞,用含有10%胎牛血清的1640完全培养液稀释,直至细胞悬液的密度为5×104/mL,接种于96孔板,每孔100 μL,置细胞培养箱中培养48 h,弃去上清液,每孔加入100 μL 25,50,100,200,400,800 μmol/L的H2O2溶液,造模8 h,每个浓度设置5个复孔,重复试验3次。另设阴性对照组(等量的细胞+细胞培养液)与空白对照组(等量的细胞培养液)。计算细胞抑制率。结果H2O2溶液浓度为25,50,100,200,400,800 μmol/L时,Melan-a细胞抑制 率 分 别 为(9.11±5.81)%、(16.69±9.60)%、(40.95±3.52)%、(63.18±4.64)%、(91.09±3.04)%、(93.21±2.26)%(n=3)。
2.3.3 GSP对H2O2诱导Melan-a细胞氧化损伤的保护作用(MTT法)[12]
前期试验考察了150,250 μmol/L H2O2的作用,结果其浓度为250 μmol/L时,GSP组的保护作用与模型组相比,具有显著差异(P<0.05)。故将细胞分为4组,即阴性对照组(等量的细胞+细胞培养液)、空白对照组(等量的细胞培养液)、模型组(250 μmol/L H2O2)、不同质量浓度(6.25,12.5,25,50 mg/mL)的GSP组。按2.3.2项下方法将Melan-a细胞均匀接种于96孔板,空白对照组仅加入等量培养液,培养24 h,弃去上清液。GSP组分别加入含不同质量浓度GSP的培养液100 μL,在空白对照组、阴性对照组和模型组中加入等量的培养液,培养24 h,弃去上清液。在模型组和GSP组中分别加入100 μL 250 μmol/L的H2O2溶液,在空白对照组、阴性对照组中加入等量培养液。将96孔板转移至细胞培养箱中培养8 h,计算细胞抑制率。
结果见图6。可见,与模型组比较,GSP质量浓度为12.5~50 mg/mL时,能显著增加H2O2造成的氧化损伤细胞的存活率(P<0.05);但GSP质量浓度为50 mg/mL时,其保护作用低于25 mg/mL,推测在质量浓度为50 mg/mL时,H2O2对细胞仍有一定毒性。由于FL减少了H2O2与细胞的直接接触,降低了药物对细胞的刺激性。
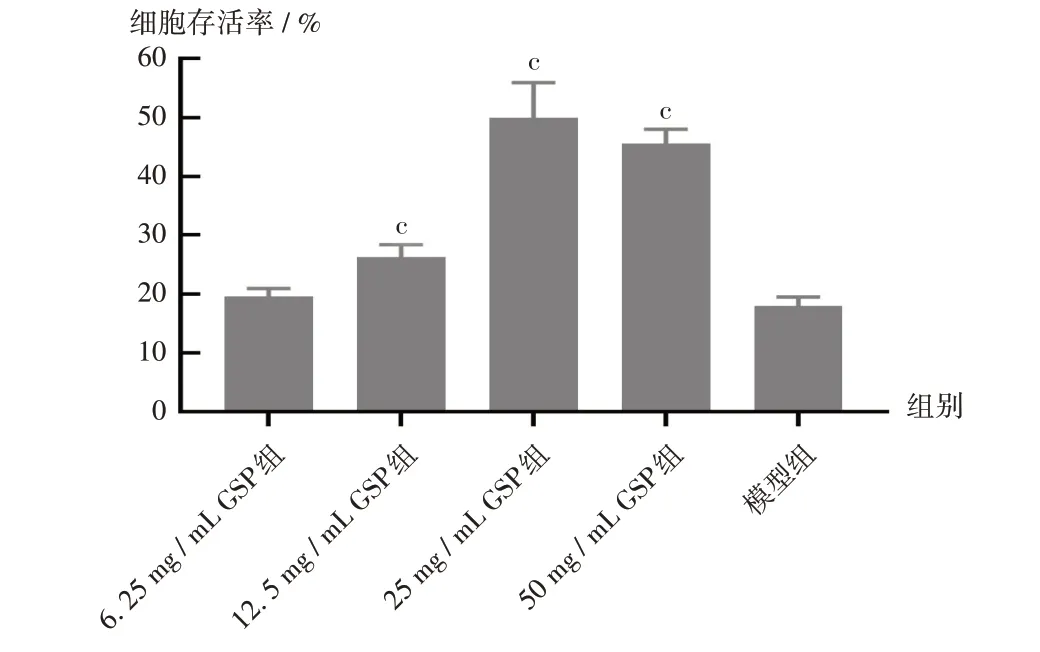
图6 不同GSP质量浓度对氧化损伤Melan-a细胞存活率的影响Note:Compared with those in the model group,cP<0.05.Fig.6 Effects of GSP with different mass concentrations on the survival rates of oxidatively damaged Melan-a cells
2.4 GSP和GSP-FL对体外酪氨酸酶活性的影响
2.4.1 对酪氨酸酶单酚酶及二酚酶活性的影响
以2.0 mmol/L的酪氨酸溶液或2.0 mmol/L的L-DOPA为底物,按表1进行反应,采用96孔板,在200 μL测活体系中加入浓度为2.0 mmol/L的酪氨酸溶液(或L-DOPA)和磷酸盐缓冲液,置37℃培养箱中预热10 min,加入质量浓度为0.1,0.2,0.4,0.8 mg/mL的GSP,GSP-FL溶液各50 μL及质量浓度为0.003,0.006,0.012,0.025,0.05 mg/mL的曲酸溶液50 μL,加入质量浓度为150 U/mL酪氨酸酶溶液50 μL,置37℃培养箱中继续反应15 min,采用酶标仪于475 nm波长处测定吸光度。抑制率(%)=[(A1-A2)-(A3-A4)]/(A1-A2)×100%。

表1 体外酪氨酸酶活性试验反应液组成(μL)Tab.1 Composition of reaction solution for tyrosinase activity test(μL)
结果显示见图7。可见,曲酸质量浓度低于0.05 mg/mL时,对酪氨酸单酚酶及二酚酶活性均有抑制作用;GSP和GSP-FL对酪氨酸酶活性的抑制作用均随质量浓度的升高而降低。GSP-FL对酪氨酸单酚酶的IC50约为GSP的2倍,对酪氨酸二酚酶的IC50约为GSP的3.5倍。详见表2。
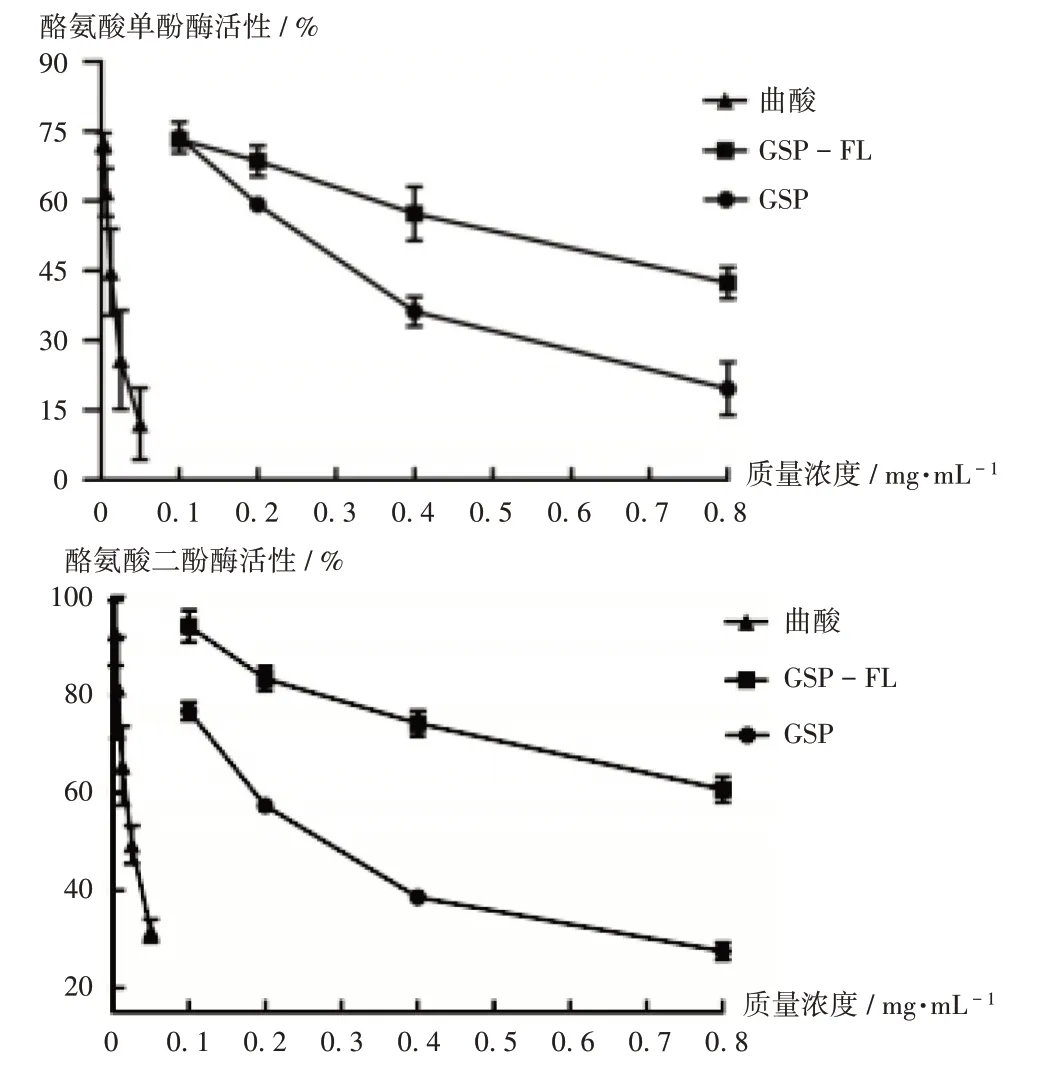
图7 GSP和GSP-FL、曲酸对酪氨酸酶单酚酶及二酚酶的活性作用Fig.7 Effects of GSP,GSP-FL and kojic acid on the monophenolase and diphenolase activities of tyrosinase
表2 对酪氨酸酶单酚酶及二酚酶作用的IC50(±s,mg/mL)Tab.2 IC50 of GSP,GSP-FL and kojic acid on the monophenolase and diphenolase of tyrosinase(±s,mg/mL)

表2 对酪氨酸酶单酚酶及二酚酶作用的IC50(±s,mg/mL)Tab.2 IC50 of GSP,GSP-FL and kojic acid on the monophenolase and diphenolase of tyrosinase(±s,mg/mL)
注:与曲酸比较,dP<0.05。表3和表4同。Note:Compared with those with kojic acid,dP<0.05(for Tab.2-4).
试剂GSP GSP-FL曲酸酪氨酸二酚酶0.294±0.011.057±0.03d 0.024±0.01酪氨酸单酚酶0.243±0.000.503±0.08d 0.010±0.00
2.4.2 酶促动力学反应
固定底物L-DOPA溶液的浓度为2 mmol/L,分别配制浓度为20,40,60,80,100 U/mL的酪氨酸酶溶液及质量浓度为0.05,0.1,0.2,0.4,0.8,1.6 mg/mL的GSP溶液,按表1进行反应,测定GSP对酪氨酸酶的抑制机制,得到酶活性随酶量变化的关系图(图8),酶活性对酶量是一条相对的直线,随着待测样品溶剂质量浓度的升高,酶活性减少。提示GSP是通过抑制酶活性而不是减少有效酶量来降低对L-DOPA的催化效率的。
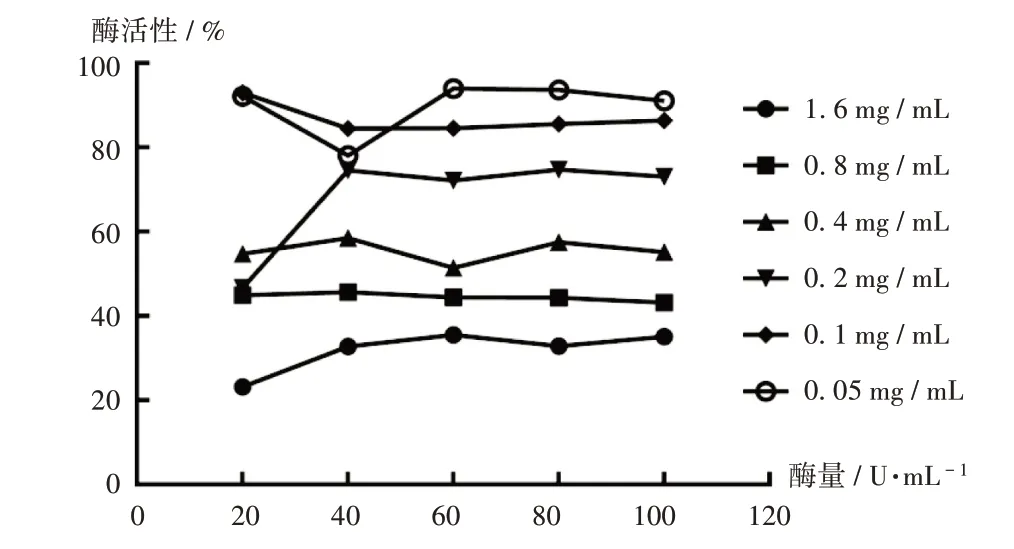
图8 GSP对酪氨酸酶的抑制效应机制Fig.8 Mechanism of inhibitory effect of GSP on tyrosinase
2.5 GSP和GSP-FL对细胞内酪氨酸酶活性的影响
2.5.1 Melan-a细胞胞内酪氨酸酶抑制率[12-14]
取对数生长期的Melan-a细胞,胰蛋白酶消化,调整细胞悬液的密度为2.5×105/mL,并接种于6孔板中,培养24 h。加入含不同质量浓度GSP、GSP-FL及曲酸的培养基,另设阴性对照(等量的细胞+细胞培养液)。培养24 h和48 h,弃去培养基,加入500 μL 1% TritonX-100溶液,静置5 min。用细胞刮刀刮下每孔中的细胞,置冰面充分裂解1 h,冷冻,离心(转速为14000 r/min)10 min。取上清液100 μL,加入96孔板中,置37℃培养箱中预热10 min。加入3 mmol/LL-DOPA溶液100 μL,继续反应1 h,采用酶标仪于475 nm波长处测定吸光度,每个浓度设置3个复孔,同时设置空白孔(100 μL 1%TritonX-100和100 μL 3 mmol/LL-DOPA),重复3次 试 验。酪 氨 酸 酶 活 性(%)=(AGSP/GSP-FL/曲酸-A空白对照组)/(A阴性对照组-A空白对照组)×100%。
结果见表3。可见,随着作用时间的增加,GSP及GSP-FL对酪氨酸酶活性的抑制作用均逐渐增强。24 h后,在质量浓度为0.8 mg/mL的GSP及GSP-FL作用下,Melan-a细胞胞内酪氨酸酶活性显著低于曲酸(P<0.05);48 h后,在质量浓度为0.4 mg/mL的GSP及GSP-FL作用下,Melan-a细胞胞内酪氨酸酶活性显著低于曲酸(P<0.05)。

表3 GSP及GSP-FL、曲酸对细胞内酪氨酸酶活性的影响(n=3)Tab.3 Effects of GSP,GSP-FL and kojic acid on the activity of intracellular tyrosinase(n=3)
2.5.2 Melan-a细胞胞内黑色素含量
取对数生长期的Melan-a细胞,胰蛋白酶消化,调整细胞悬液的密度为2.5×105/mL,并接种于6孔板中,培养24 h。加入含不同质量浓度GSP-FL及曲酸的培养基,另设阴性对照组(等量的细胞+细胞培养液),培养24 h或48 h,弃去培养基。加入500 μL 1%TritonX-100溶液,静置5 min,用细胞刮刀刮下每孔中的细胞,置冰面上充分裂解1 h,冷冻,离心(转速为14000 r/min)10 min。取离心后的细胞黑色素沉淀,加入100 μL 1 mol/L NaOH溶液(含10%二甲基亚砜)中,80℃条件下加热1 h至完全溶解,采用酶标仪于405 nm波长处测定吸光度,重复3次试验。黑色素含量(%)=(AGSP-FL/曲酸)/A阴性对照组×100%。
结果见表4。可见,随着GSP-FL质量浓度的升高和作用时间的延长,黑色素的合成均减少。24 h后,GSP-FL质量浓度为0.8 mg/mL时,Melan-a细胞胞内黑色素含量显著低于曲酸组(P<0.05);48 h后,GSP-FL质量浓度为0.4 mg/mL时,细胞胞内黑色素含量显著低于曲酸组(P<0.05)。因药物本身存在的颜色会干扰黑色素吸光度的测定,且无法通过试验设计进行排除,故未对GSP进行测定。
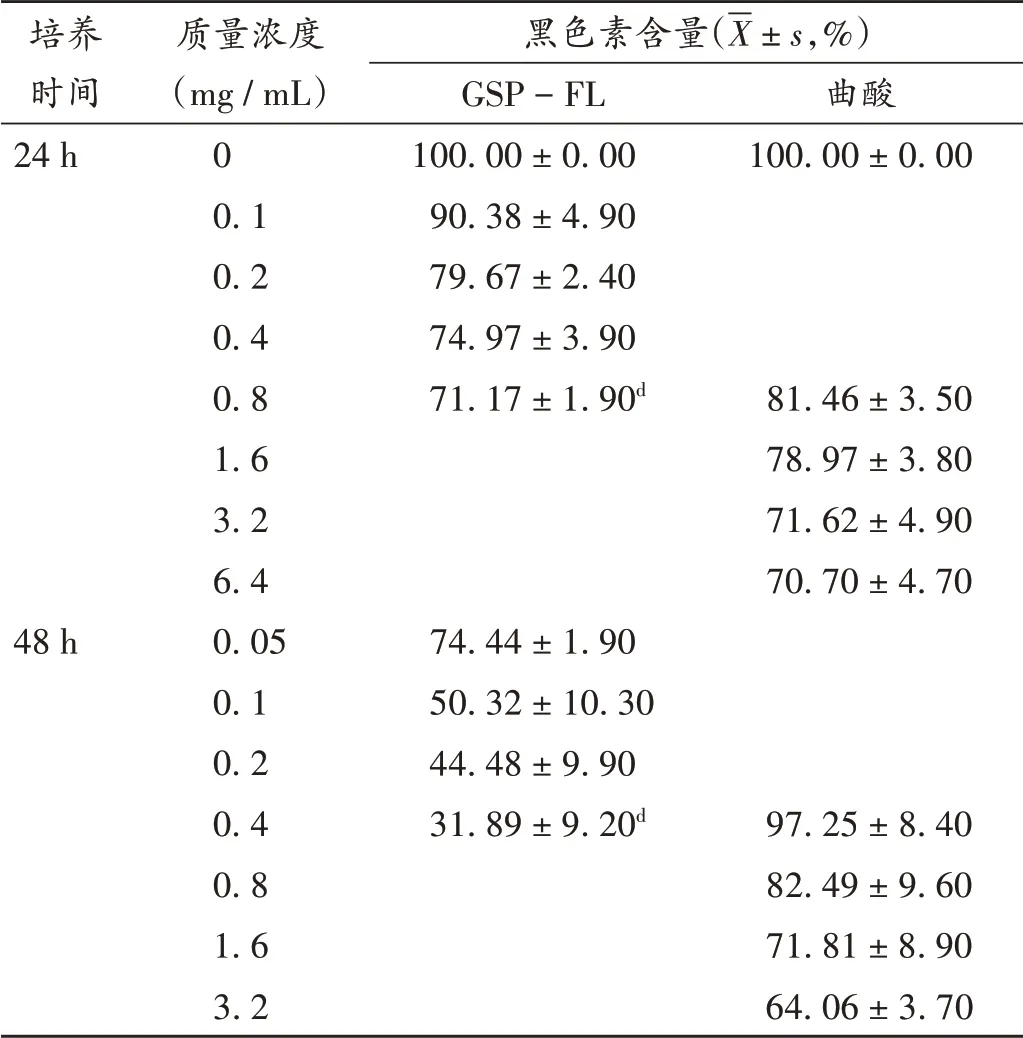
表4 GSP-FL对细胞内黑色素合成的影响(n=3)Tab.4 Effect of GSP-FL on the synthesis of intracellular melanin(n=3)
3 讨论
多数体外抗氧化的检测方法仅能评价化合物清除某一种自由基的能力,且各有优、缺点,各种方法联用才能更好地反映某化合物的抗氧化活性。本研究中通过测定GSP及GSP-FL对DPPH,ABTS+,PTIO自由基的清除能力及对Fe3+的还原能力,综合评价其抗氧化活性,结果表明GSP及GSP-FL均具有良好的抗氧化活性,对DPPH和ABTS+自由基的IC50均低于VC。早有研究报道,GSP是比VC和维生素E琥珀酸乙酯更强的自由基清除剂[15]。GSP能显著增加H2O2氧化损伤细胞的存活率,降低细胞的氧化损伤程度,但其作用机制需作进一步研究。
体外酶学试验结果显示,GSP和GSP-FL均表现出对酪氨酸单酚酶及二酚酶的抑制作用;但GSP-FL对酪氨酸单酚酶及二酚酶的抑制率显著低于GSP,推测可能是由于FL外壳对药物的保护作用,在缺乏破乳剂的情况下,药物未突释出来。MTT试验结果显示,GSP会抑制正常Melan-a细胞的增殖,将GSP包载于FL中,显著降低了药物的细胞毒性。推测可能是由于脂质体的磷脂双分子层外壳较安全,可减少药物与细胞的直接接触,从而降低了药物对细胞的刺激性。在细胞试验中,GSP及GSP-FL表现出对Melan-a细胞内酪氨酸酶活性、黑色素生成的抑制作用。皮肤美白剂的功能应在安全的药物剂量下减少细胞内黑色素的合成,不能因为过多的黑色素细胞死亡而使局部的皮肤颜色变浅,影响美观,甚至在无黑色素的保护作用下,导致皮肤晒伤[16-17]。GSP-FL在抑制细胞胞内酪氨酸酶活性和黑色素生成的同时,降低了细胞毒性,减少了黑色素细胞的死亡。
综上所述,GSP-FL具有清除自由基、抗氧化、抑制酪氨酸酶活性和黑色素生成的作用,相比游离GSP和GSP-FL还能降低对正常细胞的毒性。有望将GSP-FL进一步开发成凝胶剂、乳膏剂等具有美白功效的化妆品制剂,但美白是多重酶、多种因素共同作用的结果,其药理作用和药效机制还需进一步验证。

