基于不良事件报告系统的两性霉素B相关死亡事件数据挖掘研究
张丹丹
(遵义市第一人民医院,遵义医科大学第三附属医院,贵州 遵义 563000)
两性霉素B (AmB) 属于多烯类抗真菌药,通过与真菌细胞膜上的麦角固醇结合,构成相通的细胞膜管状离子通道,从而导致胞内钾离子外流引起真菌死亡[1]。AmB具有广泛的抗真菌活性,也是一种高效的抗寄生虫药物。虽然AmB已使用了半个多世纪,但其耐药菌株仍很少见,且其价格适中,目前仍然是临床抗深部真菌感染药物的首选,如隐球菌脑膜炎、曲霉属肺部真菌感染及免疫力低下患者真菌感染等。但研究表明[2],AmB在治疗侵袭性真菌感染过程中,由于其使用剂量较大且疗程长,易发生不良反应。肾功能损害是AmB最严重的不良反应,发生率为26%~34%[3];有报道[6-7]低钾血症的发生率为17%~43%[4],且难以纠正。临床常见其他不良反应有肝损害、多尿、静脉炎、发热等,不良事件高发限制其在临床的使用,提示我们需加强AmB的安全性监测与评价。AmB自1960年上市以来[5],已在临床治疗中积累了大量的安全性数据。而美国FDA不良事件报告系统每年可收到约150 万份关于药品及疫苗等的不良事件信息报告,该数据库信息多样、数据量大且对公众免费开放,而报告这些药品不良事件信息大部分来自医护人员、药师、药品生产企业等专业人员及其他各职业人员,因此美国食品药品监督管理局(FDA)不良事件报告系统(FAERS)数据库的信息均来自真实世界,故常被用于药品不良事件信号挖掘研究,对药品安全性监测与评价具有重要意义[6]。目前常用科学运用比例失衡分析算法(DPA)及关联规则挖掘算法(ARM)等数据挖掘技术来进行不良反应信号挖掘。本研究采用 DPA 算法,基于免费开放的 FAERS数据库对AmB相关的死亡事件进行数据挖掘,以期优化患者治疗方案,为临床安全合理使用AmB提供参考依据。
1 数据与方法
1.1 数据来源
1.1.1 数据源
本研究数据来源于FAERS,该数据库所有不良事件信息来自自发呈报,且每季度进行更新,对全球开放,提供免费下载。本研究下载了2004年1月—2020年12月ASCII 数据,提取个人信息记录(DEMO)、药物使用记录(DRUG)、不良事件记录(REAC)及适应证/诊断(IN-DI)数据表进行分析。
1.1.2 药品名标准化
采用美国 Vanderbilt 大学开发的 Medex_UIMA_1.3.7 系统进行药品名称标准化和RXNorm 编码(RxCUI)[7-8]。
1.1.3 药品不良事件编码系统
FAERS数据库中不良事件均采用《ICH 国际医学用语词典》(MedDRA)的首选语(PT)对不良反应进行编码[9]。下载 MedDRA 21.1 版,用于PT编码和语言汉化[10]。
1.2 数据处理
1.2.1 数据清洗
去除DEMO重复报告并保存最新记录。药品名、药物不良事件(ADEs)标化分别采用 Medex_UIMA_1.3.7 系统和 MedDRA 21.1进行整理。
1.2.2 数据提取
提取标化后DRUG 表中对应AmB记录作为目标药品。筛选REAC表中PT 编码为 10 011 906(死亡)、10 042 062(死产)、10 011 912(新生儿死亡)、10 049 993(心源性死亡)、10 049 418(心源性猝死)的记录,作为“直接死亡事件”,再筛选患者结局(OUTC)表中“数字提取(DE)”的记录,去除直接死亡事件后,作为“间接死亡事件”。
1.2.3 数据分析
本研究采用比例报告比值法(PRR)和报告比值比法(ROR)进行不良反应信号的挖掘,主要依据四格表算法[11](见表1)。以a≥3计算PRR值及ROR值95%可信区间(95%CI),下限均>1作为有效信号生成(见表2),提示该药物与目标不良事件具有统计学关联。采用SPSS 22.0软件和Microsoft Excel 2016软件统计分析。

表1 比例失衡法四格表

表2 ROR法与PRR法公式及阈值
2 结 果
2.1 不良事件报告情况
清洗数据后,得到9 590 312 份药品不良事件报告,AmB相关报告6 801 条,AmB相关直接死亡事件报告174 条(2.56%),间接死亡事件报告1 307条(19.22%),死亡者中位年龄61 岁;老年患者约占31.47%;经静脉给药报告占已知给药途径报告例数的86.43%。AmB相关死亡事件报告基本信息见表3,AmB相关死亡事件报告数量前10位国家见表4,AmB相关死亡事件逐年报告数量见图1。
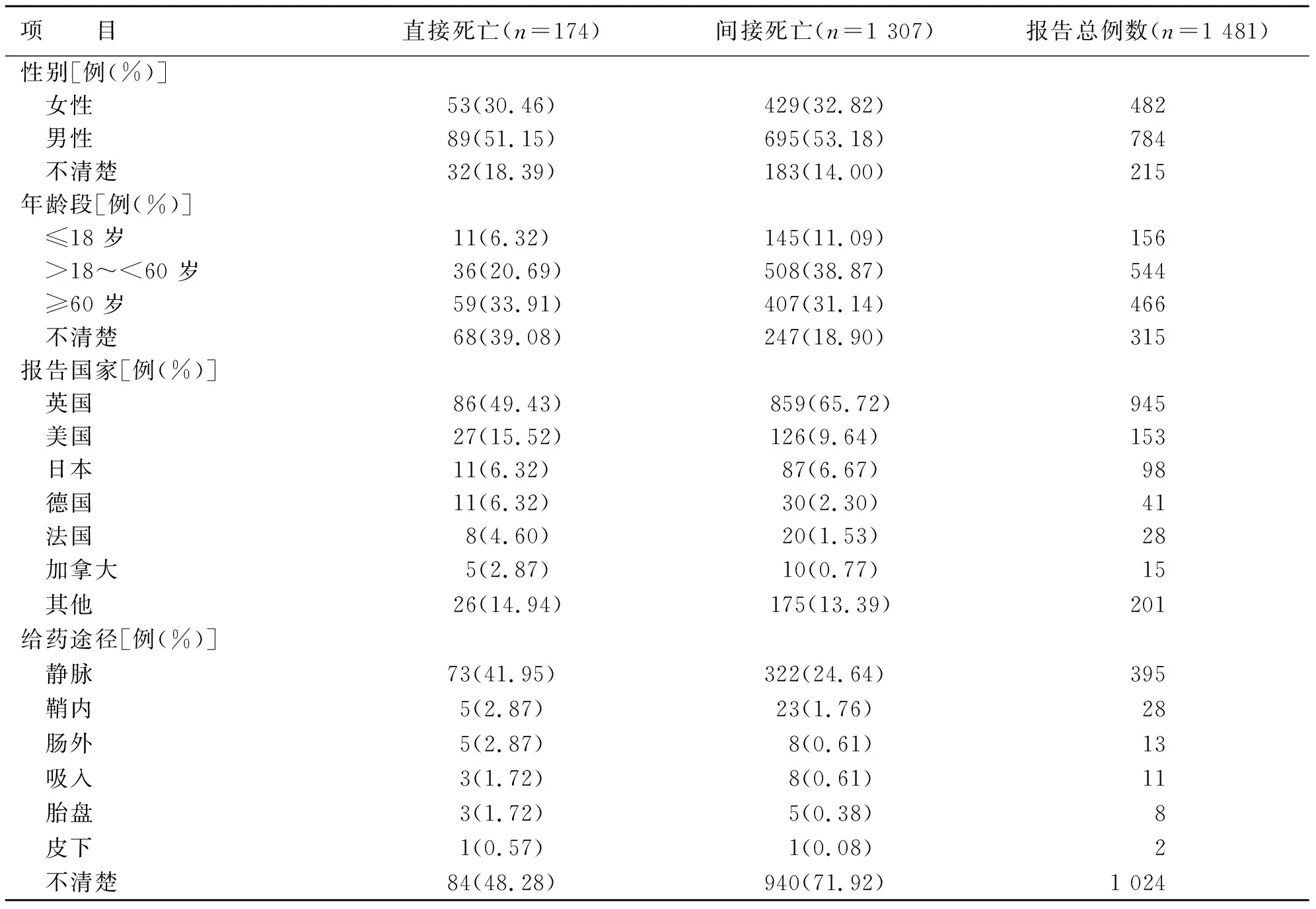
表3 AmB相关死亡事件报告的基本信息

图1 2004年-2020年AmB相关死亡事件报告数量
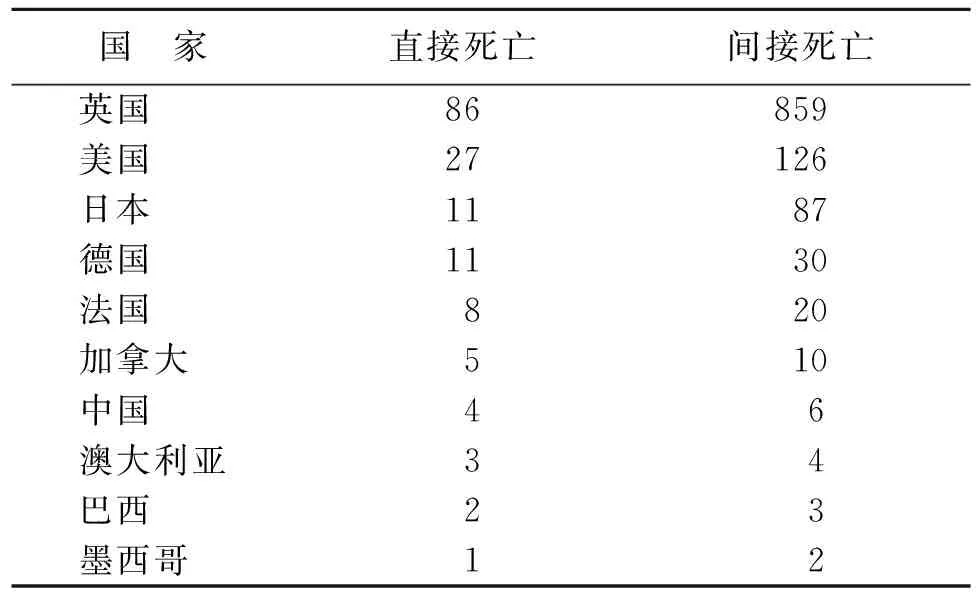
表4 2004年—2020年AmB相关死亡 事件报告前10位的国家
2.2 信号检测结果
本研究检测报告共计1 481 例,经ROR和PRR法信号检测均提示直接死亡和间接死亡事件生成信号。而直接死亡进行亚组分析时发现“死亡”的ROR=33.47,PRR=34.05,两种方法检测均提示生成信号且检测结果基本一致,提示应高度重视AmB死亡事件这一信号。AmB相关死亡事件信号检测结果见表5。

表5 AmB相关死亡事件的信号检测结果
2.3 两性霉素B的使用情况分析
纳入研究报告中221 例有详细的AmB日剂量数据。药品说明书常见AmB的用法用量为1~5 mg或按0.02~0.10 mg/kg,静脉滴注,每日1 次。然后根据患者耐受情况隔日或每日增加5 mg,当最高一日剂量增加至1 mg/kg时停止增加。临床上AmB使用剂量:日剂量均值为1.47 mg/kg,中位日剂量为1.05 mg/kg,最大使用日剂量500 mg/d,最
小使用日剂量0.25 mg/d。目前在国家食品药品监督管理总局网站上查询AmB共有2 个厂家品种且说明书推荐最大日剂量均为1 mg/kg。
本研究报告中,有75.11%的患者AmB日剂量在说明书范围内,但有14 例(6.33%)患者AmB日剂量超过3 mg/kg、32 例(14.48%)患者AmB日剂量超过5 mg/kg、4 例(1.81%)患者AmB日剂量超过10 mg/kg、2 例(0.09%)患者AmB日剂量超过50 mg/kg,3 例(1.36%)患者经气溶吸入日剂量超过300 mg/d,均明显超过说明书推荐剂量上限。相关死亡事件中AmB剂量分析见表6。
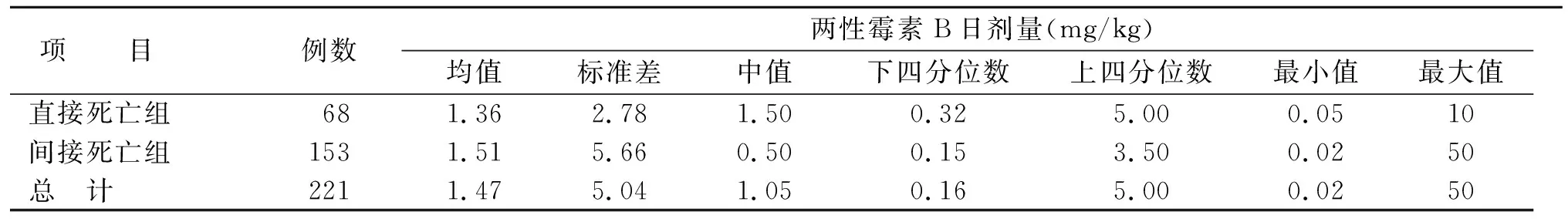
表6 死亡事件中AmB剂量分析
2.4 合并用药分析
本研究纳入患者1 481 例,每人平均用药2.13 种,单个用药最多19 种药品。用药分析发现死亡病例用药频率从高到低的品种依次为糖肽类抗菌药(万古霉素201 例)、糖皮质激素(泼尼松115 例)、钙调神经磷酸酶抑制剂(他克莫司101 例,环孢素92 例)、磺胺类抗菌药(磺胺甲恶唑/甲氧苄氨嘧啶86 例)、三唑类抗菌药(伏立康唑103 例,伊曲康唑74 例)、β-内酰胺类抗菌药(美罗培南61 例,哌拉西林他唑巴坦钠61 例、亚胺培南西司他丁钠58 例)等。AmB相关死亡事件前20 位用药品种见表7。

表7 AmB相关死亡事件前20 位用药品种
2.5 适应证分析
本研究共检出6 801条报告,其中直接死亡相关报告174 例,间接死亡相关报告1 307 例,1 015 例患者有适应证用药,并发症平均2.54 种,一个患者最多21 种基础疾病,838 例患者所报告的用药适应证符合说明书推荐。其中合并毛霉菌病、曲霉属真菌感染、隐球菌脑膜炎、深部念珠菌感染等疾病的患者死亡病例平均诊断率相对较高(见表8)。
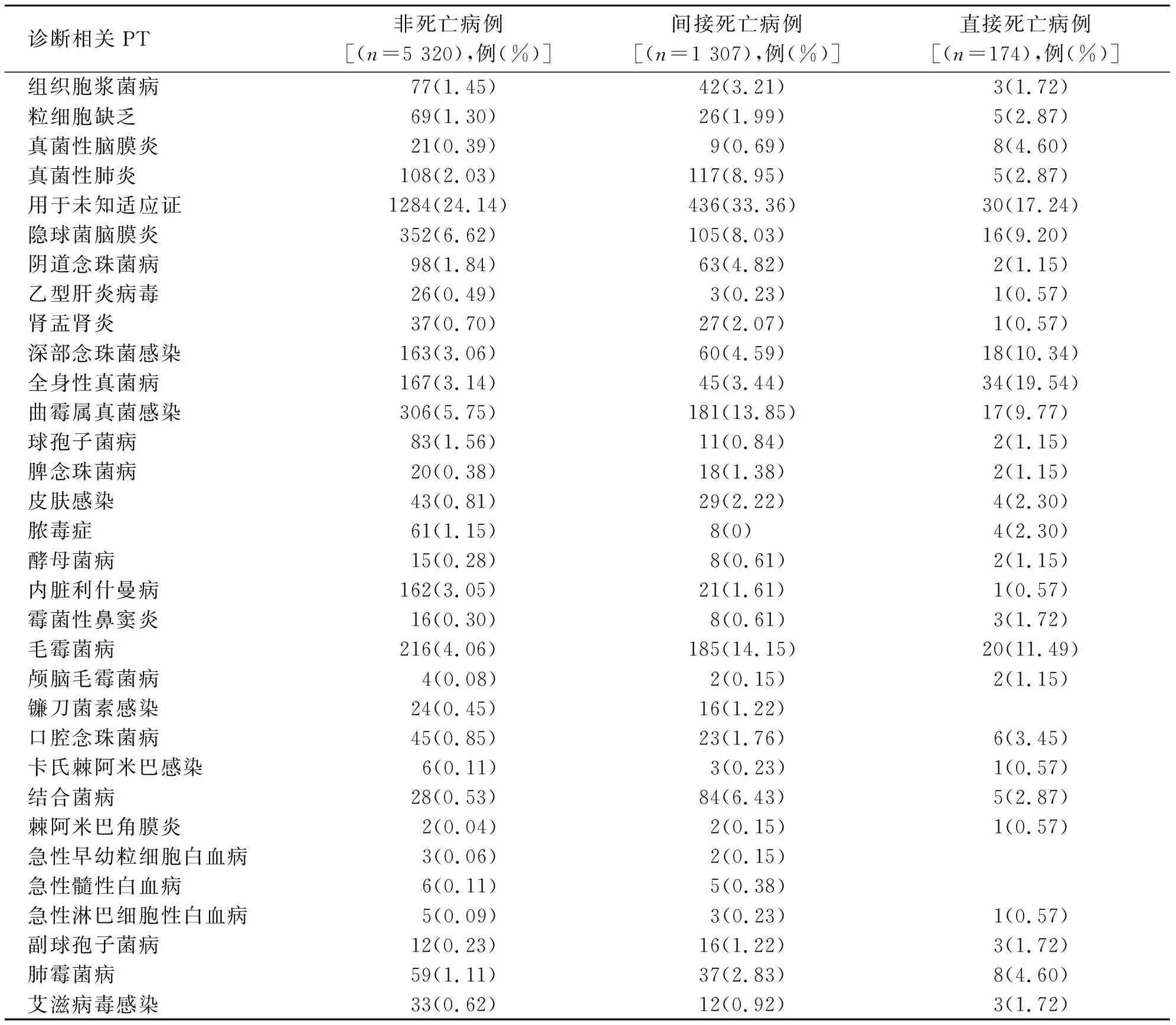
表8 AmB的相关死亡和非死亡不良事件相关诊断情况
3 讨 论
目前,随着广谱抗菌药物、肿瘤药物、肾上腺皮质激素的大量应用及器官移植和艾滋病患者的增多,导致人体正常菌群失调,真菌感染率增加[12]。临床上抗真菌药主要有氮唑类、氟胞嘧啶类、多烯胺类及棘白菌素类。AmB因抗真菌谱广、活性强、作用确切,已成为临床治疗各种严重性真菌感染的首选药,被誉为“黄金标准”。但由于AmB治疗真菌感染疗程长、剂量较大、输液相关的不良事件较多和严重的肾毒性,限制了其在临床的大量使用。
3.1 从报告时间和用药人群及国家分析
因FAERS中数据于2004年开始对公众免费开放,故本研究选择2004年后数据进行统计分析,结果发现AmB相关的死亡事件报告在2004年-2005年达到高值,提示AmB安全性事件的呈报早期在临床使用中得到了高度重视。相关死亡事件报告中,男性多于女性,老年患者比例较高,其中直接死亡组33.91%,间接死亡组31.14%,年龄平均中位数为61 岁,考虑与老年患者基础疾病较重、多病共患、住院时间较长、药物使用剂量过大及多药并用和自身机体免疫功能较差有关。药品说明书提示,肝肾功能不全的患者使用AmB应采用低剂量,因其肾毒性呈剂量依赖性。临床使用过程中,尤其对伴有肾功能不全的老年患者应密切监测用药后肾功能各项指标,并根据肾功能及时调整用药剂量。本研究相关死亡病例中3 例为经胎盘给药,ROR和PRR法信号检测未提示“胎儿死亡”及“新生儿死亡”,FDA将其划分为B类,提示AmB孕妇用药较安全。从报告国家来看,报告例数排前5名的依次是英国、美国、日本、德国和法国等发达国家,报告累计总量占85.42%,提示发达国家对药品安全性的重视程度更大,同时也对其他国家的AmB使用提出警示,应加大AmB相关死亡事件重视程度。
3.2 药物剂量分析
本研究中有75.11% 报告的药品使用剂量在说明书推荐范围内。但直接死亡组和间接死亡组中均存在AmB超剂量使用情况,其中55 例患者AmB日剂量超说明书规定最大使用日剂量,大部分患者为曲霉菌病、结合菌病、内脏利什曼病及隐球菌脑膜炎。
3.3 合并用药和适应证分析
本研究发现,AmB相关死亡事件报告患者涉及多药联用、多病共患等情况,平均用药2.13 种,平均患疾病2.54 种。合并用药排前5名的依次是糖肽类抗菌药、糖皮质激素、钙调神经磷酸酶抑制剂、磺胺类抗菌药、三唑类抗菌药。AmB肾毒性大,应避免与糖肽类抗菌药、钙调神经磷酸酶抑制剂及磺胺类抗菌药联合使用。由于AmB与三唑类抗菌药在体外具有拮抗作用,不推荐联合使用。此外AmB说明书推荐,为了减少药物不良反应可联合使用糖皮质激素,但宜用最小剂量和最短疗程,因其可加重AmB诱发的低钾血症,应密切监测患者的血钾浓度和心脏功能。多病共患分析中发现大部分肿瘤、艾滋病及器官移植的患者合并其他基础疾病较多,且部分患者存在合并使用,应避免联用的药物,这也是导致严重不良事件的原因之一,提示临床应注意药物间相互作用的识别和干预,并尽量不用于有肝肾基础病及低钾的患者,避免严重相互作用和急性肝肾损伤的发生。
药品说明书所警示的药物不良反应只针对药品前期及Ⅳ期临床实验上市使用试验阶段的不良反应,并未更新上市使用多年后出现新的一些药物不良事件,且前期临床由于受试者筛选条件、人员及研究时间限制,并不能完整获得药品的所有安全性信息。目前我国药物不良反应(ADR)的监测方法主要是基于传统的医务人员的自愿呈报系统,且大多只有惩罚措施,无奖励措施,很大程度依赖于呈报人员的自觉性,导致报告量偏低,质量不理想,不能及时发现新的、严重的不良事件。而FAERS数据库样本来源多样化且容量较大,涵盖人群较多,同时对全球免费开放,自由呈报,能随时追踪及发现上市后的 ADR 信号检测,从而可以部分弥补上述不足。本研究存在一定不足:首先部分数据项存在缺失,如药物使用疗程、药品名称未标化;其次,由于自发呈报系统的低报、漏报特点,可能存在信号低估可能,还需结合大量文献分析或专家咨询等方法评估和验证AmB死亡事件相关性。

