PRVC 模式下LPV 对AECOPD 继发呼吸衰竭患者呼吸力学指标、血气水平及血清炎症因子水平的影响
杨冬梅 任双双 孙丹颖
(河南科技大学第一附属医院呼吸与危重症医学科,河南 洛阳 471000)
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是气流受限性疾病,常表现为气流受限进展或不完全性可逆;有研究指出[1],COPD 疾病在我国40 岁以上居民中发病率可达14%,且病情反复发作、病程长,位居于呼吸道疾病的首位。
COPD 患者病情逐步进展,可造成肺部顺应性减低、肺组织弹性降低、残气量增大,在感染等因素作用下,临床症状急剧恶化发展至慢性阻塞性肺疾病急性加重期(Acute exacerbation of chronic obstructive pulmonary disease,AECOPD),在加重期阶段若不及时给予干预,可造成气道阻塞、呼吸肌疲劳等呼吸道通气功能持续性恶化继而导致呼吸衰竭,严重威胁患者生命安全[2]。目前临床上对于AECOPD 继发呼吸衰竭患者大多采用肺保护性通气(Lung protective ventilation,LPV措施干预,可调整患者自身肺部通气量,缓解呼吸衰竭症状,但其缺乏压力支持,可造成肺内气流、气道压过高,影响通气质量;压力调节容积控制通气(Pressure-regulated volume control,PRVC)模式下LPV 实施可通过自动调整呼吸机参数,促使患者在较低压力作用下获得适宜潮气量,气体在肺部病变组织内分布均匀。
鉴于此,本文旨在观察PRVC 模式下LPV 对AECOPD 继发呼吸衰竭患者的效果。
1 资料与方法
1.1 一般资料
选取2018 年4 月至2020 年10 月期间我科收治的89 例AECOPD 继发呼吸衰竭患者作为研究对象,根据随机数字表法分为对照组(n=44)和观察组(n=45)。其中对照组男25 例,女19 例;年龄在49~80 岁之间,平均64.50±6.13 岁;COPD病程3~9 y,平均6.04±1.15 y。观察组男27 例,女18 例;年龄在50~80 岁之间,平均65.03±6.28岁;COPD 病程3~10 y,平均6.52±1.20 y。纳入标准:所有患者均符合COPD 诊断标准[3],根据临床症状、实验室指标检查处于急性加重期阶段并患有呼吸衰竭症状,具备机械通气应用指征,患者及家属知情并签订知情同意书。排除标准:伴有心肝肾功能障碍不全、恶性肿瘤、精神障碍性疾病者,合并上气道堵塞、痰液分泌量增多、高误吸性风险者,长时间服用糖皮质激素类药物者。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准(伦理批号:20180416)。
1.2 方法
对照组采取LPV 措施干预。设置低潮气量为5~8 mL·kg-1,中间间隔6 h 进行肺部复张1 次操作,以50~60 cmH2O 压力需控制通气60 s,促使肺泡复张,并限制吸气峰压;之后根据患者压力-容积曲线,计算出曲线高位拐点值和低位拐点值,并依据拐点值调整适宜的呼气末正压,依据患者血气分析情况实时调整呼吸机参数;允许PaCO2水平在一定范围内升高,当pH>7.2 时,患者肾脏基本处于代偿状态。机械通气至患者自主呼吸稳定并达到停机拔管指征后,可将呼吸机撤离,更改为持续性低流量吸氧干预。
观察组采取PRVC 模式下LPV 干预,即在对照组LPV 措施干预的基础上,呼吸机通气模式选用压力控制通气/压力支持通气+呼气末正压+容积控制通气:将呼吸频率设定为13~18 次·min-1,通气压力初始状态设定为8 cmH2O,随后逐渐升高,最大范围不大于25 cmH2O,呼气压力控制在5~8 cmH2O,吸气初始压力设置为10 cmH2O;随后根据患者动脉血氧饱和度和潮气量,在1 h 内增大吸气压力直至17~20 cmH2O,容积控制通气设定为6~8 mL·kg-1。
两组患者在前3 d 使用呼吸机治疗,每天需带机治疗8 h,睡眠期间带机4 h,若患者呼吸困难症状未改善、病情加重可转为气管插管;两组均进行机械通气1 w。
1.3 观察指标
1.3.1 呼吸力学指标
干预前后,使用贝登医疗FGY-200 型肺功能检测仪检测患者第1 s 用力呼气容积占预计值百分比(Forced expiratory volume in 1 second,FEV1%)、平均潮气量(Tidal volume,VT)、每分钟通气量(Minute ventilation,MV)水平。
1.3.2 血气指标
干预前后采用罗氏cobas b 1231 型全自动血气分析仪检测pH 值、氧合指数(Arterial oxygen tension/Inspired oxygen fraction,PaO2/FiO2)、二氧化碳分压(Partial Pressure of Carbon Dioxide,PaCO2)、血氧饱和度(Oxygen saturation,SaO2)水平。
1.3.3 血清炎症因子
干预前后采集患者空腹静脉血3 mL 置于促凝管内,3000 rpm 离心10 min 后分离血清,采用免疫比浊法检测C 反应蛋白(C-reactive protein,CRP),采用酶联免疫吸附法检测肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)水平。
1.3.4 并发症情况
观察并记录两组患者发生腹胀、吸入性肺炎、眼结膜炎、面部压伤情况,并计算并发症发生率。
1.4 统计学方法
采用SPSS23.0 统计软件分析,计数资料以例数(%)表示,采用χ2值检验,计量资料以均数标准差(±SD)表示,采用t检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组患者干预前后呼吸力学指标对比
干预后,两组FEV1%、VT、MV 水平均升高,且观察组明显高于对照组(P<0.05)。见表1。
2.2 两组患者干预前后血气指标对比
干预后,两组血液pH 值和SaO2(%)无明显差异(P>0.05);两组PaO2/FiO2水平升高,且观察者明显高于对照组;两组PaCO2水平降低,且观察组明显低于对照组(P<0.05)。见表2。
2.3 两组患者干预前后血清炎症因子水平对比
干预后,两组CRP、TNF-α、IL-6 水平均降低,且观察组明显低于对照组(P<0.05)。见表3。
2.4 两组患者并发症情况对比
观察组发生腹胀2 例,吸入性肺炎1 例,眼结膜炎0 例,面部压伤2 例,总发生率11.11%;对照组发生腹胀4 例,吸入性肺炎2 例,眼结膜炎0 例,面部压伤3 例,总发生率20.45%;两组并发症总发生率无明显差异(χ2=0.8451,P>0.05)。
表1 呼吸力学指标对比(±SD)

表1 呼吸力学指标对比(±SD)
注:与干预前比较,aP<0.05;与对照组比较,*P<0.05。
组别 例FEV1%(%)VT(mL)MV(L·min-1)干预前 干预后 干预前 干预后 干预前 干预后对照组 44 43.60±7.37 51.44±7.67a 349.62±62.37 385.29±65.30a 6.35±2.28 7.06±2.49a观察组 45 43.15±7.29 65.22±8.50a* 348.88±62.19 458.76±70.06a* 6.11±2.10 8.71±2.25a*

表2 血气指标对比(X± SD)
表3 血清炎症因子水平对比(±SD)
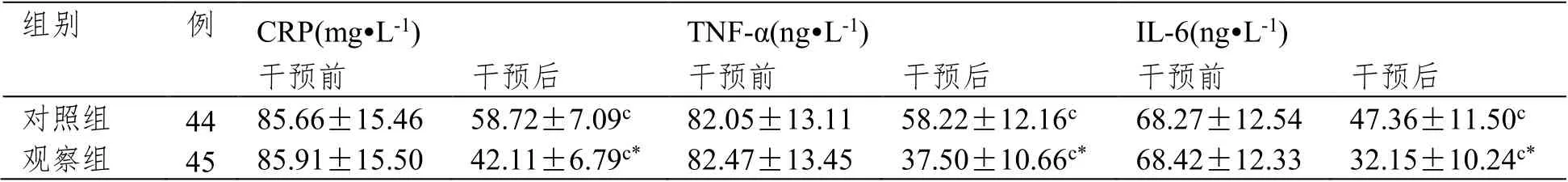
表3 血清炎症因子水平对比(±SD)
注:与干预前比较,cP<0.05;与对照组比较,*P<0.05。
组别 例CRP(mg·L-1)TNF-α(ng·L-1)IL-6(ng·L-1)干预前 干预后 干预前 干预后 干预前 干预后对照组 44 85.66±15.46 58.72±7.09c 82.05±13.11 58.22±12.16c 68.27±12.54 47.36±11.50c观察组 45 85.91±15.50 42.11±6.79c* 82.47±13.45 37.50±10.66c* 68.42±12.33 32.15±10.24c*
3 讨论
AECOPD 是COPD 患者急性阶段发病的过程,患者每年每人大约急性加重0.5~3 次,每次急性发作均会促进病情进展,加重患者心肺功能损伤程度,并伴有呼吸衰竭相关临床症状。COPD患者由于多年的支气管黏膜炎症反应的刺激,使支气管上皮细胞坏死、变性,造成器官扭曲变形出现气流受阻现象。在急性发作阶段,患者气道内会分泌大量炎症物质,因其排痰能力障碍、通气换气功能被进一步恶化,以及出现呼吸衰竭、窒息等严重并发症,继而增加患者死亡风险。
本研究显示,干预后观察组FEV1%、VT、MV水平均优于对照组,提示经PRVC 模式下LPV措施干预可有效改善AECOPD 继发呼吸衰竭患者呼吸力学。LPV 措施干预是以低呼气末正压联合小潮气量并配合肺泡复张,可改善患者肺部氧合功能,防止肺泡萎缩,维持氧气供应、减低呼吸肌相关性肺损伤、改善肺功能以及降低患者死亡率的呼吸支持措施;小通气量对正常肺部组织无显著性益处,且单纯小潮气量非通气会造成肺泡塌陷,促使肺组织内血管内皮细胞损伤,增多肺泡毛细血管内蛋白物质渗出。定时对患者进行肺部复张是在通气过程中给予持续性较高的气道压压力,可增大肺功能残气量,使萎缩的肺泡得以复张,进一步有效维持肺顺应性,提高肺部通气量,继而改善患者机体氧合状态和呼吸功能[4-5]。但实施LPV 措施可能会存在呼吸性酸中毒现象,小潮气量不足难以良好维持肺部通气,发生潜在的通气不足现象。PRVC 属于压力支持通气措施,其依据患者肺部顺应性健翔调节压力支持水平为患者提供种族的潮气量,在一定程度上对气道压良好控制,促进肺内气体得以均匀分布,有助于肺泡扩张,说明PRVC 模式与患者肺部协调性良好,进一步提高胸、肺部顺应性,降低因机械通气而造成的肺组织损伤。在PRVC 模式下LPV 措施对肺组织容积和压力的计算,可实时调整吸气压力改善通气功能,并根据气道阻力和肺部顺应性的变化,调节潮气量,使其保持在可稳定控制的预定范围内,降低呼吸频率和呼吸肌做功量,继而有效调节肺部通气能力,改善呼吸力学[6]。结果显示,干预后两组pH 值、SaO2水平无明显差异,观察组PaO2/FiO2、PaCO2水平高于对照组有明显差异,提示经PRVC 模式下LPV 措施干预可改善患者血气指标。
PRVC 模式是一种新型的双重控制通气模式,通过结合间歇正压通气模式和自主呼吸通气模式,在为患者提供足够的通气量时,可纠正其机体高碳酸血症和低氧血症;该通气模式可促使潮气量控制在理想状态,增大通气潮气量、减少通气量和呼吸频率,继而改善患者呼吸肌疲惫状态,有效纠正二氧化碳潴留和酸中毒现象。在PRVC 模式下LPV 干预以电脑持续性监测患者呼吸频率、呼气末二氧化碳分压和潮气量,可使其实际潮气量接近目标潮气量,有效维持稳定的通气量,进而改善患者血气分析相关指标[7]。结果显示,干预后观察组CRP、TNF-α、IL-6 水平低于对照组有明显差异,两组并发症发生率无明显差异,提示经PRVC 模式下LPV 措施可有效降低AECOPD继发呼吸衰竭患者机体炎症反应,安全性高。PRVC 模式下LPV 措施依据患者呼吸用力和呼吸阻力同时调控通气夹断输出的压力和容积,在每分钟通气量和最小潮气量时,减少呼吸肌做功可维持患者而自主呼吸,较为符合机体生理呼吸功能,进而降低了因机械通气所引发的机体炎症反应,有助于炎症反应的控制。同时其维持恒定的潮气量可保证患者通气安全,无需反复调整吸气压力,可有效控制气道压峰值,减少面部压伤、腹胀等并发症的发生风险[8-10]。
综上所述,PRVC 模式下LPV 通过双重控制通气和复张肺泡对AECOPD 继发呼吸衰竭患者干预,可有效调节血气分析指标,降低炎症反应,促进呼吸功能恢复,安全性高。

