PD-1 单抗联合化疗治疗晚期Her-2 阴性胃癌的临床观察
史纯璞
(常熟市第一人民医院 江苏常熟 215500)
胃癌是全世界范围内高发的一种恶性肿瘤疾病,我国胃癌发病率位于全球第5 位,死亡率位于第6 位,存在严重的疾病负担[1]。人类表皮生长因子受体2(Her-2)是位于染色体17q21 上的原癌基因,编码具备络氨酸活性的跨膜蛋白,Her 家族成员参与信号的传导途径,导致细胞生长以及分化。晚期Her-2 阴性胃癌因为缺乏有效分子靶向药物,所以化疗为主的方法成为治疗此类患者的首选方法[2]。SOX 方案(替吉奥+奥沙利铂)是其中常用方法之一,而实际显示单纯应用SOX 方案化疗的效果欠佳并且副作用较大[3]。程序性死亡受体1(PD-1)单抗是新兴抗癌治疗手段,该药物的应用将临床中对癌症的治疗进入免疫治疗范畴,PD-1 可表达在活化T 细胞表面,肿瘤细胞抵抗T 细胞杀死结合T细胞表面的PD-1 生成PD-L1 这一配体,PD-L1同T 细胞表面PD-1 结合启动机体免疫抑制机制,从而使T 细胞无法识别以及杀灭肿瘤细胞。目前PD-1 单抗广泛应用到恶性肿瘤疾病的治疗中,但是鲜有报道研究关于PD-1 单抗联合化疗治疗晚期Her-2 阴性胃癌的效果[4-5]。基于此,本次研究纳入50 例晚期Her-2 阴性胃癌患者,探讨采取PD-1 单抗联合化疗治疗效果,现报告如下。
1 资料与方法
1.1 一般资料
选取2020 年8 月~2022 年5 月收治的50 例晚期Her-2 阴性胃癌患者为研究对象,针对研究者按随机数字表法原则分为实验组和对照组。
实验组25 例,男性16 例,女性9 例;年龄37 岁~77岁,平均年龄(56.58±2.48)岁;病程6 个月~7 年,平均(3.52±0.52)年;TNM 分期:Ⅲ期14 例,Ⅵ期11 例。
对照组25 例,男性17 例,女性8 例;年龄38 岁~77岁,平均(55.98±2.52)岁;病程7 个月~7 年,平均(3.48±0.56)年;TNM 分期:Ⅲ期15 例,Ⅵ期10 例。
两组患者的一般资料,差异没有统计学意义(P>0.05)。
纳入标准:(1)符合《胃癌诊疗规范(2018 年版)》[6]关于胃癌的相关诊断标准,肿瘤TNM 分期在Ⅲ~Ⅵ期者。(2)免疫组化中Her-2 表达阴性者。(3)既往未接受任何的化疗治疗者。(4)预期生存时间超过6 个月者。(5)精神状态良好且能主动表述以及沟通交流者。
排除标准:(1)存在严重肝脏以及肾脏等严重的脏器病变者。(2)经病理组织明确证实存在其他恶性肿瘤者。(3)血液疾病以及传染疾病者。(4)存在精神疾病及家族史者。
1.2 方法
对照组应用以SOX 方案为主的化疗。具体如下:口服替吉奥胶囊,按照体表面积来计算成人的给药剂量基准量,2 次/天,早晚各一次;静脉滴注奥沙利铂注射液,130 毫克/平方米,第1 天。治疗21天为一个周期,4 个周期持续治疗。
实验组在对照组化疗方案的基础上,加用PD-1 单抗治疗,主要静脉输注信迪利单抗,推荐剂量为200 毫克,每隔21 天给药一次,4 个周期持续治疗。
1.3 观察指标
(1)疗效评判标准。参照实体瘤疗效评估的RECIST 标准判定治疗效果。完全缓解(CR):实体瘤完全消失,影像评估无实质征象;部分缓解(PR):影响评估测定实体肿瘤最大径以及最大垂直径乘积缩小>30%;病情稳定(SD):测定实体瘤乘积缩小不超过50%,增大不超过25%,持续超过4 周;病情进展(PD):影像技术评估测定最大实体瘤两径乘积增大超出20%,实体瘤测定绝对值超过5 毫米。总有效率=(CR+PR)/总例数×100%。
(2)免疫功能。治疗之前以及在4 个周期的治疗完成后,采集肘静脉血液后进行离心处理,获得血清后通过流式细胞仪测定T 淋巴细胞亚群,主要检测项目 包 括CD3+、CD4+、CD8+,同 时 计 算CD4+/CD8+的比值。(3)生活质量。治疗后采取Karnofsky(KPS 评分)评价生活质量,采取百分法的评分方式,根据治疗前后KPS 评分变化对应相应生活质量改善情况。KPS 评分增加≥20 分为显著改善;评分增加10 分-20 分为改善;评分增加<10 分为稳定;评分减少≥10 分为降低。总改善率=(显著改善+改善)/总数×100%。
1.4 统计学方法
使用SPSS20.0 软件作出统计学的分析结果,计量资料用()表示,使用t 检验,计数资料用(%)表示,使用X2检验,组间比较应用独立样本的Wilcoxon 秩和检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 疗效
实验组总有效率显著高于对照组(P<0.05)。见表1。
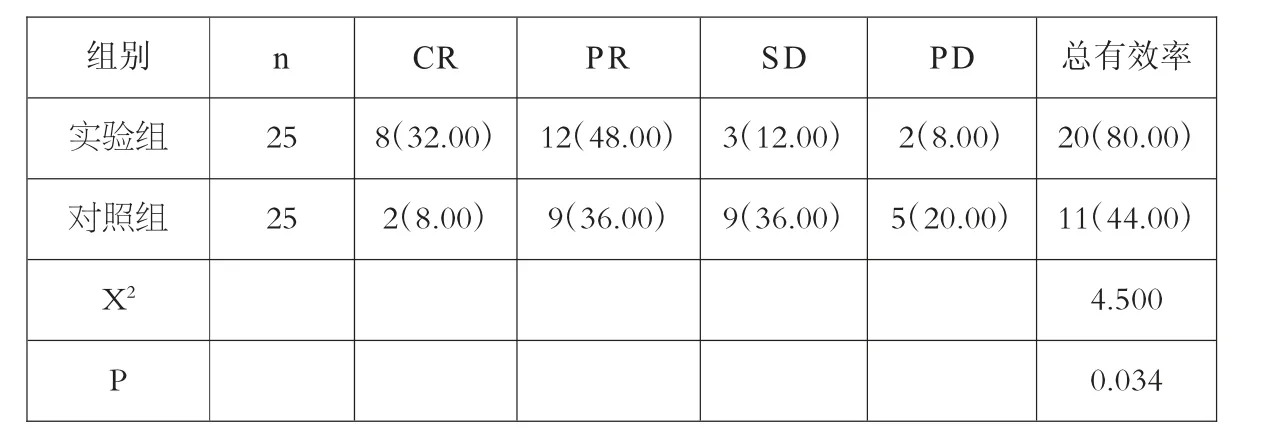
表1 两组患者治疗效果比较[n(%)]
2.2 免疫功能
免疫相关指标,各组均是治疗前的指标,无显著差异。经过治疗后,各指标均已改善,而指标的改善情况,实验组较对照组的改善幅度为优,对比差异有统计学意义(P<0.05)。见表2。
表2 两组在治疗前后免疫功能的指标变化对比()
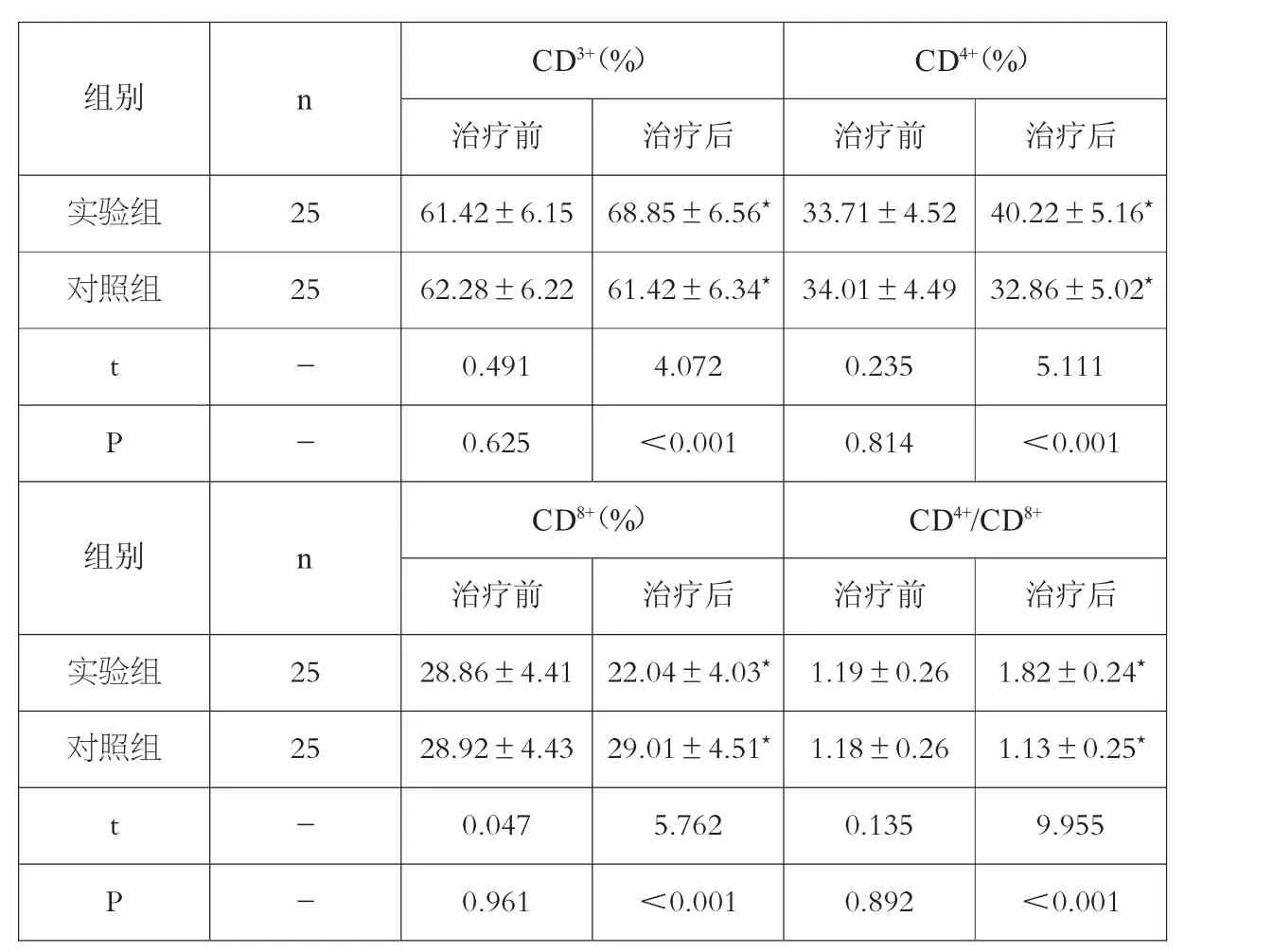
表2 两组在治疗前后免疫功能的指标变化对比()
注:与本组治疗前比较,★P<0.05。
CD3+(%) CD4+(%)治疗前 治疗后 治疗前 治疗后实验组 25 61.42±6.15 68.85±6.56★ 33.71±4.52 40.22±5.16★对照组 25 62.28±6.22 61.42±6.34★ 34.01±4.49 32.86±5.02★t-0.491 4.072 0.235 5.111 P-0.625 <0.001 0.814 <0.001组别 n CD8+(%) CD4+/CD8+治疗前 治疗后 治疗前 治疗后实验组 25 28.86±4.41 22.04±4.03★ 1.19±0.26 1.82±0.24★对照组 25 28.92±4.43 29.01±4.51★ 1.18±0.26 1.13±0.25★t-0.047 5.762 0.135 9.955 P-0.961 <0.001 0.892 <0.001组别 n
2.3 生活质量
实验组的生活质量总改善率较对照组高(P<0.05)。见表3。
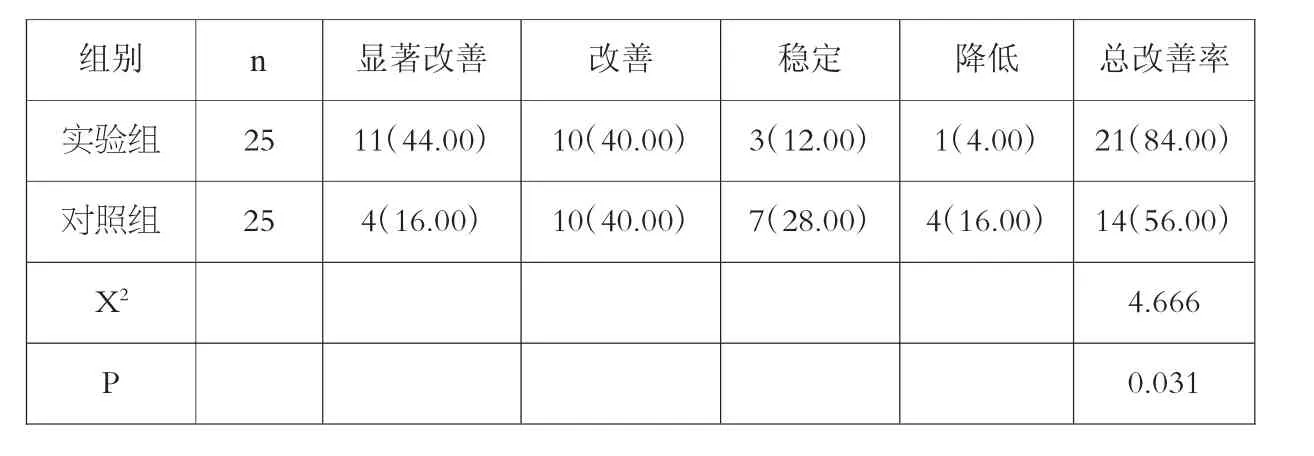
表3 两组治疗后生活质量KPS 评分改善情况比较[n(%)]
3 讨论
Her-2 阴性晚期胃癌采取SOX 方案化疗可取得一定的效果,然而化疗的毒副反应却使得生活质量降低,导致患者依从性降低[8-9]。近年来随着免疫治疗的进一步发展,针对胃癌开始探索免疫联合化疗的治疗方案。本研究结果提示:应用PD-1 单抗联合化疗的治疗方案效果较满意。分析其原因可能是PD-1 单抗作为免疫调节因子,对机体免疫系统进行调节,对T 细胞参与炎症反应的作用,缓解相关炎症反应,提高机体免疫耐受水平,从而能够预防自身免疫疾病,提高自身对化疗毒副反应的耐受。
晚期胃癌患者,机体长时间受癌细胞作用,侵袭正常器官,影响机体T 淋巴细胞分泌以及功能发挥,造成免疫功能的降低,同时生活质量下降。本次研究结果显示,实验组治疗前后外周血T 淋巴细胞亚群水平改善,而对照组治疗前后指标水平无显著改善,实验组生活质量KPS 评分总改善率高于对照组,表明采取PD-1 单抗联合化疗的治疗手段可显著提高机体免疫功能,提高患者的生活质量。分析原因:PD-1 单抗联合化疗方案,有效杀伤癌细胞,同时免疫治疗也对机体免疫功能进行适当调节[10]。PD-1 单抗可通过解除患者体内的免疫抑制,让机体的免疫功能重新发挥作用,达到杀伤肿瘤的效果。
综上所述,针对晚期Her-2 阴性胃癌,采取PD-1 单抗联合化疗的治疗方式,对免疫相关指标有较好的效果,能有效改善临床预后,因而具有一定应用以及推广价值。

