U0126对食管鳞癌细胞迁移的影响
刘丹辉 齐博 刘玉珍 陈智 赵宝生
(新乡医学院 1第一附属医院胸外科,河南 卫辉 453100;2食管癌研究所;3第一附属医院生命科学研究中心)
食管癌是消化系统常见恶性肿瘤之一,主要分鳞癌与腺癌两大病理类型,在中国90%以上为食管鳞癌患者〔1〕。尽管目前对于食管癌的诊疗已经有了显著进步,如手术、化疗、放疗等,但由于高复发和转移的特性,其预后依然很差。细胞外信号调节激酶(ERK)作为丝裂原活化蛋白激酶家族成员之一,调控细胞内的多种信号分子发挥生物学效应〔2〕。ERK通过活化核因子κB等途径诱导抗凋亡基因的表达,促进凋亡蛋白的降解,促进肿瘤细胞的增殖、抑制其凋亡;丝裂原细胞外信号调节激酶(MEK)作为ERK的激酶,引起ERK磷酸化的发生。应用MEK抑制剂抑制ERK磷酸化(磷酸化ERK为ERK活化形式),诱导细胞凋亡与周期阻滞,对不同类型的神经母细胞瘤、肝癌、结直肠癌等多种肿瘤细胞表现出抑制生长、促进凋亡的作用〔3~5〕。在肿瘤迁移及侵袭方面,ERK通过活化转录因子激活蛋白(AP)-1等促进细胞外基质的降解,利于肿瘤细胞的迁移,抑制ERK活性后肿瘤细胞的迁移及侵袭能力显著被抑制〔6〕。然而,临床试验发现MEK抑制剂治疗某些肿瘤并不能提高患者5年生存率,且有研究报道MEK抑制剂具有促进乳腺癌细胞迁移的作用〔7〕。目前有关MEK抑制剂对食管鳞癌细胞迁移的影响及其作用机制,国内外尚无相关报道。本研究旨在分析MEK抑制剂U0126对食管鳞癌细胞迁移的影响,并探讨其可能机制。
1 材料与方法
1.1细胞和试剂 人食管癌细胞系KYSE-150购自中国科学院上海生命科学研究院细胞库,使用RPMI1640(含10%胎牛血清及1%青链霉素混合液)培养细胞。MEK抑制剂U0126购自美国APExBIO公司,二喹啉甲酸(BCA)蛋白定量试剂盒购自碧云天公司,放射免疫沉淀法(RIPA)蛋白裂解液购自博士德公司,Transwell小室购于美国 Corning 公司,辣根过氧化物酶标记山羊抗兔IgG(H+L)购自北京鼎国昌盛生物技术有限责任公司(1∶8 000),磷酸化(p)-ERK1/2、E-钙黏蛋白(cadherin)、β-连环蛋白(catenin,1∶1 000)抗体购自美国CST公司,GADPH(1∶1 000)抗体购自武汉博士德公司。
1.2细胞培养及分组 用含10%胎牛血清及1%青链霉素混合液的RPMI1640培养基在37℃含5% CO2培养箱中培养 KYSE-150细胞,使细胞呈单层贴壁生长,每3 d传代一次。 U0126处理KYSE-150细胞,使其终浓度分别为0.0、0.5、1.0、2.5 μmol/L。
1.3Transwell细胞迁移实验检测细胞垂直迁移能力 取对数生长期细胞,用无血清的培养基RPMI1640重悬细胞(浓度为5.0×105/ml),取200 μl(含细胞数1.0 × 105个)加入Transwell上室中,在下室加入600 μl含10% 胎牛血清培养基,将小室放入培养板中。分为0.0、0.5、1.0、2.5 μmol/L的 U0126组,于培养箱中培养24 h、48 h后,4%多聚甲醛固定15 min,再用0.1%的结晶紫对下室底部细胞进行染色,并用棉签除去上室内侧的细胞。最后显微镜下观察细胞,取9个不同视野进行拍照计数,统计细胞数量。
1.4划痕实验检测细胞水平迁移能力 将细胞密度为5.0×105/ml 的细胞悬液加入6孔板中,在37℃含5%CO2培养箱培养过夜,经不同浓度U0126处理,在细胞上用200 μl 的枪头划横线三条继续培养。药物分别处理24 h、48 h后取出细胞,显微镜下观察细胞横向迁移情况,并在相同位置拍照。
1.5Western印迹实验 分别收集0.0、0.5、1.0、2.5 μmol/L U0126处理的细胞,磷酸盐缓冲液(PBS)清洗3次,加入RIPA裂解液裂解细胞,提取蛋白。按每孔20 μg蛋白制备蛋白样品、上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转至聚偏氟乙烯(PVDF)膜。经5%脱脂牛奶室温下封闭1 h后,加入相应的一抗稀释液,4℃ 孵育过夜。回收一抗,TBST清洗3次,每次10 min,加入辣根过氧化物酶标记山羊抗兔IgG(H+L)二抗,室温孵育70 min,TBST清洗3次,电化学发光(ECL)法显影,采用凝胶成像设备观察结果并拍照,用ImagegJ 18.0图像分析软件测条带灰度值并比较各组间差异。
1.6统计学分析 采用Graphpad prism7软件进行t检验。
2 结 果
2.1U0126对食管鳞癌细胞垂直迁移的影响 0.5、1.0、2.5 μmol/L U0126处理组的细胞穿膜细胞数〔(83.33±9.00)个、(240.00±2.49)个、(314.00±2.94)个〕较0.0 μmol/L U0126(对照)组〔(115.00±7.12)个〕明显增加,且处理组穿膜细胞数目随U0126浓度的增高而增加(P<0.01)。见图1。
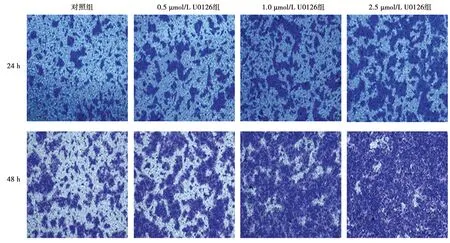
图1 U0126对KYSE-150细胞垂直迁移的影响(结晶紫染色,×200)
2.2U0126对KYSE-150细胞水平迁移的影响 U0126促进KYSE-150细胞迁移,且随着U0126浓度及时间的增加,促进效应逐渐增强。0.5、1.0、2.5 μmol/L U0126处理细胞24、48 h后横向迁移细胞数高于对照组除0.5 μmol/L 24 h时外,其余差异均具有统计学意义(P<0.01)。见表1和图2。

表1 U0126对KYSE-150细胞水平迁移的影响个,n=3)
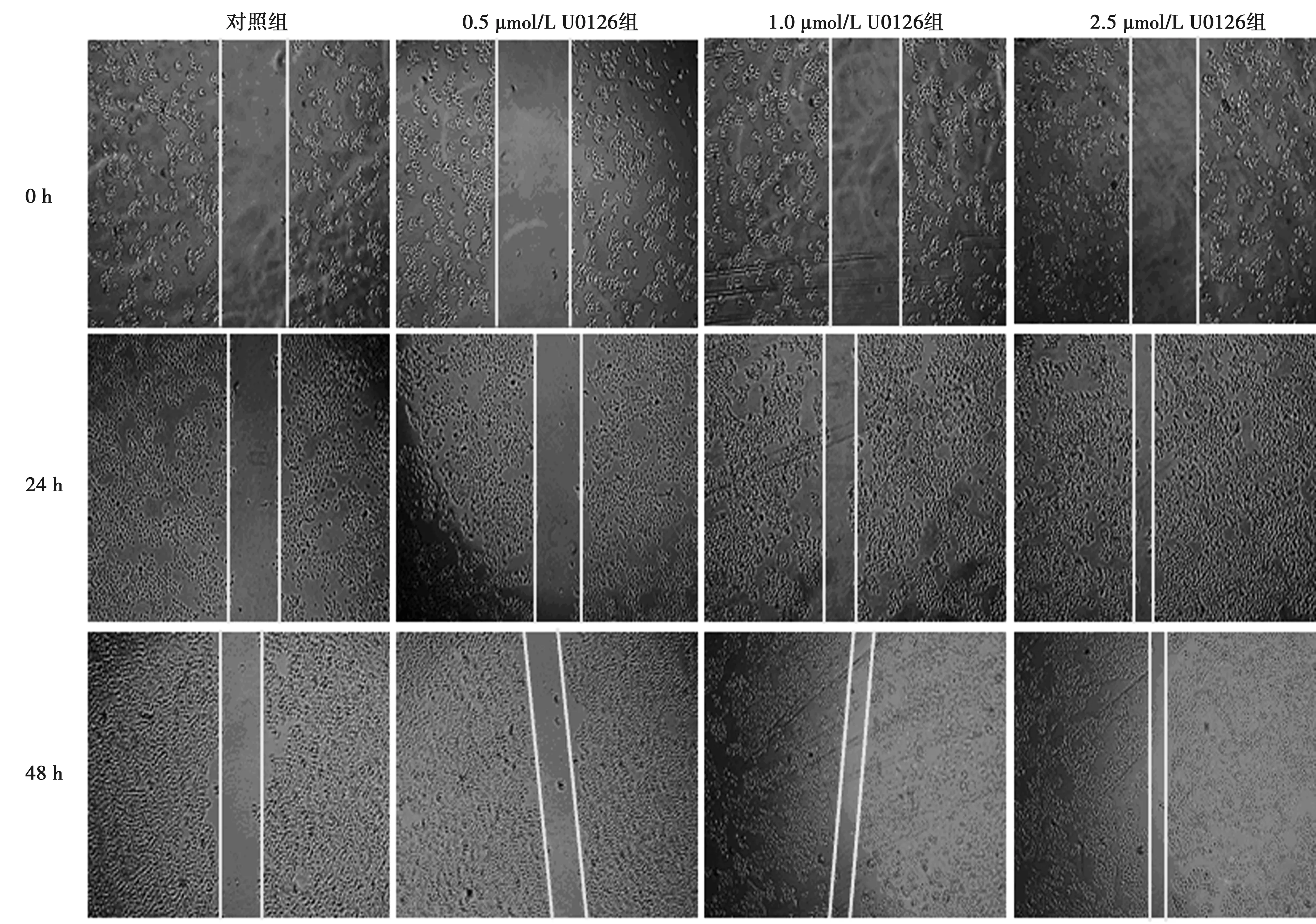
图2 U0126对KYSE-150细胞水平迁移的影响(×200)
2.3U0126对KYSE-150细胞上皮间质转化相关蛋白表达的影响 0.5、1.0、2.5 μmol/L U0126处理组 E-cadherin蛋白表达量明显低于对照组,而 β-catenin蛋白表达量明显高于对照组(P<0.01),0.5、1.0 μmol/L U0126与p-ERK1/2表达较对照组无明显改变,但2.5 μmol/L U0126抑制p-ERK1/2表达(P<0.01)。见图3和表2。

1~4:对照组,0.5 μmol/L U0126组,1.0 μmol/L U0126组,2.5 μmol/L U0126组图3 U0126对KYSE-150细胞相关蛋白表达的影响
表2 U0126对KYSE-150细胞相关蛋白表达的 影响
3 讨 论
食管癌是常见的消化系统恶性肿瘤,其发病率和死亡率高,且预后差,是世界上最常见的第8大恶性肿瘤,中国90%以上为食管鳞癌患者〔8〕。由于食管癌具有高度侵袭性且易发生早期转移,其5年生存率不到20%。尽管许多抗肿瘤药物能抑制食管癌的进展,但有些患者治疗效果依然很差,其原因有待进一步阐明。Ras/MEK/ERK通路对肿瘤细胞增殖、凋亡、迁移、侵袭和血管生成等方面起着关键作用〔9~16〕。因此,ERK被认为是治疗癌症的合适靶点〔17〕。ERK活化促进癌细胞增殖,抑制凋亡,针对调控ERK的上游激酶的抑制剂,已被研发应用于临床试验。通过应用ERK激酶MEK抑制剂进而抑制ERK信号通路,抑制ERK磷酸化的发生,促进肿瘤细胞凋亡。例如,钙结合蛋白S100A12上调前列腺癌细胞ERK磷酸化水平,具有明显抗凋亡能力,MEK抑制剂MK-8353明显逆转该现象的发生〔18〕。此外,ERK磷酸化可通过调控转录因子的表达,利于EMT现象的发生,促进肿瘤细胞的迁移及侵袭能力。EMT即上皮到间质细胞的转化,通过修饰细胞表达的黏附分子,从而使其具有迁移和侵袭行为。上皮标志物E-cadherin和间充质标记物β-catenin、vimentin等均为EMT的标志蛋白,上皮标志物的下调与间充质标志物的上调预示着肿瘤细胞EMT现象的发生。Zheng等〔19〕研究证实钙蛋白酶家族成员Capn4通过ERK/c-Jun氨基末端激酶(JNK)磷酸化激活AP-1,促进鼻咽癌细胞迁移。ERK磷酸化水平上调,促使胰腺癌细胞EMT的发生,抑制ERK磷酸化水平上调E-cadherin的表达,下调vimentin的表达,降低胰腺癌细胞的迁移能力〔20〕。但是,也有研究发现MEK抑制剂PD98059通过EGFR信号的激活刺激β-catenin核积聚进而促进乳腺癌细胞迁移〔7〕。
已有文献报道10 μmol/L U0126对食管鳞癌细胞增殖无影响,但随着浓度的增加,其对食管鳞癌的增殖抑制作用明显增强〔21〕。前期通过对不同食管鳞癌细胞检测发现,U0126小于10 μmol/L对KYSE-450、EC9706细胞的迁移均无影响,但却明显促进KYSE-150细胞迁移。因此本研究进一步研究发现,MEK1/2抑制剂U0126以时间-剂量依赖性的方式抑制食管鳞癌KYSE-150细胞的迁移。
β-catenin通常作为关键的转录因子,促进肿瘤细胞的增殖和迁移〔22〕。β-catenin可通过上调基质金属蛋白酶(MMPs)在内的转移相关基因转录而促进肿瘤细胞运动能力的增强〔23〕。虽然β-catenin高表达发生在应用MEK抑制剂后,但是有研究表明,该现象的发生主要在于MEK抑制剂诱导EGFR信号通路的激活有关,与经典的RAF/MEK/ERK通路介导的细胞增殖、凋亡及迁移、侵袭无相关性〔7〕。由此提示,U0126影响食管鳞癌KYSE-150细胞的迁移可能不仅与调控ERK活性的基本作用有关,且还有可能通过非经典的ERK途径发挥作用。
综上,U0126可能是通过下调E-cadherin和上调β-catenin表达,诱导EMT的发生,促进KYSE-150细胞迁移。该研究为临床试验应用MEK抑制剂治疗某些肿瘤效果不理想做出合理解释,提示临床用药过程中不仅要考虑到用药个体化,还要考虑到用药的剂量,以此为临床抗癌药物的应用提供一定的理论指导。

