基于MRI 影像组学模型识别三角纤维软骨复合体损伤
滕佩宏,张卜天,杨慧敏,任玲玲,李晓静,白应洁,刘桂锋
三角纤维软骨复合体(triangular fibrocartilage complex, TFCC)是尺侧腕关节的重要解剖结构,由三角纤维软骨盘、掌侧及背侧桡尺韧带、半月板类似物、尺腕韧带、尺侧副韧带及尺侧腕伸肌腱鞘组成,结构精细而复杂[1-2],能够在腕关节运动中保持稳定并提供减震的作用[3],且在日常生活和运动中,腕关节的使用频率高、活动范围大,因而TFCC损伤以及由此造成的腕部疼痛、乏力、活动受限等较为常见[4-7]。目前腕关节镜检查是诊断TFCC 损伤的金标准[8],但为有创检查,因而目前临床上外科医生对于TFCC损伤的诊断主要依靠病史、临床症状和辅助检查。一些研究[9-11]证实高分辨率3.0 T MRI对于显示TFCC的解剖及损伤情况具有较高的敏感性,在Treiser等[12]的一项荟萃分析中,MRI 对于判断TFCC 损伤的敏感度和特异度分别为76%和82%。MRI 对软组织的分辨率较高,可以显示TFCC 的信号强度变化以及形态改变,成为目前诊断TFCC 损伤的主要辅助方式[13-16],但基于TFCC 形态复杂、结构微小,临床工作中对于其精确的诊断及损伤的评估需要基于丰富的临床经验,对于年资较低的放射科医生来说,极有可能漏诊或误诊[17]。
影像组学是一种通过自动化算法从医学图像中高通量地提取定量影像特征,将图像信息转换成高维数据信息,经降维和建模处理后,用作预测和诊断疾病以提高临床决策的方法[18-20],具有无创、经济、高效及可重复性等优点。目前国内外针对影像组学应用于腕关节TFCC研究的文献相对较少,因此,本研究通过联合腕关节TFCC 的MRI 影像与影像组学,构建分类器模型,将损伤与非损伤患者加以区分,提高诊断率,以便于进一步的临床治疗[21]。
1 材料与方法
1.1 研究对象
回顾性分析2019 年1 月至2021 年12 月于吉林大学中日联谊医院放射科行腕关节MRI 检查的患者病例。纳入标准:(1)经腕关节镜或手术证实的TFCC损伤及非损伤患者;(2)行腕关节MRI 检查前未接受关节镜、关节造影以及手术等创伤性检查或治疗;(3)均在同一台高分辨率3.0 T磁共振扫描仪上采集数据。排除标准:(1)已明确合并尺骨远端骨折;(2)磁共振图像伪影重。本研究经吉林大学中日联谊医院伦理委员会批准,免除受试者知情同意,批准文号:2021072108。
1.2 影像采集
所有患者均使用3.0 T 磁共振扫描仪(SIEMENS Healthineers, MAGNETOM Skyra, Germany),所有患者均为俯卧位,检查臂抬起至头顶上方,使手腕位于激光标记所精确指向的扫描器孔的中心位置。成像方案如表1所示。
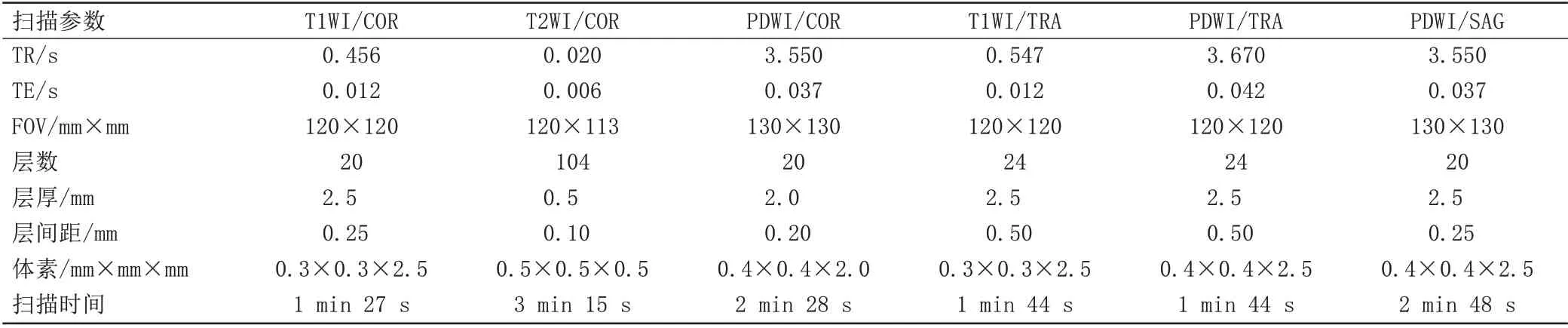
表1 各序列扫描参数Tab.1 Scanning parameters of each sequence
1.3 感兴趣区的获取
图像经吉林大学中日联谊医院放射科影像归档和通信系统(picture archiving and communication systems, PACS)获取,选取腕关节T2WI冠状位序列,经医学影像图像处理软件MRIcroGL 勾画TFCC 的3D 感兴趣区(region of interest, ROI)。考虑到TFCC的结构及空间分布的复杂性,在勾画ROI 时,以周围诸腕骨为界[22],减少TFCC 本身结构性的干扰,尽管特异度可能会下降,但保证了模型敏感度。ROI 由一名具有10 年骨肌影像诊断经验的放射科医生勾画,并交由另一名具有15年骨肌影像诊断经验的放射科主任医师确认分割准确性,意见不一致时,讨论并达成一致意见(图1)。
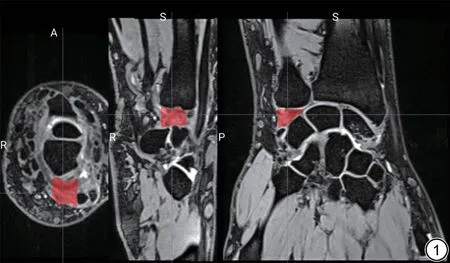
图1 手动分割三角纤维软骨复合体区域。Fig. 1 The manual segmentation area of triangular fibrocartilage complex。
1.4 影像特征的提取
基于影像组学分析工作流程的开源软件包Pyradiomics(http://www.Radiomics.io/pyRadiomics.html)[23]进行影像组学特征的提取。共提取了88个影像组学特征:14 个形状特征(shape features),18 个一阶统计特征(first-order statistics features),24 个灰度共生矩阵(gray level cooccurence matrix,GLCM),14 个灰度相关矩阵(grey level dependence matrix, GLDM),16个灰度游程长度矩阵(gray level run length matria, GLRLM),16 个灰度尺寸区域矩阵(gray level size zone matrix, GLSZM),5 个邻域灰度差矩阵(neighbouring gray tone differencematrix, NGTDM)[24],并进行数据的标准化处理。
1.5 影像特征的筛选
基于Python 3.7 的运行环境,运用Pandas、Numpy、Sklearn 程序包,先进行曼-惠特尼U检验及最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法的运行,再进行数据降维、特征筛选,去除冗余特征,避免发生过拟合[25-27]。在曼-惠特尼U检验中,P<0.05 表示差异有统计学意义;LASSO 算法通过五折交叉验证以及调整参数λ 使无关特征和冗余特征的权重系数压缩为0,保留与判断TFCC损伤相关性最强的特征。
1.6 影像模型的构建
将最终筛选出的相关性最强的影像特征,按照7∶3 的比例随机选取训练集和测试集,采用支持向量机(support vector machine, SVM)构建分类器模型[28-29],用受试者工作特征(receiver operating characteristic, ROC)曲线的曲线下面积(area under the curve, AUC)、精确度、敏感度及特异度来评价模型的预测性能。
1.7 统计学处理
采用SPSS 25.0软件包进行数据处理,组间对比的检验方式为χ2检验,计量资料的检验方式为t检验,对经Pyradiomics 提取的88 个影像组学特征采用曼-惠特尼U检验(Mann-WhitneyUtest)的方法,P<0.05 表示差异有统计学意义;在训练集和测试集中都使用AUC以及精确度、敏感度和特异度评估分类器的预测性能。
2 结果
2.1 一般资料
研究共纳入100例患者病例,其中TFCC损伤及非损伤患者各50例(表2)。

表2 损伤组与非损伤组患者基本情况Tab.2 Basic conditions between injury and non-injury
2.2 特征值筛选结果
将100例患者按照7∶3的比例随机分为训练集和测试集(分别为70例和30例),经标准化及曼-惠特尼U检验处理后,得到88个影像特征,采用LASSO算法进行特征筛选后,最终获得12 个相关性最强的影像特征(表3、图2),其中包括5个形状特征,2个一阶特征以及5个高阶纹理特征(1个GLDM,3个GLSZM,1个NGTDM)。
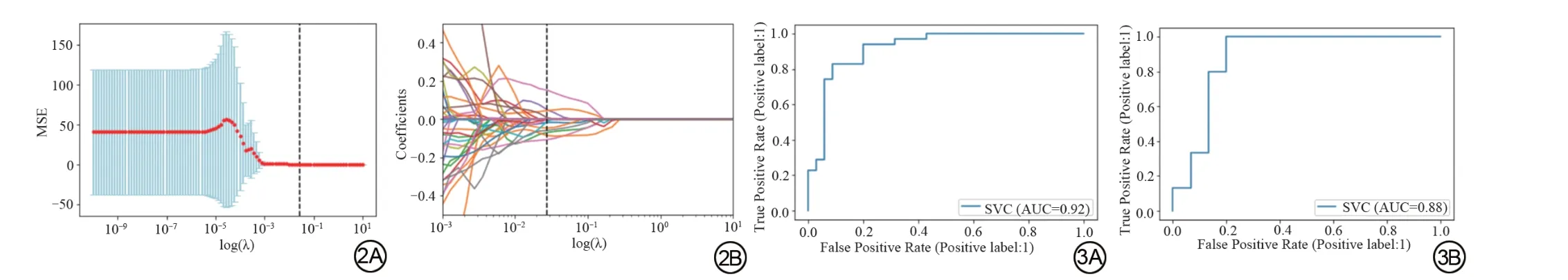
图2 采用最小绝对收缩和选择算子算法从T2WI冠状位序列中提取影像特征。2A:通过基于五折交叉验证来选择套索模型中的权重参数(λ)。下方的x轴表示对数(λ),y轴表示二项式偏差。蓝色垂直线表示具有给定λ的每个模型的偏差值。垂直的黑色虚线定义了λ的最佳值为0.03。2B:88个初始特征的权重系数变化。图中显示最终选取了12个具有非零系数的影像特征。 图3 3A和3B分别表示模型在训练集和测试集中的AUC值。Fig. 2 Radiomic features derived from T2WI sequence selected by using the least absolute shrinkage and selection operator (LASSO) algorithm. 2A: Selection of the tuning parameter (λ) in the LASSO model via fivefold cross-validation. The x-axis indicates the log(λ), and the y-axis indicates binomial deviances. The blue vertical lines indicate the deviance values for each model with a given λ.The vertical black dotted lines define the optimal values of λ which is 0.03.2B:LASSO coefficient profiles of the 88 texture features. The twelve selected features with nonzero coefficients are indicated in the plot. Fig. 3 3A and 3B represent the AUC values of training set and test set respectively.

表3 LASSO二元logistic回归法筛选得到的影像特征Tab.3 Radiomics features selected by LASSO binary logistic regression
2.3 分类器建模结果
经SVM 分类器建模后,在训练集中的AUC 值、精确度、敏感度及特异度分别为0.92、84%、86%、100%,在测试集中的AUC 值、精确度、敏感度及特异度分别为0.88、90%、92%、100%(图3),在训练集和测试集中均表现出了良好的预测性能。
3 讨论
本研究从识别TFCC 损伤与否的目的出发,基于腕关节MRI,首次将影像组学应用于TFCC 损伤评估。以往关于TFCC 的文献中大多仅包含了TFCC 损伤的分类、关节镜下的治疗[30-32]等,但对于使用MRI从三维立体的角度评估TFCC 损伤的研究相对较少[33],将影像组学与基于MRI 的TFCC 损伤的文献报道几乎为空白。将影像组学应用于运动损伤中的腕关节TFCC损伤的评估,相较于关节镜检查具有无创性,而且能够有效减少放射科医生的诊断主观性,使TFCC 的损伤诊断不再依赖于医生的年资及经验水平,有效提高诊断效能。
3.1 影像图像的选择
TFCC 的解剖结构相对复杂,结构精细而微小,基于MRI 对于软组织具有良好的成像显示[34-35],本研究选择3.0 T MRI[36],从三维立体的角度,减少TFCC 本身结构复杂性的干扰,为进一步的ROI识别与勾画做好基础。
3.2 模型预测性能
TFCC 结构及空间分布的复杂性,本研究以周围腕骨为边界勾画ROI,扩大勾画范围以提高模型的敏感性;最终模型通过AUC值、精确度、敏感度及特异度表现出了较好的预测性能,取得了较高的诊断准确率,这也证实了将影像组学应用于运动损伤中TFCC的评估确实可行。
3.3 临床价值及意义
近年来,影像组学发展迅速,目前针对肺结节的研究与应用已经取得显著的成果[29],在骨折的识别方面也方兴未艾[30],这些研究成果不仅极大地提高了基层单位的诊断能力,也提高了三甲级医院的工作效率[37]。运动损伤存在于生活中的方方面面,诸如骨折、韧带及软骨损伤等,且影像组学在骨折的诊断方面已经在临床工作中得以应用。目前尚未有影像组学应用于软组织损伤的诊断中,日常工作中对于TFCC 损伤仍存在漏诊、误诊的情况,特别是对边缘型TFCC 损伤诊断的敏感性及特异性更不尽如人意。基于本研究的研究目的及研究结果,未来的影像组学或许可以扩大诊断范围,尤其对于结构相对复杂的组织和器官,有效降低诊断门槛,提高诊断效能。
3.4 局限性
本研究有几个局限性:(1)本次研究仅将影像图像及部分临床资料纳入研究,但基于TFCC结构复杂、损伤病因多样[1,38-39],在后续工作中将深化研究,对造成TFCC损伤的原因进行进一步探讨;(2)本研究纳入了100 例患者病例作为研究对象,样本量较少,更大的数据集和多中心研究可能会显示出更加稳定的预测效能;(3)对于伴随或不伴随TFCC损伤而出现的滑膜增生及滑囊积液,在本次ROI的勾画中并未加以区别,在后续的研究中,将选择更精确的勾画及区分方法,进一步提高模型的特异性。
综上所述,本研究建立了一种无创性的辅助诊断TFCC 损伤的方法,目前国内外关于MRI 影像组学与TFCC结合分析的文献报道几乎为空白。本研究建立的基于MRI 的影像组学模型能够不再依赖放射科医生的年资及经验水平,提高TFCC损伤的诊断率,便于指导患者的个性化治疗。
作者利益冲突声明:全体作者均声明无利益冲突。

