分子印迹包裹的碳量子点荧光传感器特异性吸附检测核黄素
刘炉英, 汤春琪, 吴家婷, 谢丽君
(广东第二师范学院化学系,广东广州 510303)
核黄素又称维生素B2,为体内黄酶类辅基的组成部分,当缺乏时会影响机体的生物氧化,造成代谢障碍,可产生口角炎、唇炎、舌炎、眼结膜炎和阴囊炎等症状[1,2]。目前核黄素的检测方法有电化学检测法[3,4]、酶联免疫法[5]、毛细管电泳法[6]、比色检测法[7]、高效液相色谱法[8,9]以及荧光检测法[10,11]。
碳量子点(CDs)具有优异的水溶性、良好的光稳定性和生物相容性等特性[12-15],但CDs作为荧光传感器最大的挑战是对目标物的选择性不高,在复杂的样品中很难特异性识别目标分子。因此为了提高CDs的选择性、抗干扰性、灵敏度,在CDs表面包裹一层分子印迹层,大大提高荧光传感器的特异性识别能力和荧光稳定性,扩大CDs在样品前处理技术中的应用范围[16 - 18]。单发射特性的荧光传感器会受到光漂白、背景干扰和仪器波动等因素影响,其定量和定性能力受到一定的限制。因此使用比率荧光传感器并引入双发射波长,可以消除这些因素带来的不利影响[13,19,20]。近年来分子印迹聚合物(MIPs)被广泛用于与CDs结合以提高荧光传感器的选择性。本工作采用溶胶-凝胶原位聚合法,利用3-氨基丙基三乙氧基硅烷为功能单体,正硅酸乙酯为交联剂,形成分子印迹层包裹CDS,核黄素作为模板分子印迹在聚合物层形成嵌入式的CDS@MIPS材料,洗去模板分子后可对核黄素进行特异吸附检测。此方法将CDS固定在印迹层内,使得CDS与核黄素分子之间能量传递被印迹层分子阻隔难以发生能量共振转移,所以CDs的荧光信号不受核黄素的影响。因此,将碳量子点在460 nm波长处的荧光作为参考信号,目标物核黄素在520 nm波长处的荧光作为变量信号,利用I520/I460的荧光比值随着核黄素的浓度变化而变化,形成比率型荧光传感器检测食品中的核黄素。
1 实验部分
1.1 仪器与试剂
F97pro荧光光谱仪(中国上海,棱光技术有限公司);Tensor27红外光谱分析仪(德国,布鲁克公司);MIRA3场发射扫描电镜(捷克,泰思肯有限公司);JEM-2100F透射电子显微镜(日本,电子株式会社)。
无水柠檬酸、N-(β-氨乙基-γ-氨丙基)甲基二甲氧基硅烷(AEAPMS)、3-氨丙基三乙氧基硅烷(APTES)、正硅酸乙酯(TEOS)、核黄素购于阿拉丁试剂公司,其它试剂均为分析纯试剂。实验用水均来自于超纯水机纯化的超纯水(18.2 MΩ·cm)。
1.2 CDs合成
称取0.5 g无水柠檬酸分散在10 mL AEAPMS中后,转入聚四氟乙烯内衬里氮气脱气20 min,然后将高压釜在240 ℃下保持2 h。反应结束后冷却至室温,用圆筒过滤膜滤器(0.22 μm)过滤溶液,最后用石油醚洗涤滤液三次。将获得的CDs分散在250 mL无水乙醇中,并在4 ℃下避光保存以供下一步使用。
1.3 CDs@MIPs荧光传感器的合成
烧瓶中加入40 μL上述制备的CDs和100 mg核黄素,继续加入350 μL APTES和1.5 mL TEOS,200 μL NH3·H2O和800 μL超纯水组成的混合溶液,超声分散20 min,在室温下避光反应24 h,通过离心收集产物[16]。用洗脱溶剂洗脱模板分子,直至用荧光分光光度计从洗脱溶剂中检测不到模板分子。最后在60 ℃下真空干燥12 h,得到一种核黄素印迹的乳白色粉末CDs@MIPs。同时,不加入核黄素采用相同的方法制备无印迹CDs@NIPs材料。
1.4 CDs@MIPs检测核黄素
荧光测量条件:激发波长为370 nm,激发和发射缝宽度均为10 nm,激发电压为750 V,分别记录460 nm、520 nm处的荧光强度。将CDs@MIPs的粉末溶于超纯水中,制作CDs@MIPs工作溶液(2.5 mg/mL、25 mg/mL)。核黄素的检测:1 mL CDs@MIPs上述储备液与1 mL核黄素标准溶液(0.3~20 μmol/L)混合涡旋1 min后离心分离,用超纯水冲洗3次后溶解至2 mL后检测荧光。对照组CDs@NIPs的实验条件与CDs@MIPs的相同。
2 结果与讨论部分
2.1 表征CDs@MIPs
CDs@MIPs的形貌通过扫描电镜(SEM)、透射电镜(TEM)表征如图1A、1B所示,从图中可以看出其呈现的是球形颗粒状,直径大致为50 nm,远远大于CDs粒径,说明多个CDs是嵌在印迹层里,并非单核壳结构,且颗粒之间出现交联。

图1 CDs@MIPs的表征:(A)扫描电镜图;(B)透射电镜图。Fig.1 Characterization of CDs@MIPs:(A) SEM;(B) TEM.
FT-IR光谱如图2A所示,比较CDs@MIPs洗脱前后与CDs@NIPs之间的差异,以及与核黄素进行对比。从图中可以看出为洗脱前CDs@MIPs存在核黄素2 375 cm-1特征峰,洗脱后的CDs@MIPs此峰消失,证明核黄素洗脱干净。而CDs@MIPs洗脱前与后、CDs@NIPs三者都出现792 cm-1Si-O振动峰,1 061 cm-1为Si-O-Si的不对称伸缩振动峰,1 667 cm-1为仲酰胺羰基(C=O)的拉伸振动峰,2 937 cm-1为C-H拉伸振动峰,说明成功合成CDs@MIPs。
图2B所示为CDs、CDs@MIPs、CDs@MIPs+核黄素、核黄素以及CDs@MIPs+核黄素的荧光发射光谱图(右上图分别对应各个溶液的发光颜色)。从图中可以看出CDs的荧光强度最大,发射峰位置在465 nm,并且右上角对应的图中发出明亮的蓝光(a);CDs@MIPs的荧光强度相对于CDs减弱,可能由于分子印迹层阻挡部分荧光的发射,但发射峰依然在465 nm且发蓝光(b)。CDs@MIPs+核黄素荧光强度相对CDs@MIPs有一定增强且发射峰在460 nm,溶液发绿光(c)。核黄素溶液发黄光,发射峰在520 nm处(d)。CDs@MIPs+核黄素(c)与CDs@MIPs+核黄素光谱理论加和(e)进行对比发现两者几乎重合,进一步说明CDs与核黄素之间的荧光相互不干扰,荧光传感器的荧光光谱为CDs@MIPs和核黄素两者的荧光峰叠加而成。因此此传感器可利用CDs荧光作为参考信号,核黄素荧光作为变量信号。CDs@MIPs在紫外光连续照射12 h后荧光强度几乎不变,说明合成的CDs@MIPs荧光稳定。
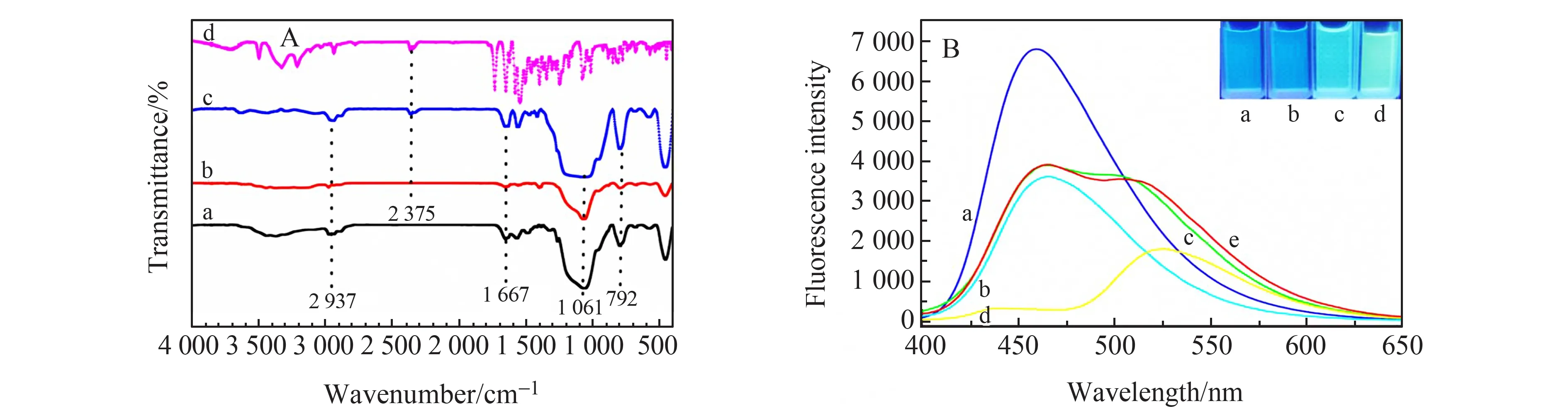
图2 (A) CDs@NIPs(a)、CDs@MIPs(b)、CDs@MIPs +核黄素(c)和核黄素(d)的傅里叶红外(FT-IF)光谱;(B)CDs(a)、25 mg/L CDs@MIPs(b)、25 mg/L CDs@MIPs+1.0 μmol/L 核黄素(c)、核黄素(d)、CDs@MIPs+核黄素理论加和荧光光谱图(e)Fig.2 (A) FT-IR spectra of CDs@NIPs(a),CDs@MIPs(b),CDs@MIPs+riboflavin(c) and riboflavin(d);(B) Fluorescence spectra of CDs(a),CDs@MIPs(b),CDs@MIPs+ riboflavin(c),riboflavin(d) and theoretical adduct diagrams of CDs@MIPs+ riboflavin(e)
2.2 优化检测条件
实验选用甲醇-乙酸(90∶10,V/V)、甲醇-水(90∶10,V/V)、甲醇、超纯水4种溶剂洗脱印迹层中的核黄素分子。CDs@MIPs使用每种洗脱剂洗脱10次、20次、30次、40次后真空干燥。如图3A所示,CDs@MIPs经过超纯水洗脱30次之后比值最小且没有变化,说明印迹层中的核黄素被洗脱干净,同时通过荧光检测验证印迹层中的核黄素已经被洗脱干净。因此选择超纯水作为洗脱剂。
优化1.25 mg/L CDs@MIPs与核黄素萃取时间如图3B所示,1.5 μmol/L核黄素与CDs@MIPs涡旋1 min时达到最大荧光比值,后续随着涡旋时间的增加荧光比值降低。可能由于随着时间增加,吸附核黄素被重新溶解至溶液里,导致荧光强度降低。后续实验中萃取时间选择1 min。

图3 优化实验条件:A)溶剂洗脱;B) 响应时间 Fig.3 Optimization of experimental conditions:A) Solvent elution;B) Response time
2.3 CDs@MIPs检测核黄素
选用CDs@MIPs两个浓度分别为1.25 mg/L、12.5 mg/L,利用I520/I460与核黄素的浓度呈正比,对于低浓度CDs@MIPs检测核黄素的浓度为0.15、0.25、0.40、0.50、1.0、1.5 μmol/L,线性方程为:Y=1.2661X+0.5984,R2=0.9948,利用3δ/k计算出检出限为8.48 nmol/L。高浓度CDs@MIPs检测核黄素的浓度为1.5、2.5、4.5、7.0 μmol/L,线性方程为:Y=0.05425X+0.7585,R2=0.9979,所以总的线性范围为0.15~7.0 μmol/L。从图4中可以看出,当CDs@MIPs的浓度增加时,I520/I460两者的比值反而减小,可能由于当升高CDs@MIPs的浓度时,460 nm处的荧光增强。虽然在520 nm处的荧光也增强但是分母增大幅度更大使得比值减小。
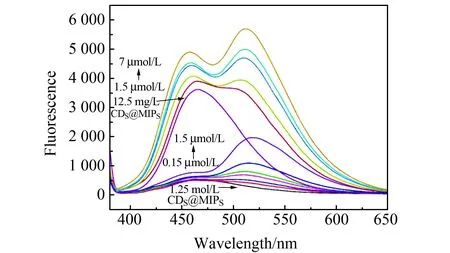
图4 CDs@MIPs的荧光光谱Fig.4 Fluorescence spectra of CDs@MIPs
选用CDs@NIPs两个浓度分别为1.25 mg/L、12.5 mg/L,对于低浓度CDs@NIPs吸附核黄素的浓度为0.15、0.25、0.4、0.5、1.5 μmol/L进行检测,得出线性方程为:Y=1.0990X+0.8664,R2=0.9573;而高浓度CDs@NIPs与核黄素浓度不呈线性关系。通过比较CDs@MIPs与CDs@NIPs两者线性关系可知,CDs@NIPs吸附能力小于CDs@MIPs,说明CDs@MIPs具有较好的特异性吸附能力。
与其它已报道的方法进行对比,此方法的线性范围或检出限比其它的方法具有优势,如表1所示。

表1 比较不同检测核黄素的方法
2.4 CDs@MIPs选择性
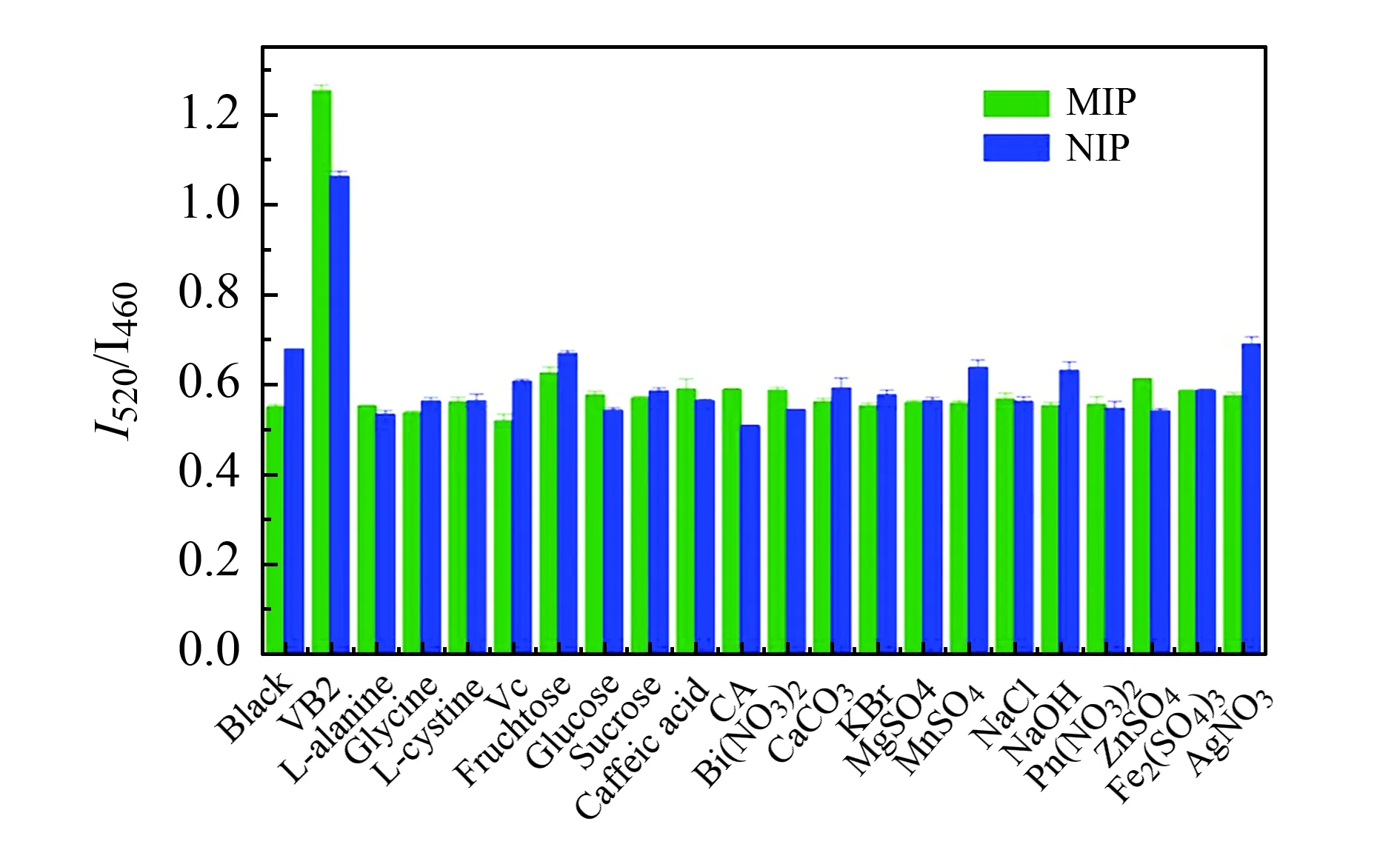
图7 CDs@MIPs的选择性Fig.7 The selectivity of CDs@MIPs
将1 mL浓度2.5 mg/L CDs@MIPs溶液加入10 mL离心管中,然后加入1 mL 80 μmol/L的其它物质。从图5中可以看出CDs@MIPs、CDs@NIPs吸附核黄素的I520/I460荧光比值比吸附其它物质高,因为核黄素520 nm处有荧光信号,使得荧光增强从而比值增强,CDs@MIPs、CDs@NIPs吸附其它物质的比值差不多。而且可以看出CDs@MIPs吸附核黄素的比值比CDs@NIPs的高,是因为CDs@MIPs利用空穴特异性吸附核黄素,使得核黄素浓度升高,说明CDs@MIPs选择性好。
2.5 样品测定
选择市面上常规的果汁,取10 mL果汁过滤稀释至100 mL。将1 mL的CDs@MIPs溶液加入到10 mL离心管中,然后分别加入0.5 mL果汁和0.5 mL不同浓度的核黄素。如表1所示,原果汁中没有检测出核黄素含量。选择分别加入0.3、0.7、2.0、6.0 μmol/L 4个浓度的核黄素于样品中。从表中可以看出回收率范围为82.2%~90.4%,相对标准偏差(RSD)为0.88%~1.15%。

表2 果汁中核黄素的检测
3 总结
本文成功制备核黄素印迹的CDs@MIPs材料,建立了对核黄素特异性吸附检测的比率荧光传感器,其线性范围为0.15~7.0 μmol/L,检出限为8.48 nmol/L。此荧光传感器稳定性好,灵敏度高,具有特异性,可以达到对样品中核黄素特异性吸附检测的效果,因此此传感器有望在样品前处理技术中得到进一步应用。

