慢性乙型肝炎患者外周血SOCS3 mRNA的表达及其与Th17的关系
赵寅洲,张茹薏,赵家洁,李敏玥,宋 瑞,游 晶
(1. 昆明医科大学第一附属医院感染性疾病和肝病科 国家卫生健康委员会毒品依赖和戒治重点实验室,云南 昆明 650032; 2. 云南省第一人民医院感染性疾病科与肝病科,云南 昆明 650034)
我国乙型肝炎病毒(hepatitis B virus, HBV)感染人群数量庞大,为全球乙型肝炎病毒表面抗原(hepatitis B surface antigen, HBsAg)阳性人数最多的国家,有慢性乙型肝炎(chronic hepatitis B, CHB)患者2 000万~3 000万[1]。HBV感染慢性化的发病机制至今仍未阐释清楚,其中CD4+T淋巴细胞的分化和功能障碍可能是导致机体免疫对HBV清除障碍的主要原因之一[2]。辅助性T细胞17(helper T cell 17, Th17)和调节性T细胞(regulatory T cell, Treg)是CD4+T淋巴细胞的两个亚群,大多数研究[3-4]显示在慢性HBV感染过程存在Th17/Treg失衡,并且主要以Th17升高为主,而Th17及其效应分子白细胞介素(interleukin,IL)-17A、IL-23的高表达可能促进肝脏炎症的发生发展,并与肝纤维化进展密切相关。其中维甲酸相关孤儿核受体γt(retinoid-related orphan nuclear receptor gammat, RORγt)是Th17主要的转录因子,在Th17分化和发育过程中都起着关键的作用,而细胞因子信号转导抑制因子3(suppressor of cytokine signaling 3, SOCS3)是JAK/STAT信号通路经典的负反馈抑制因子,JAK/STAT信号通路在调节RORγt的表达中发挥着重要的作用[5-6]。本文主要通过研究CHB患者SOCS3 mRNA表达情况,探索其与Th17的关系,从而寻找可能影响CHB患者Th17异常表达的因素。
1 对象与方法
1.1 研究对象 选取2021年2—8月于昆明医科大学第一附属医院门诊就诊的CHB患者30例及同期至该院门诊的15例正常体检人员为对照组。研究对象同意入组研究后,收集患者血标本和临床资料。本研究符合《赫尔辛基宣言》的伦理标准,并经昆明医科大学第一附属医院伦理委员会讨论通过,所有入组对象均知情同意。
1.2 纳入与排除标准 所有CHB患者均符合以下标准:(1)纳入标准(需满足以下所有条件):①符合《慢性乙型肝炎防治指南(2019年版)》[2]对于CHB的诊断标准;②既往HBsAg阳性>6个月,且既往或目前存在肝功能异常或肝影像学异常情况;③入组前至少半年以上未行核苷(酸)类似物、干扰素等抗病毒药物治疗。(2)排除标准(符合以下任一条件):①由药物、毒物及其他原因导致的慢性肝炎;②合并甲型、丙型、丁型、戊型等嗜肝病毒及其他非嗜肝病毒感染;③合并重度脂肪肝、酒精性脂肪肝、自生免疫性肝病及终末期肝病,如肝硬化、肝癌等其他肝病;④合并自身免疫性疾病、免疫缺陷性疾病及其他严重基础疾病所致的肝损伤;⑤不明原因的肝损伤;⑥妊娠期妇女。正常对照组符合以下条件:①HBsAg、乙型肝炎病毒e抗原(hepatitis Be antigen,HBeAg)阴性,乙型肝炎病毒表面抗体(hepatitis B surface antibody,HBsAb)阳性或阴性,肝功能正常;②无高血压、糖尿病、冠心病、脑梗死等基础疾病史;③无自身免疫性疾病、各种急慢性肝病及各种肿瘤性疾病史;④近期无各种急慢性感染性疾病史;⑤近期未使用过任何免疫相关药物。
1.3 研究方法 采集所有入组研究对象清晨、空腹时静脉血约9 mL,其中采用EDTA抗凝管的血标本2支,1支血标本立即用于流式细胞术检测外周血Th17和Treg细胞频数,1支血标本送至实验室,备4只新的1.5 mL EP管,每支EP管中加入200 μL新鲜血和800 μL裂解液后立即吹打混匀,贮存于-80℃冰箱中,待收集完标本后全用于提取外周血RNA;采用不含抗凝剂管的血标本1支,室温孵育20 min,然后4℃ 3 000 rpm离心15 min后立即分装上清(血清),并于-80℃条件下保存用于后续细胞因子表达水平检测。
1.3.1 主要的试剂和仪器 (1)流式细胞术主要实验试剂:人外周血淋巴细胞分离液购自TBD公司,RPMI 1640 medium、胎牛血清(FCS)购自美国Gibco公司,佛波酯PMA 50ng/mL购自北京索莱宝科技有限公司,高尔基体阻断剂2 μmol/mL、Stain Buffer缓冲液购自美国BD公司,Cytofix/Cytoperm固定/破膜缓冲试剂盒(包括Fixation/Permeabilization solution、BD Perm/Wash Buffer 10×)、PE-Cy7 Mouse Anti-Human CD4抗体、PE Mouse anti-Human IL-17A抗体、同型对照抗体购自美国Biolegend公司。酶联免疫吸附试验(ELISA)主要实验试剂:人IL-17/IL-17A ELISA试剂盒(EHC170)、人IL-23 ELISA试剂盒(EHC171)购自深圳欣博盛生物科技有限公司。qRT-PCR实验主要实验试剂:SureScript-First-strand-cDNA-synthesis-kit、BlazeTaqTMSYBR®Green qPCR Mix 2.0购自GeneCopoeia,Nuclezol LS RNA Isolation Reagent购自ABP Biosciences Inc,引物购自擎科生物,无RNase水购自Biteke Gorporation,DL2000 DNA Marker购自Takara,核酸染料购自北京百泰克生物技术有限公司。(2)主要实验仪器:Attune®NxT声波聚焦流式细胞仪,5% CO2温箱购自CRYSTAL 精骐,低温高速冷冻离心机购自安徽中科中佳科学仪器有限公司;酶标仪(ELX800)购自美国BioTek,隔水式恒温培养箱(GHP-9050N)购自上海一恒科学仪器有限公司;紫外分光光度计(752)购自上海菁华科技仪器有限公司,核酸电泳装置、紫外观察箱购自北京市六一仪器厂,2720 Thermal Cycler 普通PCR仪购自Applied Biosystems,CFX96实时定量荧光PCR仪购自Bio-Rad,96孔定量PCR板购自ABI(4346906),凝胶成像系统QuickGel 6100购自Monad,冷冻高速离心机购自Thermo公司。
1.3.2 外周血Th17细胞频数的检测 采用密度梯度离心法分离获得外周血单个核细胞(peripheral blood mononuclear cells, PBMC),将上述分离到的PBMC稀释为1×106个/mL的PBMC悬液。取1 mL上述PBMC悬液加入3 mL RPMI 1640完全培养基中,在37℃ 5% CO2孵箱培育过夜,时间不少于12 h;向上述培育过夜的混合液体中加入1 mL细胞刺激剂孵育5 h。加入5 μL表面抗体PE-Cy7 Mouse Anti-Human CD4进行细胞外抗体标记染色;加入300 μL 1×Cytofix/Cytoperm固定破膜剂破膜后,加入5 μL胞内抗体PE Mouse anti-Human IL-17A进行细胞内抗体标记染色(具体严格按照操作说明进行)。4℃,1 300 rpm离心5 min,弃上清后涡旋,加350 μL预冷的staining buffer缓冲液上流式仪检测,用Flowjo-v10流式细胞分析软件进行分析。本试验结果描述的Th17细胞频数即Th17细胞绝对计数。
1.3.3 血清IL-17A和IL-23表达水平的检测 本试验采用ELISA双抗体夹心法测定细胞因子IL-17A和IL-23表达水平,具体操作均严格按照相应说明书进行。
1.3.4 外周血SOCS3、RORγt mRNA表达水平的检测 (1)采用一步法提取外周血总RNA,电泳检测完整性,分光光度仪检测RNA纯度和浓度。(2)RT-PCR:按照下列顺序依次加入各个试剂和溶液进行逆转录体系的配置,见表1。配置完成后短暂离心,在普通PCR仪上按照如下条件逆转录:第一步:25℃,5 min;第二步:42℃,45 min;第三步:85℃,5 min;第四步:4℃,hold。(3)qRT-PCR反应:使用广州Genecopoeia公司的BlazeTaqTMSYBR®Green qPCR Mix 2.0试剂盒,每个样本设3个复孔,以SOCS3、RORγt mRNA作为目的基因,GAPDH作为内参基因进行qRT-PCR检测。引物的合成由擎科生物公司完成,引物序列见表2。先将上述逆转录产物cDNA稀释5倍,所有样品必须按照同一倍数进行稀释,再进行下述qPCR反应。qPCR扩增反应体系的配置见表3。上述反应体系配置好后短暂离心,按95℃预变性30 s,95℃变性10 s,60℃退火20 s,72℃延伸30 s条件在CFX96实时定量荧光PCR仪进行40个循环的反应。扩增完成后,从起始温度60℃开始缓慢加热到最终温度95℃反应10 s得到qPCR反应产物的熔解曲线。反应结束后确认扩增曲线及熔解曲线,读取Ct值。(4)结果分析:用2-△△Ct法计算基因的相对表达量,△Ct=Ct(目的基因)-Ct(内参基因);△△Ct=△Ct(试验组)-△Ct(对照组);最后计算2-△△Ct值。

表1 逆转录体系配置

表2 SOCS3、RORγt和GAPDH基因特异性引物序列(5’→3’)

表3 qPCR扩增反应体系
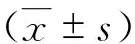
2 结果
2.1 一般情况 两组患者组内男、女比例及年龄大小比较,差异无统计学意义(均P>0.05)。CHB患者肝功能指标丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)水平均较对照组高,差异有统计学意义(均P<0.05)。CHB患者病毒指标分析等见表4。
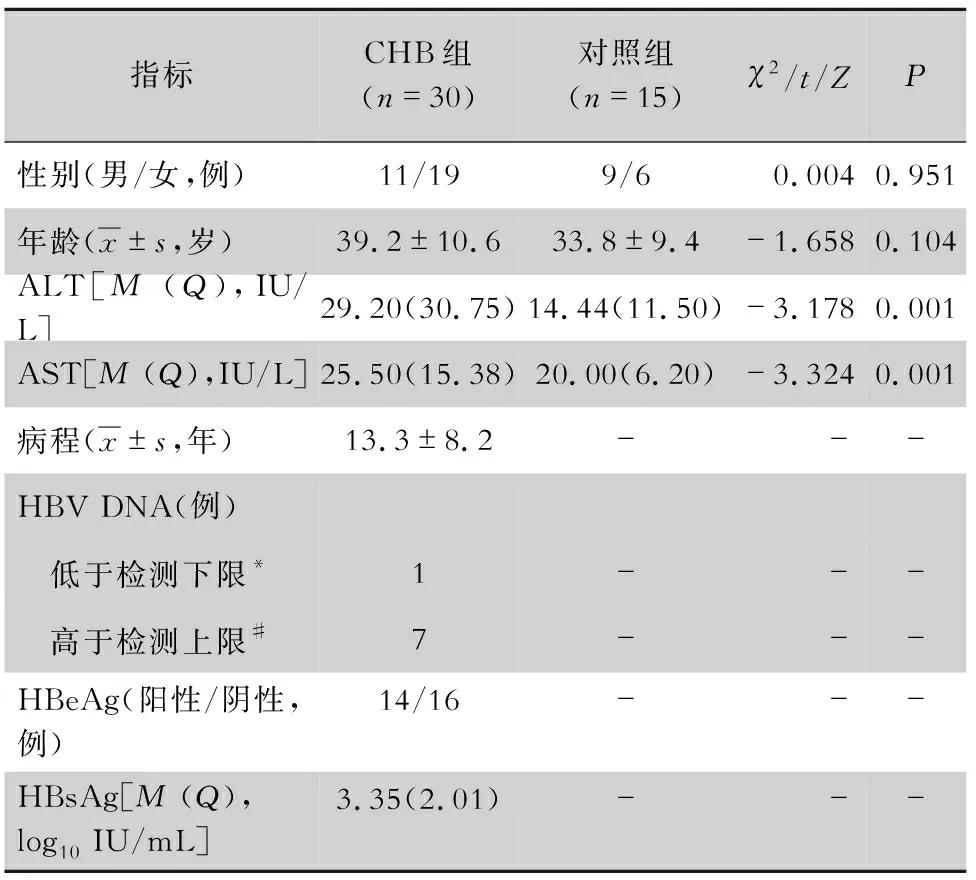
表4 两组患者一般资料、肝功能指标及病毒指标比较
2.2 Th17细胞频数及其效应分子IL-17A和IL-23表达水平分析 试验结果显示CHB组患者Th17细胞频数、IL-17A和IL-23表达水平均高于对照组,差异均有统计学意义(均P<0.05)。见表5。
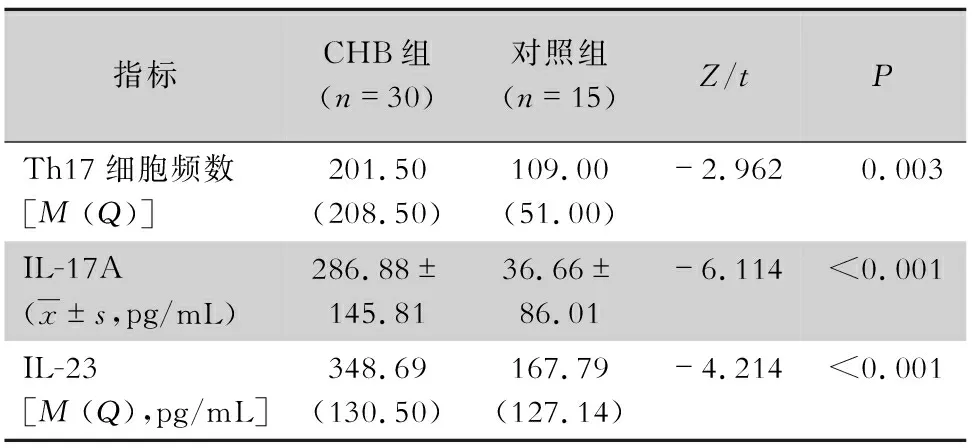
表5 两组Th17细胞频数及其效应分子表达水平比较
2.3 外周血SOCS3、RORγt mRNA表达水平分析 试验结果显示,CHB患者外周血SOCS3、RORγt mRNA表达水平高于对照组,差异均有统计学意义(Z值分别为-3.074、-2.765,均P<0.05)。见图1。

注:红线代表中位数和95%置信区间[M(95%CI)]。
2.4 相关性分析 与HBV DNA水平(用HBV DNA定量数据表示)进行Spearman秩相关性分析,均选取在检测仪器检测范围内的患者,即HBV DNA定量为(1×101~1×108) IU/mL。
2.4.1 CHB患者HBV DNA水平与患者其他指标相关性分析 相关性分析结果显示,CHB患者HBV DNA水平与Th17细胞频数、IL-17A表达水平以及SOCS3、RORγt mRNA表达水平之间存在正相关(r值分别为0.570、0.563、0.662、0.561,均P<0.05),而与IL-23表达水平、ALT和AST水平无相关关系(均P>0.05)。见图2。
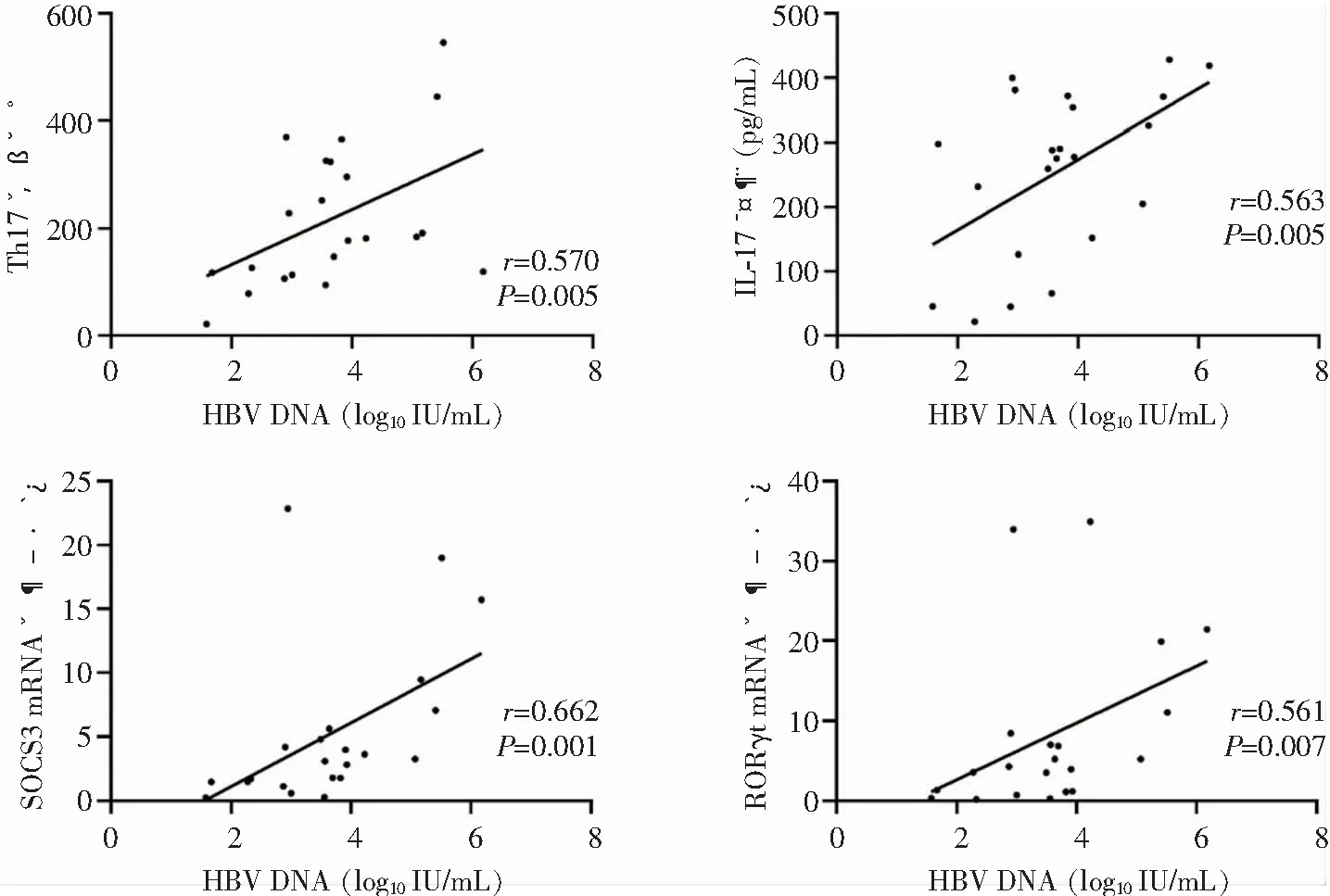
图2 CHB患者HBV DNA水平与其他指标散点图(n=22)
2.4.2 CHB患者SOCS3 mRNA表达水平与其他指标相关性分析 分析结果显示,CHB患者SOCS3 mRNA表达水平与Th17细胞频数、IL-17A、RORγt mRNA表达水平存在正相关(r值分别为0.626、0.826、0.552,均P<0.05),而与IL-23、肝功能指标无相关关系(均P>0.05)。见图3。
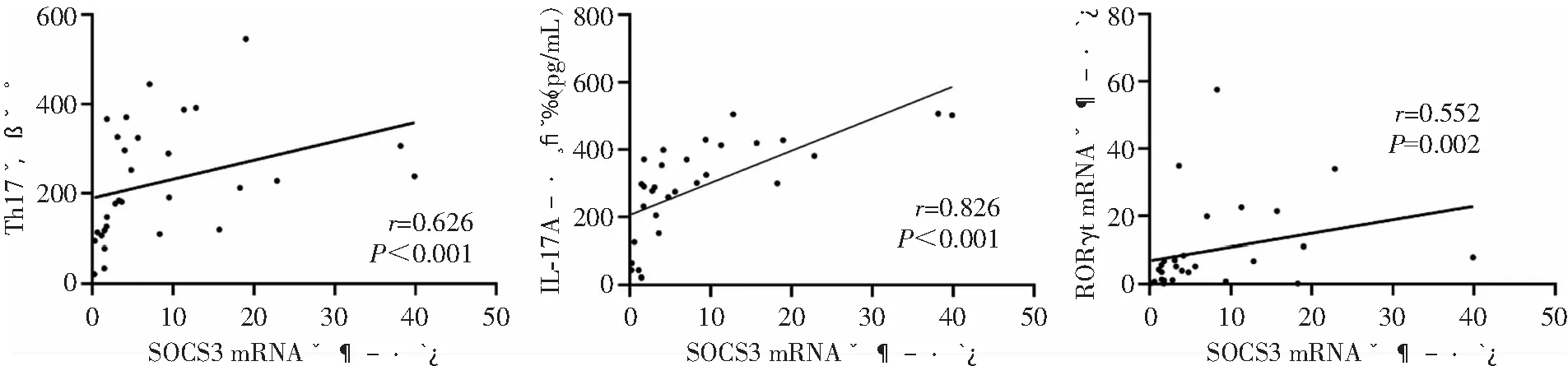
图3 CHB患者SOCS3 mRNA表达水平与Th17细胞频数、IL-17A、RORγt mRNA表达水平散点图(n=30)
3 讨论
目前,国内外大量研究[7-8]证实,CHB患者存在Th17/Treg失衡,而且该平衡主要以Th17升高为主,Th17/Treg失衡还可预示肝纤维化进程。本研究主要通过细胞水平、转录水平寻找可能影响CHB患者Th17升高的因素,结果发现CHB患者外周血Th17细胞频数、IL-17A和IL-23表达水平均明显升高,并且Th17及其效应分子IL-17A与HBV病毒载量之间均存在正相关。
国内研究[9-11]显示,在CHB患者外周血单个核细胞中Th17及其效应分子IL-17A表达水平升高,其升高可能促进了HSCs的活化,进一步加重肝纤维化程度。肝脏中Th17多集中在肝纤维化较严重的区域,Th17数量与反映肝纤维化程度的血清学标志物呈正相关[12]。因此,推测IL-17A、IL-23可能是Th17在慢性HBV感染过程中发挥免疫功能的主要效应分子之一。研究[13-14]证实,IL-17A能通过诱导中性粒细胞的募集来促进肝脏炎症的发生发展,而HSCs细胞膜表面可高表达IL-17受体(IL-17 receptor, IL-17R),IL-17A也可刺激肝脏库普弗细胞(Kupffer cells, KCs)分泌细胞因子IL-6、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和TGF-β1,进一步激活HSCs,加重肝细胞炎症及纤维化程度。
本研究进一步分析了CHB患者外周血SOCSC3 mRNA表达水平与病毒载量、Th17及其效应分子和特征性转录因子的关系,结果显示CHB患者外周血SOCS3、RORγt mRNA高表达,SOCS3 mRNA表达水平与Th17细胞频数、IL-17A和RORγt mRNA表达水平均呈正相关。研究[6]发现,SOCS3在胸腺T细胞的正常分化及T辅助细胞的极化过程中起着重要的调节作用,SOCS3主要通过调节IL-23/STAT3信号通路影响Th17的分化和成熟。在动物试验中发现[15],M1巨噬细胞相关的SOCS3在炎症反应中起到了正性调节的作用,对于某些促炎因子的产生发挥积极的作用,推测SOCS3可能通过基因特异性方式调节促炎介质的表达;并且该研究还发现选择性沉默SOCS3基因的巨噬细胞驱动T效应细胞分化的潜力下降,尤其对Th17分化影响更大。而国内有关干扰素抗病毒治疗效果的研究[16-17]显示,CHB患者接受干扰素抗病毒治疗后无应答组患者外周血PBMC及肝组织中SOCS3 mRNA表达量明显升高,而在应答组SOCS3 mRNA表达量则明显下降,推测SOCS3 mRNA可能会影响干扰素抗病毒效果。因此,推测在慢性HBV感染过程中HBV DNA水平的升高可能通过某些机制促进了SOCS3 mRNA的表达,SOCS3 mRNA的异常升高可能通过调节RORγt mRNA的表达从而影响Th17的分化和功能,并进一步影响慢性HBV感染过程中Th17/Treg的平衡状态。
综上所述,目前慢性HBV感染的免疫机制仍有待进一步阐述,而大多数研究发现CHB患者中存在Th17高表达的状况。本研究通过探索CHB患者外周血SOCS3 mRNA的表达与Th17的关系,发现SOCS3 mRNA在CHB患者外周血中异常高表达,并与Th17细胞频数存在正相关关系,推测SOCS3 mRNA异常表达可能通过调节RORγt mRNA的表达来影响CHB患者Th17的分化及其效应分子的分泌,也为进一步研究CHB患者中Th17异常高表达的机制提供了新的思路,并为寻找恢复慢性HBV感染中Th17/Treg平衡的治疗手段提供一定的思路,也是后续进一步研究的方向。
利益冲突:所有作者均声明不存在利益冲突。

