蝉棒束孢交配型基因MAT的群体分布特征
满海乔,王 娇,唐光甫,桂艳玲,韩 洁,赵杰宏
(贵州中医药大学 药学院,贵州省中药生药学重点实验室,贵州 贵阳 550025)
0 引言
【研究意义】 蝉花(Cordycepscicadae)为我国传统名贵中药材,是由虫生真菌蝉棒束孢〔IsariacicadaeMiquel;同物异名:蝉拟青霉Paecilomycescicadae(Miquel) Samson〕寄生蝉若虫后形成的菌虫复合体[1]。早在南北朝的《雷公炮炙论》中已有记载,历代医药典籍对蝉花有大量描述,其具疏散风热、透疹、明目退翳的功效[2]。近代研究表明,蝉花有改善肾功能、抗肿瘤、降血糖等药理作用[3-4],临床上有望成为冬虫夏草的替代药。蝉花主要生长环境为竹林以及热带和亚热带的阔叶林等,遍布在中国秦岭至淮河以南的省份[5-6],因为其味道鲜美,营养丰富,民间有长期食用的习惯,已成为药食两用的重要虫草资源。虫草往往有无性型和有性型两种形态,自然界常见的是有性型,如蛹虫草(Cordycepsmilitaris)和冬虫夏草(C.sinensis),但蝉花却主要是无性型(即蝉棒束孢),其有性型极其稀缺,也无法通过人工培养获得,导致蝉花有性型的药材基原混乱,至今也未知蝉花有性型稀缺的原因。因此,解析蝉花有性生殖的遗传调控机制对其深入研发具有重要意义。【前人研究进展】近年来,刘爱英等[7]从广西乐业天坑采集1株有性型和无性型共存的复型蝉花标本,并将其命名为神木蝉虫草(C.cicadae-SM sp.Nov.Liu Ai-Ying&Zou Xiao);李增智等[8]从江西井冈山采挖到蝉花有性型标本,命名为C.chanhuaZ.Z.Li,F.G.Luan,Hywel-Jones,C.R.Li &S.L.Zhang,sp.nov.,并指出与刘爱英等[7]报道的标本在显微结构上存在区别,因此蝉花有性型仍存在争议。有性生殖能去除真菌有害基因突变,还可以产生基因型多样性,增强环境适应性[9-10]。虫草属真菌的有性生殖主要由交配型基因MAT参与调控。MAT基因及其编码蛋白具有调控生殖器官分化、营养繁殖和子囊壳形成等作用[11-12]。根据MAT基因在单倍体细胞中的分布情况,有性生殖可分为同宗配合和异宗配合[13-14]。同宗配合是同时含有MAT1-1和MAT1-2交配型基因[15],1株即可完成有性生殖;而异宗配合含有不同交配型基因,需不同交配型的菌株共同完成有性生殖[16-18]。MAT1-1含MAT1-1-1、MAT1-1-2和MAT1-1-3交配型基因,其中,MAT1-1-1研究较多,编码含HMG α-box保守域的转录因子[19-20];MAT1-2仅含交配型基因MAT1-2-1,编码含HMG box保守域的转录因子[21-22]。【研究切入点】蝉花有性型稀缺,其是否与蝉棒束孢交配型基因MAT的序列结构、基因变异及基因分布特征有关,尚未见报道。【拟解决的关键问题】通过研究7省12市100份蝉花标本中虫生真菌蝉棒束孢的MAT基因,初步揭示蝉棒束孢MAT基因的分布特征和多样性,为提高蝉花的生殖率提供参考。
1 材料与方法
1.1 菌种
新鲜蝉花标本共100个,采自全国7省12市(表1)。用酒精棉球擦拭虫体表面,无菌镊子轻轻将其掰开,接种针挑取少许内菌核,接种于常规沙氏固体培养基上,培养7 d和14 d时观察记录各菌株的菌落形态及微观结构。
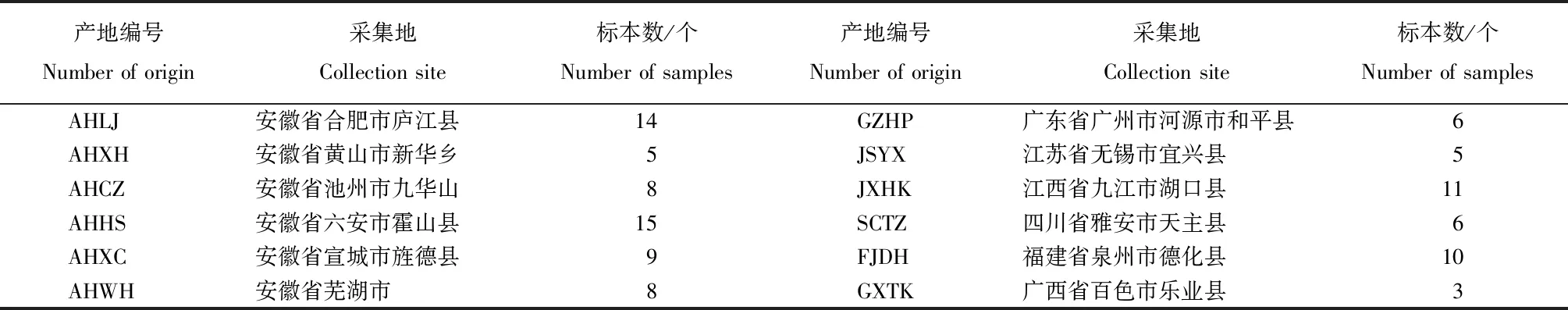
表1 蝉花标本的来源Table 1 Source of Cordyceps cicadae samples
1.2 ITS和MAT序列扩增
用基因组提取试剂盒(购自北京天根生化)提取各菌株的基因组DNA,采用引物ITS1/4、1MAT1-1F/R、2MAT1-1F/R、gaoMAT1-1F/R和gaoMAT1-2F/R(表2)分别扩增目标序列,反应体系:上下游引物(10 μmol/L)各1 μL,2×Taq PCR Mix 10 μL,模板2 μL,最后用ddH2O补足20 μL。PCR反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环;72℃延伸10 min。PCR产物送华大基因测序。

表2 ITS和MAT序列的扩增引物Table 2 Amplification primers of ITS and MAT sequences
1.3 聚类分析
获得的ITS或MAT序列在NCBI进行 Blastn(https://www.ncbi.nlm.nih.gov/blast/)比对,选取覆盖率和相似性最高的菌种作为分子鉴定结果。在MEGA 7中,将获得的不同ITS序列进行Align对齐,截去两端不齐序列后,选择Phylogenetic Analysis,点击Phylogeny,选择Construct/Test Neighbor-Joining Tree,更改No.of Bootstrap Replications为1 000,其余参数为默认值点击Compute,最后查看和下载聚类树。
2 结果与分析
2.1 不同蝉花的形态多样性
不同来源的蝉花标本均在虫体上具有典型的无性型孢梗束结构,但未发现有性型子座。不同产地蝉花的孢梗束长短、色泽和产孢量差异较大,其中,福建产蝉花的孢梗束较细长;广州的较短,产孢量也较小;安徽宣城、安徽霍山、安徽新华、广州和平蝉花的孢梗束金黄色,福建德化的淡黄色,四川雅安的棕色。蝉花菌种在沙氏培养基上的菌落呈多层轮状。显微镜下各菌株产孢结构的瓶梗基部膨大,顶端骤尖,孢子为长椭圆形,串生,孢子大小(5.0~7.5) μm ×(2.5~5.0) μm,产孢结构无明显差异,具有典型的蝉棒束孢显微特征(图1)。
2.2 ITS序列聚类
对从蝉花分离的100份菌株进行ITS序列扩增和测序,经NCBI blastn比对,100份
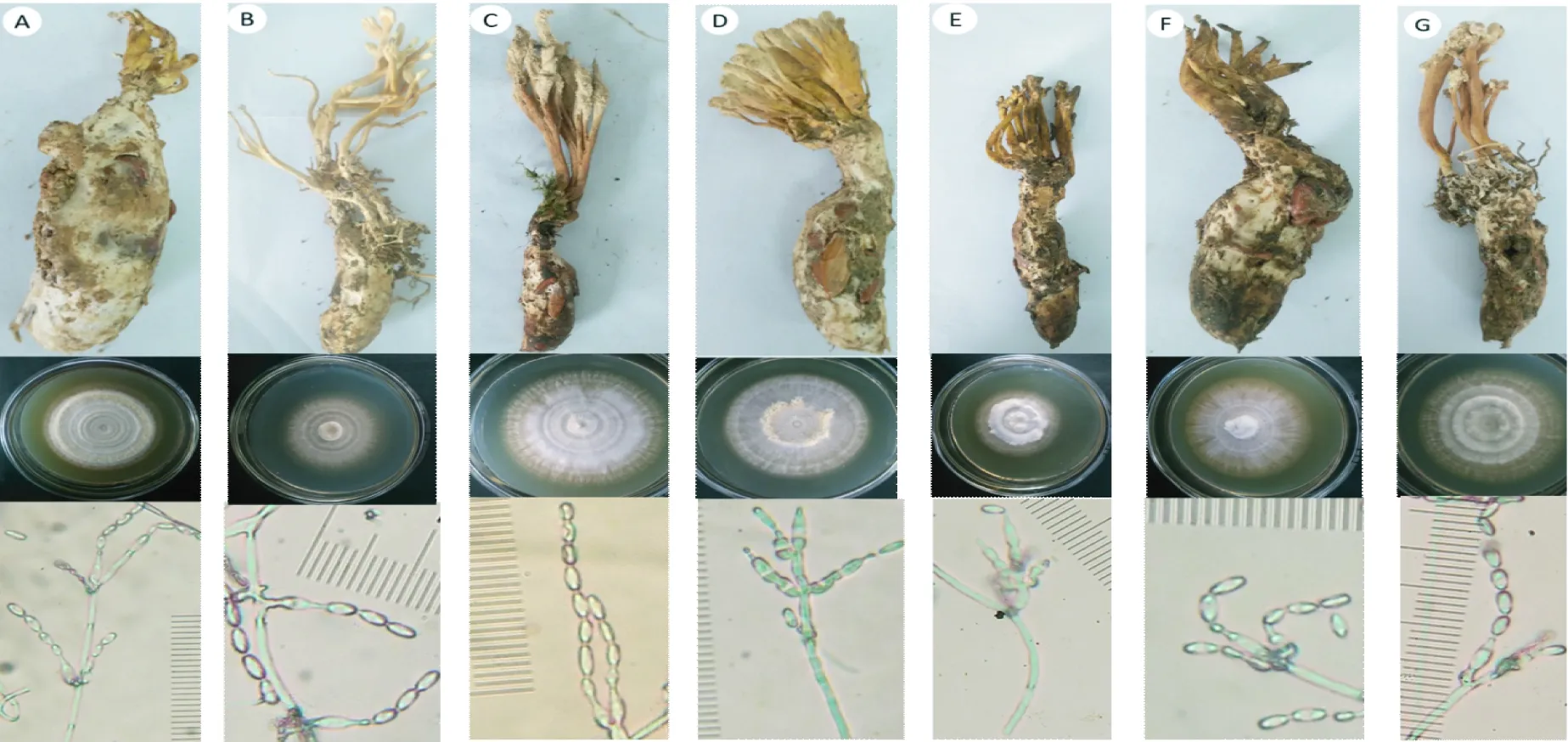
注:A为广州和平3,B为福建德化1,C为四川天主4,D为安徽霍山5,E为安徽宣城3,F为安徽宣城9,G为安徽新华2;测微尺为2.5 μm/小格。
菌株与NCBI上蝉花C.cicadae(GenBank:MN128643.1)的序列相似性最高。随机选择从不同产地蝉花分离的13份菌株与NCBI上蝉拟青霉P.cicadae(GenBank:HQ874633.1)、环链棒束孢I.cateniannulata(GenBank:KT944289.1)、玫烟色棒束孢I.fumosorosea(GenBank:KR184828.1)、斜链棒束孢I.cateniobliqua(GenBank:KP743151.1)、爪哇棒束孢I.javanica(GenBank:MF416455.1)、日本棒束孢I.japonica(GenBank:AT001673.1)以及蝉花C.cicadae(MF460361.2,KY924492.1,MZ373136.1,MN128643.1)的ITS序列聚类分析,以产黄青霉Penicilliumchrysogenum(GenBank:U57323.1)为外群,由MEGA 7构建系统发育树(图2)显示,13份菌株与蝉拟青霉和蝉花聚为一类,支持率为100%,与其他棒束孢属菌种的亲缘关系较远,进一步证明该试验的菌株是从蝉花分离的蝉棒束孢。
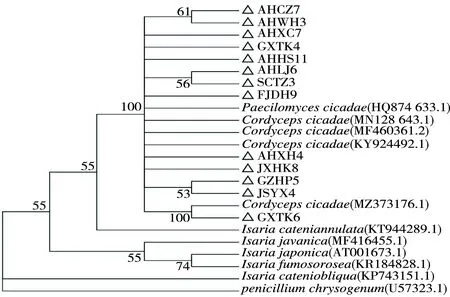
注:∆为研究分离菌株。Note:∆ indicates studied isolated plant.图2 部分不同来源蝉棒束孢ITS序列进化树Fig.2 ITS sequence cladogram of different I. cicadae strains from different sources
2.3 MAT序列的克隆
用引物分别克隆各菌株的1MAT1-1-1、2MAT1-1-1、gaoMAT1-1-1和gaoMAT1-2-1靶标序列,获得的片段分别是1 150 bp、1 850 bp、480 bp和362 bp(图3),符合预期大小。测序表明,1MAT1-1-1有HMG α-box功能域,2MAT1-1-1缺失HMG α-box,gaoMAT1-1-1为1MAT1-1-1的部分序列,gaoMAT1-2-1具有HMG box。以FJDH7和AHLJ1菌株为例,1MAT1-1-1、2MAT1-1-1分别与NCBI上蝉花MAT1-1-1(GenBank:KP749925.1)的碱基序列相似性为99.80%(覆盖率100%)和99.81%(覆盖率48%),氨基酸序列相似性为100%和42.02%;gaoMAT1-2-1与NCBI上蝉花MAT1-2-1(GenBank:KP749926.1)的碱基序列相似性为99.73%(覆盖率99%),氨基酸序列相似性为90.18%。可见,1MAT1-1-1和gaoMAT1-2-1指向的基因具有功能,2MAT1-1-1的基因可能序列和功能不全。
2.4 MAT序列的分布
PCR检测结果显示,100个菌株中13个菌株仅有1MAT1-1-1,79个菌株仅有gaoMAT1-2-1,其中,兼有1MAT1-1-1和gaoMAT1-2-1交配型基因的菌株有8个(表3),兼有菌株分布在安徽新华、安徽宣城、江西湖口、四川天主和福建德化。2MAT1-1-1与gaoMAT1-2-1同时存在,有1MAT1-1-1(包括兼有gaoMAT1-2-1)的菌株未检测到2MAT1-1-1,但福建产FJDH7和FJDH9菌株同时存在1MAT1-1-1、2MAT1-1-1和gaoMAT1-2-1序列(图3D)。多数地区的菌株以gaoMAT1-2-1占优势,而四川天主和广西乐业菌株以1MAT1-1-1占优势。安徽庐江、安徽霍山、江苏宜兴和广州和平的菌株未检测到1MAT1-1-1。从数据上看,蝉花有同宗配合的潜力,也存在异宗配合的可能,有性生殖的概率较高,但与蝉花有性型稀缺的实际情况不符。
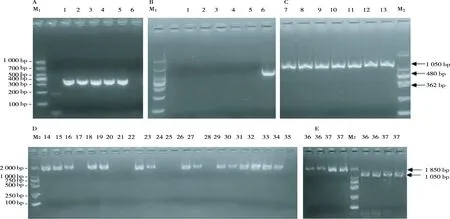
Note:A,gaoMAT1-2-1;B,gaoMAT1-1-1(1~6:GZHP2,AHWH7,AHCZ2,AHXC5,AHXC6 and AHXC7);C,1MAT1-1-1(7~13:AHXC7,AHXC8,AHXC9,AHXH2,AHWH3,AHWH6 and AHCZ4);D,2MAT1-1-1(14~35:AHWH8,JSYX3,JXHK3,JXHK4,JXHK8,JXHK9,SCTZ2,SCTZ6,AHLJ1,AHLJ2,AHXC3,AHXC9,AHXC11,AHXH1,AHXH2,AHCZ1,GZHP1,AHHS12,AHHS13,FJDH6,GXTK1 and ddH2O);E:1MAT1-1-1/2MAT1-1-1(36~37:FJDH7 and FJDH9).M1:DL1 000 DNA marker.M2:DL2 000 DNA marker.图3 部分菌株MAT基因的电泳图谱Fig.3 Electrophoretogram of MAT gene of part strains

表3 不同蝉棒束孢MAT序列存在类型Table 3 Types of MAT sequence in different I.cicadae strains
2.5 MAT序列聚类和结构特性
对21个菌株的1MAT1-1-1序列、87个菌株的gaoMAT1-2-1序列分别进行聚类分析(图4),21个1MAT1-1-1与蝉花已知序列(GenBank:KP749925.1)聚为一枝,支持率99%;87个gaoMAT1-2-1与蝉花已知序列(GenBank:KP749926.1)聚为一枝,支持率98%。安徽来源的多株蝉棒束孢未单独聚类成群,可见相同来源蝉棒束孢菌株间无明显地域居群分布相关性,与参比菌种的亲缘关系较远,其中亲缘关系较近的参考菌种是细脚棒束孢(Isariatenuipes)。
序列比对结果(图4C)显示,1MAT1-1-1为蝉花MAT1-1-1(KP749925.1)的一部分外显子序列,2MAT1-1-1为NCBI 上现有3个独立蝉花基因组(GenBank:ASM296887v1、ASM1021170v1和ASM164478v1)的部分基因序列,在3个蝉花基因组仅有2MAT1-1-1和gaoMAT1-2-1序列,未发现1MAT1-1-1。2MAT1-1-1与1MAT1-1-1仅有30%序列覆盖(覆盖区域相似性99.69%),推测缺失HMG ɑ-box的2MAT1-1-1无功能。

注:A为MAT1-1-1序列聚类分析,B为gaoMAT1-2-1序列聚类分析,C为MAT 1-1-1序列结构示意图;方框为外显子,横线为内含子或居间序列。Note:A:Cluster analysis of MAT1-1-1;B:Cluster analysis of gaoMAT1-2-1;C:Structure diagram of MAT1-1-1;Box:Exon;Horizontal line:Intron or intermediate sequence.图4 蝉棒束孢MAT序列进化树和MAT1-1-1序列结构Fig.4 MAT sequence cladogram of I. cicadae.and MAT1-1-1 sequence structure
3 讨论
蝉花在食品和临床等领域有较广泛的应用,但至今其有性型仍存争议[7-8],现有中医药典籍《中药大辞典》和《中华本草》等著作中记载的蝉花有性型更是被上述报道推翻。出现以上现状的主要原因是蝉花有性型非常稀缺,难以采集也无法人工培养,至今对蝉花的有性生殖知之甚少。
围绕蝉花的交配型基因研究,高扬等[18]将采自安徽各地的40株蝉棒束孢分成了2组,分别含有交配型MAT1-1-1和MAT1-2-1序列,比例接近1∶2,且未发现同时含有2种交配型基因或缺少2种基因的菌株。本研究的靶标序列1MAT1-1-1是根据高扬等[18]发表的蝉花MAT1-1-1序列(GenBank:KP749925.1)设计引物扩增的部分序列(163~1 334 bp),靶标序列2MAT1-1-1是利用MAT1-1-1在NCBI 与蝉花基因组blastn〔database:whole-genome shotgun contigs(wgs);organism:cordyceps cicadae〕,根据获得的最高相似序列及其上下游序列(GenBank:WJIA01000209)设计引物进行扩增分析。
通过检测安徽省6地市59个蝉花标本分离的蝉棒束孢菌株发现,AHXH2、AHXC3和AHXC9同时含有MAT1-1-1(即1MAT1-1-1)和MAT1-2-1(即gaoMAT1-2-1)序列;来自其他6省市的41个蝉花标本分离的菌株中检测到5个菌株同时含有以上2个交配型基因序列,检出率为8%;其他菌株仅含其中1个交配型基因,也未发现完全缺失的菌株。全部1MAT1-1-1与gaoMAT1-2-1的比例为24.14%(接近1∶4),兼有菌株、单1MAT1-1-1菌株、单gaoMAT1-2-1菌株的比例为1∶1.625∶9.875(接近1∶1.5∶10),可见不同交配型分布的比例不对等,对稀少的虫草来说,其有性生殖变得更加困难。
LU等[23]对蝉花BA-001菌株的基因组(GenBank:AEIW00000000)分析发现,蝉棒束孢MAT1-2和1个缺少HMG ɑ-box截短的MAT1-1-1同时存在,在各时期转录组中该截短基因不表达,并且通过单基因或双基因敲除MAT1-2和MAT1-1-1对无性型孢梗束的形成无影响。另外,这种截短现象也发生在植物病原Grosmanniaspp.[24]、甲虫相关真菌Leptographiumprocerum和L.profanum[25]中。本研究从100份蝉棒束孢I.cicadae菌株中也检测到此段截短的MAT1-1-1(即2MAT1-1-1),发现有1MAT1-1-1(包括兼有gaoMAT1-2-1)的菌株却无2MAT1-1-1,2MAT1-1-1常与gaoMAT1-2-1共存,这与上述报道以及NCBI 上现有3个独立的蝉花基因组(GenBank:ASM296887v1、ASM1021170v1和ASM164478v1)序列一致,但福建产FJDH7和FJDH9菌株含有1MAT1-1-1、2MAT1-1-1和gaoMAT1-2-1序列,暗示蝉花交配型基因在进化过程中有着复杂的表现形态,似乎蝉棒束孢同时存在同宗配合和异宗配合的潜力,处于特殊的进化阶段。对于同宗配合和异宗配合的进化,早期认为两者为共同起源,即MAT基因为染色体上同一DNA保守区,该区发生突变,导致不同交配方式产生,后又有研究支持子囊菌中的异宗配合起源于同宗配合[26-27]。因此,蝉花可能成为研究交配型基因进化的重要样本。
通过聚类分析未发现MAT基因的地域分布相关性特征,这可能与各菌株间缺乏基因交流,主要采用无性生殖有关。推测蝉花为了充分适应生存环境,可能通过某种未知的机理,抑制或中断了有性生殖途径,逐渐将无性生殖方式保留。
4 结论
从7省12市100份蝉花标本中分离出蝉棒束孢菌株,对各菌株的MAT基因分析发现,有的菌株仅有1MAT1-1-1或MAT1-2-1,兼有菌株占8%。此外还发现,截短的MAT1-1-1(即2MAT1-1-1)普遍不与1MAT1-1-1共存,常与MAT1-2-1伴存,但FJDH7和FJDH9菌株却同时存在1MAT1-1-1、2MAT1-1-1和MAT1-2-1序列,可见群体中不同蝉棒束孢菌株的MAT基因有4种可能:单1MAT1-1-1、兼有MAT1-2-1和1MAT1-1-1、兼有MAT1-2-1和2MAT1-1-1、共有1MAT1-1-1/MAT1-2-1/2MAT1-1-1序列,给蝉花有性生殖带来不确定性。推测蝉花有性型稀缺与MAT基因的分布模式多样及比例失衡有密切关系。

