原花青素对玉米赤霉烯酮诱导牦牛颗粒细胞氧化损伤的保护作用研究
唐紫雯,程华琴,刘冬菊,彭毛卓玛,杨 雪,李 键*,殷 实*
(1.西南民族大学畜牧兽医学院,成都 610041; 2.西南民族大学 现代生物技术国家民委重点实验室,成都 610041)
牦牛()主要生活在青藏高原地区以及周围空气稀薄的高海拔地区,其肉、皮、骨、角以及粪便能为当地居民所用,具有较高的经济价值。但牦牛具有性成熟晚、繁殖率低及繁殖周期长等劣势,严重限制了高原地区畜牧业的发展。颗粒细胞(granulosa cells,GCs)是哺乳动物卵巢中一类重要的体细胞,颗粒细胞对于卵巢内卵泡和卵母细胞的发育至关重要,颗粒细胞分泌的类固醇激素(如雌二醇和孕酮)和其他多种生长因子如激活素、TGF-β和SCF等能促进卵泡的生长和发育。此外,颗粒细胞可以通过缝隙连接与卵母细胞传递信息,以保证卵母细胞的正常成熟。因此,颗粒细胞功能的正常执行是母畜完成受孕以及生产的前提条件。
活性氧(reactive oxygen species, ROS)是体内线粒体代谢的正常产物之一。当组织和细胞所产生的ROS超过机体抗氧化防御系统的承载能力时,氧化平衡被打破,过量的ROS破坏细胞中DNA、蛋白质、脂质、线粒体和其他重要的细胞成分,破坏细胞膜的结构,刺激端粒缩短,对机体造成损害进而引起病变。环境污染、外源致病菌毒素、高温、强紫外线等均能诱发机体产生氧化应激反应。玉米赤霉烯酮(zearalenone, ZEA)是一种由镰刀菌属产生具有氧化性的非甾体类真菌毒素,因其最早从发霉的玉米中分离出来而得名。ZEA的广泛污染已经成为了全球性问题,每年因毒素污染而造成的粮食损失可达10亿吨。ZEA主要会对动物的消化、免疫、泌尿以及生殖系统等造成损伤。其中,ZEA对生殖系统的损伤尤为严重,主要通过如下两种机制:1)ZEA能与雌激素受体结合,干扰类固醇激素的合成与分泌。2)ZEA能上调ROS水平,损害机体抗氧化防御系统,引起机体氧化损伤,诱导细胞凋亡。因此,寻找缓解ZEA毒性的方法是目前畜牧养殖行业一个亟需解决的问题。
抗氧化剂可以捕获并结合氧自由基,减轻氧化应激对动物生殖系统带来的损伤。原花青素(procyanidins, PC)是从植物器官中提取的一种多酚化合物,无定形粉末,是以不同数量的儿茶素和表儿茶素为基本结构单元结合而成的低聚体和多聚体混合物,是国际公认的超强抗氧化剂之一,其抗氧化性比维生素族更强,能更高效地清除机体内的自由基。具有抗炎、抗辐射、抗衰老、抗肿瘤、防治心脑血管疾病和促进细胞增殖等生物学功能。已有多项研究表明葡萄籽原花青素(grape seed procyanidins,GSPs)能减轻氧化应激对动物生殖系统带来的损伤。如GSPs对沙门菌内毒素导致的鸡卵巢颗粒细胞氧化损伤具有一定的缓解作用,能够回复沙门菌处理后GSH和T-SOD的表达水平。王友良的研究表明,原花青素可明显抑制反式脂肪酸所致小鼠睾丸脂质过氧化损伤作用,提高机体清除自由基能力,又如原花青素能够抑制镉暴露导致的大鼠睾丸组织抗氧化状态的改变,降低丙二醛(MDA)、NO和HO的含量,并提高过氧化氢酶(CAT)、超氧化物歧化酶(T-SOD)以及谷胱甘肽过氧化物酶(GSH-Px)的活性。尽管关于原花青素抗氧化能力研究方面的文献众多,但其在牦牛生殖方面的研究较少,本研究成功分离了牦牛颗粒细胞,在细胞及分子层面初步探讨了原花青素对玉米赤霉烯酮诱导牦牛颗粒细胞产生氧化损伤后细胞活力、增殖生长能力、凋亡程度、激素分泌以及抗氧化性的影响,为今后原花青素禽畜育种上的应用提供了一定的理论依据。
1 材料与方法
1.1 主要试剂及仪器
主要试剂:DMEM/F-12培养基(Gibco),胎牛血清(Gibco),胰蛋白酶-EDTA消化液(Hyclone),青霉素-链霉素溶液100X(Solarbio),玉米赤霉烯酮(上海源叶生物科技有限公司),原花青素(上海麦克林生化有限公司),Anti-FSHR鼠多克隆抗体(Abcam),Goat Anti-Mouse IgG (H+L) FITC-conjugate (Affinit),HE染色试剂盒(Solarbio),CCK-8试剂盒(MCE),TRIzol(Invitrogen),PrimeScriptRT Reagent Kit反转录试剂盒(诺唯赞生物科技有限公司),ChamQ Universal SYBR qPCR Master Mix(诺唯赞生物科技有限公司),牛活性氧(ROS)ELISA试剂盒(鹏世达生物科技有限公司),牛雌激素(E)ELISA 检测试剂盒(鹏世达生物科技有限公司)。
主要仪器:二氧化碳培养箱(Thermo),共聚焦显微镜(Zeiss),倒置显微镜(Olympus),超低温冰箱(Thermo),定量PCR扩增仪(Bio-RAD),紫外分光光度计(岛津),超净工作台(Haier),低温高速离心机(Thermo),涡旋振荡仪(Stuart),超纯水系统(Milli-Q),酶标仪(Thermo)。
1.2 牦牛颗粒细胞的分离培养
试验样品来自四川省成都市青白江唐家寺牛羊肉供应基地,采集3头年龄在3~5岁,生长状况良好,健康的雌性牦牛卵巢,用含1%接近于牦牛体温的双抗的磷酸盐缓冲溶液(PBS)冲洗干净,置于0.9%生理盐水的保温桶中及时带回实验室完成后续处理。在超净工作台中,用10 mL一次性注射器将吸出卵泡液,过200目细胞筛。得到滤液,并转移至2 mL微量离心管中,调整离心机转速为2 000 r·min,时间5 min,小心去除上清液,用含10%胎牛血清(FBS)的DMEM/F-12将沉淀悬浮起来,再次以上一步相同条件完成离心,丢弃上清液,向离心管中加入完全培养基,制成细胞悬液,测细胞活力后,调整细胞密度至1×10个·mL,吹打至无明显沉淀后接种于90 mm培养皿中,于37 ℃,50 mL·LCO的培养箱中培养。待细胞培养至贴壁时,用PBS清洗,弃去未贴壁的细胞及其他杂质,注意保持整个过程的无菌环境及条件。使用胰蛋白酶消化细胞并接种至一个新的细胞培养皿中,之后每隔一段时间进行清洗,换液,继续培养。
1.3 颗粒细胞苏木素-伊红(HE)染色及颗粒细胞免疫荧光染色
使用酒精棉球将专用的细胞爬片上的杂质擦除干净,用75%酒精浸泡48 h,再使用PBS洗去残余酒精,并轻放到细胞培养皿中,37 ℃,50 mL·LCO培养箱中培养,取出80%汇合度的细胞爬片,PBS洗去培养液及其他杂质后,加入4%多聚甲醛(PFA)固定爬片20 min,洗去多聚甲醛,按照HE试剂盒要求进行染色,根据具体情况调整染色时间,爬片干燥后中性树胶固封并镜下观察。以同样的方法制得细胞爬片,加入500 μL 0.5% Triton X-100透膜液透膜20 min后,再用磷酸盐缓冲液清洗3次,在室温条件下,用1 mL 5%牛血清白蛋白(BSA)封闭液封闭1 h,取出盖玻片,置于稀释了200倍的特异性抗体Anti-FSHR鼠多克隆抗体中,于4 ℃冰箱中过夜,之后,使用PBS清洗玻片3次,每次2 min,风干片刻后,滴加500 μL用PBS稀释了300倍的对应二抗Goat Anti-Mouse IgG (H+L) FITC-conjugate,室温避光环境中孵育1 h,DAPI染色封片并用共聚焦显微镜观察细胞染色情况。
1.4 颗粒细胞活力检测
用培养基将牦牛颗粒细胞的密度设置为1×10个·mL,在无菌条件下接种于96孔板,37 ℃,50 mL·LCO培养12 h后,设置空白对照组(Control):更换培养12 h的培养基,新的培养基中不添加ZEA和PC,37 ℃,50 mL·LCO培养24 h。设置ZEA处理组:更换培养12 h的牦牛颗粒细胞培养基,在新的培养基中添加不同浓度的ZEA,使其最终浓度为0、5、10、20、40、60、80和100 μmol·mL,37 ℃,50 mL·LCO培养24 h。设置PC处理组:更换培养12 h的牦牛颗粒细胞培养基,更换新的培养基并添加不同浓度的PC,使其最终浓度为0、0.05、0.5、2.5、5、10、50和100 μg·mL,37 ℃,50 mL·LCO培养24 h。设置ZEA + PC联合处理组:更换培养12 h的牦牛颗粒细胞培养基,在新的培养基中添加50 μmol·mLZEA+5 μg·mLPC,该组与氧化损伤组和PC组以相同的培养条件完成培养。在每个孔添加10 μL CCK-8溶液,继续在相同条件下培养2 h,测定OD,记录结果,遮盖培养板避光室温保存,可多次测定吸光度,并根据说明书所示公式计算细胞活力,进行结果分析。
1.5 颗粒细胞总RNA提取、cDNA合成及实时荧光定量PCR
将细胞培养皿中的液体弃去,用PBS洗净培养液后,加入1 mL冰冷TRIzol反复冲洗培养皿以获得足够多的细胞。收集该液体至1.5 mL无酶离心管中,室温静置5 min,接下来的步骤严格按照TRIzol法进行提取RNA,通过紫外分光光度计测定RNA的浓度及纯度,为挑选浓度和纯度合格的样品,选择在OD与OD的比值处于1.8到2.0之间且OD与OD大于2.0的RNA样本进行后续试验,并于-80 ℃保存备用。将得到的颗粒细胞RNA通过PrimeScriptRT Reagent Kit反转录试剂盒进行反转录,按说明书采用两步法反转录,第一步反应条件:42 ℃ 2 min,第二步反应条件:37 ℃ 15 min,85 ℃ 5 s,将得到的cDNA进行浓度及质量检测后于-20 ℃冷冻保存备用。参照NCBI数据库中公布瘤牛()的相关基因序列,通过NCBI中的Pick Primers在线完成引物的设计,引物序列见表1。使用ChamQ Universal SYBR qPCR Master Mix试剂盒检测牦牛颗粒细胞中各基因的表达情况,RT-qPCR反应体系为15 μL:模板及上、下游引物分别1 μL,2×ChamQ Universal SYBR qPCR Master Mix 7.5 μL,ddHO 4.5 μL。RT-qPCR反应程序:95 ℃预变性4 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共进行40个循环,重复执行该流程,保证每个样本重复3次。qPCR所得Ct值通过2法计算其相对表达,使用SPSS 21.0对定量结果进行方差分析。

表1 qRT-PCR引物序列Table 1 Primer sequences of qRT-PCR
1.6 颗粒细胞ROS水平检测
收集空白对照组(Control)、添加50 μmol·mLZEA处理组及50 μmol·mLZEA+5 μg·mLPC联合处理组培养24 h后的细胞培养液3 000 r·min离心10 min,小心吸取得到上清液。按照牛活性氧(ROS)ELISA检测试剂盒操作说明检测颗粒细胞活性氧水平,迅速使用酶标仪依次测定各样本在450 nm波长处的吸光度。绘制标准曲线,代入数值完成结果的计算。
1.7 雌二醇(estradiol,E2)浓度检测
收集空白对照组(Control)、添加50 μmol·mLZEA处理组及50 μmol·mLZEA+5 μg·mLPC联合处理组培养24 h后的细胞培养液3 000 r·min离心10 min,取上清液备用。使用牛雌激素(E)ELISA 检测试剂盒完成E浓度的检测,依次测定在450 nm下各样本的吸光值,绘制标准曲线,代入数值完成结果的计算。
1.8 数据统计与分析
试验数据采用SPSS 21.0软件处理,采用的统计学方法为Student’s unpaired t-test,统计结果以“mean±SEM”的方式表示,<0.05表示差异显著,<0.01表示差异极显著。
2 结 果
2.1 牦牛颗粒细胞的分离与鉴定
接种牦牛颗粒细胞几个小时后一部分细胞已贴壁生长,原代细胞生长缓慢,且分布不均匀,细胞传代培养后生长迅速,且生长形态更好。为了检测本研究分离培养得到的细胞的纯度,保证后续研究对象的准确性,对牦牛颗粒细胞进行了HE染色,染色情况如图1A所示,颗粒细胞形态大多呈梭形,生长状态良好。免疫荧光染色后的结果表明,所分离得到的细胞能够表达颗粒细胞特异性卵泡刺激素受体(follicle stimulating hormone receptor, FSHR)(图1B),证明本次用于试验的细胞为纯度较高的颗粒细胞。
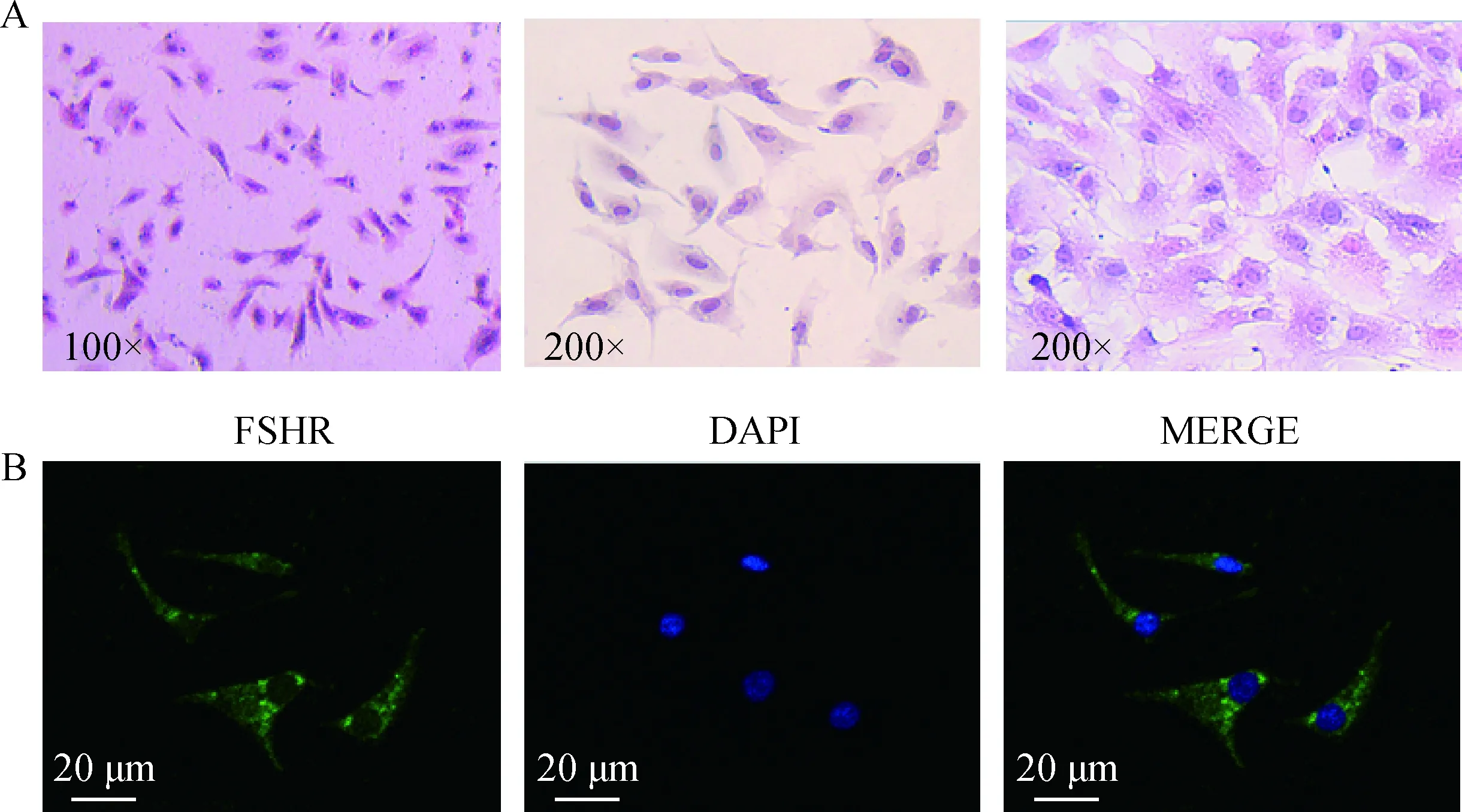
A.不同放大倍数牦牛颗粒细胞HE染色;B.牦牛颗粒细胞FSHR的免疫荧光染色A.HE staining in yak granulosa cells at different magnifications; B. Immunofluorescent staining of FSHR in yak granulosa cells 图1 牦牛颗粒细胞的鉴定Fig.1 Identification of yak granulosa cells
2.2 ZEA和PC对颗粒细胞活力的影响
设立不同浓度的ZEA添加到颗粒细胞培养液中,检测细胞活力后结果显示,在0~100 μmol·mL的范围内随着ZEA浓度增高颗粒细胞活力越低(<0.01,图2),以此为基础计算出ZEA的半数抑制浓度为50 μmol·mL,并以此浓度处理牦牛颗粒细胞建立氧化损伤模型。同样的,应用CCK-8法测定不同浓度PC对颗粒细胞相对存活率的影响来确定后续研究的适宜浓度,由图3可知,当PC浓度小于2.5 μg·mL时,与未添加PC组颗粒细胞的活力相比没有显著影响,随着浓度的上升,PC对颗粒细胞的活力有显著提高作用,且在浓度为5 μg·mL时提高细胞活力的作用最明显,提高了19.1%(<0.01),但随着PC浓度的升高,颗粒细胞的活力逐渐降低,因此本研究后续设定PC浓度为5 μg·mL来研究PC对经ZEA损伤的颗粒细胞的保护作用。
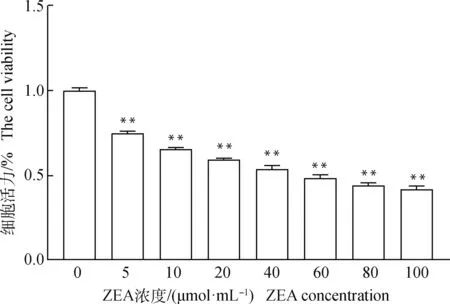
设定对照组为1,其他组别均与对照组做比较,数据表示为 “平均值±SEM ”,n=3, *表示差异显著(P<0.05),**表示差异极显著(P<0.01),下同The control group was set as 1, and all other groups were compared with the control group, * indicated significant difference (P<0.05), Data were presented as “mean±SEM”, n=3, ** indicated extremely significant difference (P<0.01), the same as below图2 不同浓度ZEA处理24 h后牦牛颗粒细胞的活力Fig.2 The viability of yak granulosa cells treated with different concentrations of ZEA for 24 h
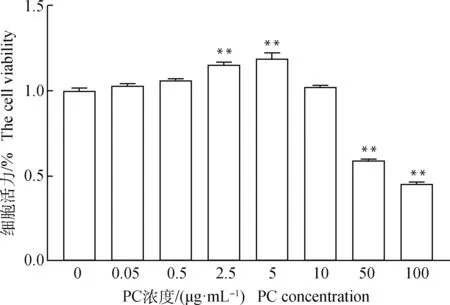
图3 不同浓度PC处理24 h后牦牛颗粒细胞的细胞活力Fig.3 The viability of yak granulosa cells treated with different concentrations of PC for 24 h
2.3 ZEA与PC联合处理后对细胞生长活性的影响
ZEA对颗粒细胞的生长有抑制作用,与ZEA组相比,ZEA + PC联合处理组颗粒细胞数量增加(图4A)。经CCK-8检测结果显示,与ZEA组相比,ZEA + PC联合处理组颗粒细胞活力显著增加了56.5%(<0.01,图4B)。
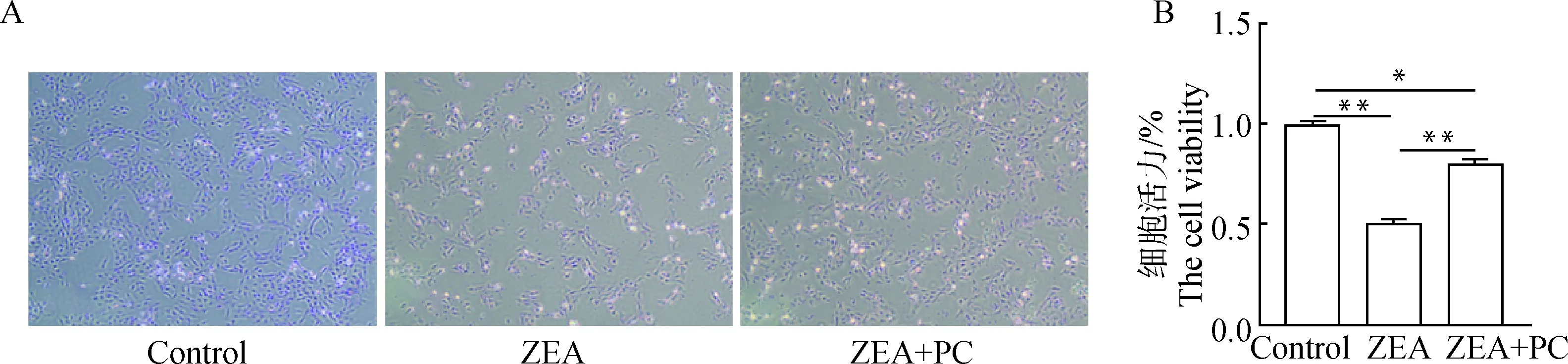
A. ZEA与PC联合处理24 h后牦牛颗粒细胞的生长状态(40×);B. ZEA与PC联合处理24 h后牦牛颗粒细胞的活力A. The growth situation of yak granulosa cells with the combined treatment of ZEA and PC for 24 h(40×); B. The viability of yak granulosa cells with the combined treatment of ZEA and PC for 24 h图4 ZEA与PC联合处理后对牦牛颗粒细胞生长活性的影响Fig.4 The effect of combined treatment of ZEA and PC on the viability of yak granulosa cells
2.4 ZEA与PC联合处理后对颗粒细胞增殖以及凋亡相关基因的影响
添加ZEA后,与对照组相比颗粒细胞中与细胞增殖相关基因和生长相关基因-II mRNA的表达水平极显著下调(<0.01),分别下调了67.3%和52.1%。而与ZEA处理组相比,ZEA+PC联合处理组这两种基因的mRNA表达水平有极显著上升(<0.01),分别上升了78.3%和35.7%(图5A、5B)。与对照组相比,ZEA处理组中颗粒细胞中抑凋亡相关基因和-2 mRNA的表达水平极显著下调(<0.01),分别下调了52.2%和59.2%。而ZEA + PC联合处理组这两种基因的表达水平与ZEA组相比显著上调(<0.05),分别上调了44.5%和49.5%(图5C、5D)。与对照组相比,ZEA处理组中颗粒细胞中与促凋亡相关基因和3 mRNA的表达水平极显著上调(<0.01),分别上调了241.8%和55.0%。而ZEA + PC联合处理组这两种基因的表达水平与ZEA组相比有所下调,其中mRNA的表达水平极显著下调(<0.01),下调了35.2%,3 mRNA的表达水平显著下调(<0.05),下调了17.1%(图5E、5F)。
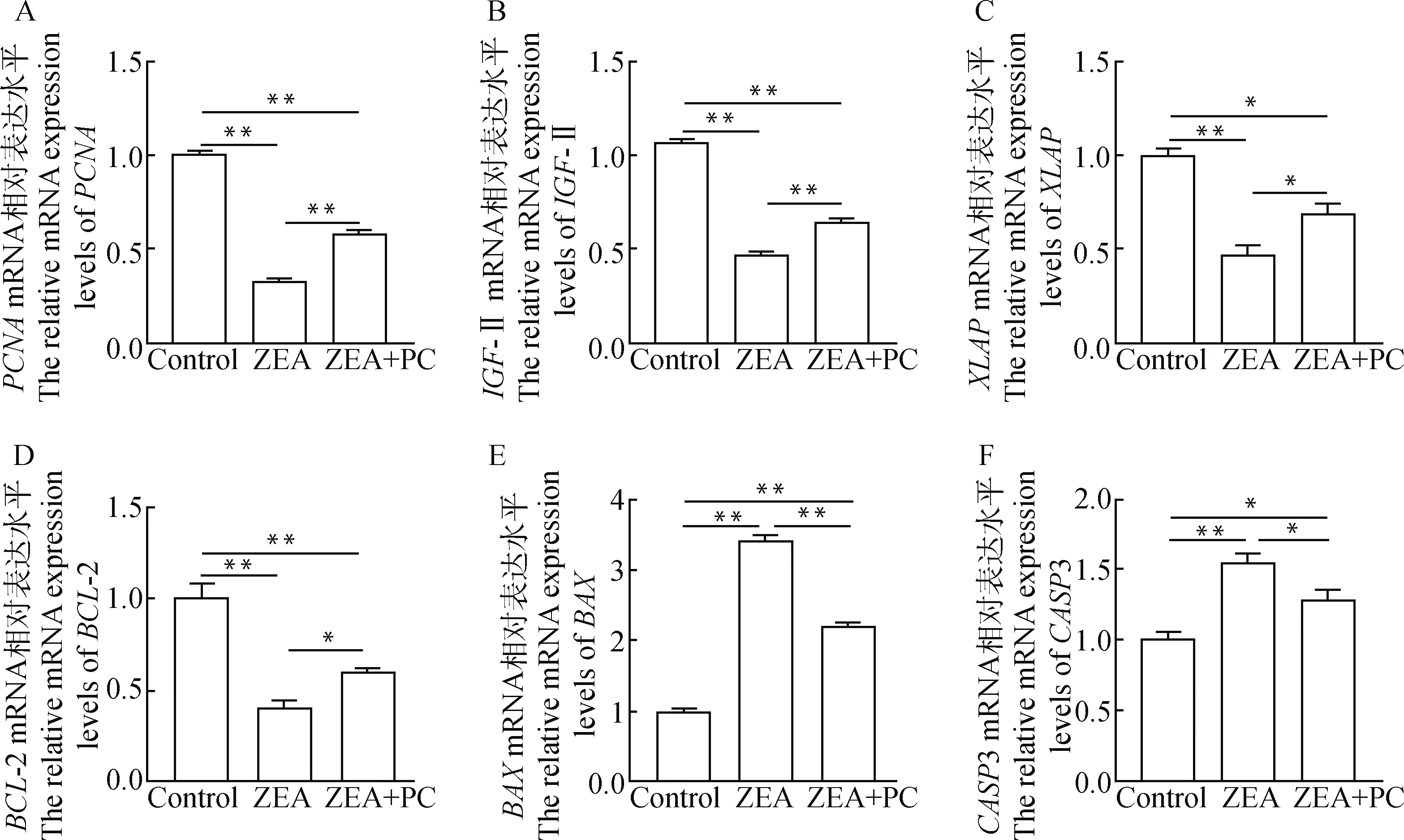
A~B.颗粒细胞中增殖生长相关基因PCNA和 IGF-Ⅱ mRNA的相对表达水平;C~D.颗粒细胞中抑凋亡相关基因XIAP和BCL-2 mRNA的相对表达水平;E~F. 颗粒细胞中促凋亡相关基因BAX 和 CASP3 mRNA 的相对表达水平A-B. The relative mRNA expression levels of proliferation and growth-related genes PCNA and IGF-II in granulosa cells; C-D. The relative mRNA expression levels of the anti-apoptotic genes XIAP and BCL-2 in granulosa cells; E-F.The relative mRNA expression levels of pro-apoptotic genes BAX and CASP3 in granulosa cells图5 ZEA + PC联合处理后牦牛颗粒细胞24 h后增殖和凋亡相关基因表达水平Fig.5 The expression levels of proliferation and apoptosis-related genes in yak granulosa cells after 24 h with the combined treatment of ZEA+PC
2.5 ZEA与PC联合处理后对颗粒细胞抗氧化能力的影响
结果显示,与对照组相比,ZEA处理组ROS水平显著升高了20.7%(<0.05)。而与ZEA处理组相比,ZEA+PC联合处理组颗粒细胞的ROS水平显著降低了11.5%(<0.05,图6A)。对颗粒细胞抗氧化相关基因表达水平进行检测后,发现单独添加ZEA培养后,与对照组相比,颗粒细胞中抗氧化基因2、1及的表达水平极显著下调(<0.01),分别下调了24.5%、63.8%和14.7%。而与ZEA组相比,ZEA + PC联合处理组颗粒细胞中这些抗氧化基因mRNA的表达水平均极显著上调(<0.01),分别上调了24.4%、68.2%和14.1%(图6B~6D)。
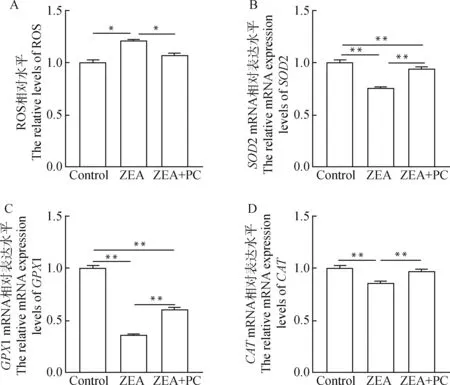
A.颗粒细胞ROS相对水平;B~D.部分颗粒细胞抗氧化基因mRNA的相对表达水平A. The relative levels of ROS in granulosa cells; B-D. The relative mRNA expression levels of some antioxidant-related genes in granulosa cells图6 ZEA与PC联合处理后对牦牛颗粒细胞抗氧化能力的影响Fig.6 The effect of combined treatment of ZEA and PC on the antioxidant capacity of yak granulosa cells
2.6 ZEA与PC联合处理后对颗粒细胞E2分泌水平的影响
测定颗粒细胞的E分泌水平后,结果显示,与对照组相比,ZEA组颗粒细胞分泌的E水平显著降低(<0.05),降低了13.4%。而与ZEA组相比,ZEA+PC联合处理组颗粒细胞E分泌水平显著上升(<0.05),上升了18.7%(图7A)。为了探究ZEA与PC对颗粒细胞E合成相关基因的影响,检测了部分颗粒细胞E合成相关基因的表达情况,结果表明,与对照组相比,ZEA组颗粒细胞中与E合成相关基因、11A1及3B mRNA的表达水平极显著下调(<0.01),分别下调了87.9%、64.1%和34.8%。而与ZEA组相比,ZEA+PC联合处理组中这些基因的表达水平有所上升,其中及11A1 mRNA的表达水平极显著上调(<0.01),分别上调了94.6%和85.8%(图7B、7C),3B mRNA的表达水平显著上调(<0.05),上调了30.6%(图7D)。
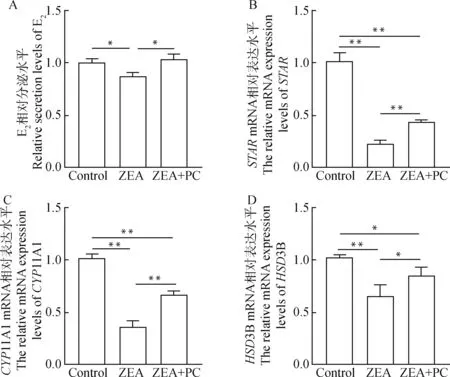
A.颗粒细胞E2相对分泌水平; B~D.部分颗粒细胞E2合成相关基因mRNA相对表达水平A.The relative secretion levels of E2 in granulosa cells; B-D. The relative mRNA expression levels of some E2 synthesis-related genes图7 ZEA与PC联合处理后对牦牛颗粒细胞分泌E2的影响Fig.7 Effect of the combined treatment of ZEA and PC on the secretion of E2 by yak granulosa cells
3 讨 论
卵巢是雌性动物生殖系统的重要组成部分,颗粒细胞是卵巢卵泡内包围在卵母细胞周围的一类非常重要的体细胞。其主要功能是分泌雌激素、促进卵泡的生长、发育及成熟,在母畜受孕生产中有着重要作用。因此,维持颗粒细胞功能的正常执行是提高动物繁殖能力的重要手段之一。
本研究发现ZEA处理颗粒细胞后细胞的活力降低,ROS水平上升且部分抗氧化酶相关基因的表达下调,而雌激素合成的能力下降,表明ZEA对牦牛颗粒细胞造成氧化损伤性并抑制了雌激素的合成。
已有多篇文献研究了ZEA的氧化损伤作用和雌激素样作用,如高鑫研究表明,ZEA及其代谢物能够对人类和动物的生殖、消化、免疫系统等方面造成氧化损伤,从而影响机体的正常生长,甚至诱发癌症;而向妊娠期雌性大鼠灌胃ZEA,导致体内雌二醇水平下降,干扰雌激素信号通路,导致生殖系统紊乱。本试验检测了不同浓度的PC对牦牛颗粒细胞活力的影响,结果表明,PC浓度为5 μg·mL时提高细胞活力的作用最明显,但浓度高于50 μg·mL后,PC会显著降低颗粒细胞的活性。在其他研究中也有类似的结果,例如有研究发现在人体白细胞内,同样作为抗氧化剂的槲皮素当其浓度低于50 mmol·L时,显示抗氧化活性,但浓度超过100 mmol·L时,DNA氧化损伤显著增加,损害细胞活力。有研究指出,当对小鼠主动脉内皮细胞进行过表达线粒体过氧化氢酶后,发现可降低体内HO含量,并阻断细胞由G0期向G1期的转变,证明低剂量的ROS在调控细胞分裂中具有积极作用。由此推测,在本次试验中当PC浓度高于50 μg·mL时,ROS水平低于机体正常运转所需最低ROS水平,细胞正常功能受到影响,反而产生降低细胞活力的效果。由此可知,PC作为抗氧化剂作用于颗粒细胞应控制在一定的浓度范围内。此外,本研究发现,ZEA与PC联合处理组颗粒细胞与ZEA氧化损伤组相比,细胞的活力极显著上升,说明ZEA对PC诱导牦牛颗粒细胞活力下降具有明显的缓解作用。
机体为了应对氧化应激,除了保证体内抗氧化酶和抗氧化性物质的正常合成以外,外源性补充生物活性物质或抗氧化剂也是减缓氧化应激的重要途径。PC是一类生物类黄酮,属于天然植物提取类的抗氧化剂。而本研究也证实,适宜浓度的PC能够促进牦牛颗粒细胞的生长,下调颗粒细胞ROS水平。在ZEA与PC联合处理牦牛颗粒细胞后,颗粒细胞活性氧水平与ZEA单独处理组相比显著下降,颗粒细胞活力得到显著提高,相关基因的表达水平得到恢复,因此,本研究推测,PC可能是通过降低ZEA诱导颗粒细胞后的活性氧水平,降低颗粒细胞凋亡程度,进而提升了细胞的活力。这与其他文献中所报道的结果一致,如有研究中发现,葡萄籽原花青素B2(GSPB2)能够提升被HO氧化损伤的猪颗粒细胞活力,这一作用是通过提高-2/比值,降低3 mRNA的表达量实现的。原花青素B1(PB1)处理MII 卵母细胞和卵丘细胞后,降低了细胞ROS 的产生和凋亡水平,并且增加了GSH水平。
颗粒细胞所分泌的E在卵泡发育及卵母细胞发育的过程中发挥重要作用,对雌性动物生殖能力的维持具有重要意义。而在E合成过程中主要受到、11A1及3B三种关键蛋白的调节作用。体外研究发现,ZEA及其代谢物在体外抑制牛小卵泡颗粒细胞的细胞增殖和类固醇生成。在Barbe等的研究中发现GSPB2能够通过提高人颗粒细胞STAR蛋白的表达水平进而促进细胞分泌孕酮和雌激素。在本研究中,添加ZEA后牦牛颗粒细胞E分泌水平显著降低,而添加PC后,E水平以及相关基因的表达都得到了一定的恢复,推测PC可能通过促进、11A1及3B mRNA的表达进而提高颗粒细胞分泌E的能力。
4 结 论
牦牛颗粒细胞培养基中添加ZEA会导致细胞氧化损伤,细胞活力下降,ROS水平上升,E分泌水平下降。PC能够减缓ZEA引起的一系列细胞功能如生长增殖、氧化应激及雌激素分泌水平等,恢复细胞功能。本试验表明适宜浓度PC能够改善牦牛颗粒细胞的生存环境,提升颗粒细胞应对氧化应激的抗性以及雌激素的分泌能力,减少ROS带来的氧化损伤。

