纳布啡联合酮咯酸氨丁三醇预处理对电视胸腔镜外科手术后急性痛觉过敏的影响*
李明明,白明松,刘静,王华娟,宋满,郑孝振
(河南大学第一附属医院 麻醉科,河南 开封 475000)
电视胸腔镜外科手术(video-assisted thoracic surgery,VATS)属于微创手术,可以改善胸外科手术的局限性[1]。在VATS 中,瑞芬太尼是常用的镇痛剂之一。有研究[2-3]指出,此药会在镇痛时出现痛觉过敏反应,即阿片类所致痛觉过敏(opioid-induced Hyperalgesia,OIH),从而影响镇痛效果,产生异常疼痛,对患者预后造成影响。纳布啡可以与阿片受体进行结合且不激动受体,产生镇痛的同时抑制阿片受体,从而减轻阿片受体对中枢神经的敏化[4]。酮咯酸氨丁三醇是通过抑制环氧合酶(cyclooxygenase,COX)的活性,来抑制组织损伤和炎症反应时COX介导的花生四烯酸转化及前列腺素合成,从而减少伤害性刺激引发的疼痛感受敏化改变[5]。本研究通过对全身麻醉下行VATS肺叶切除术的患者应用酮咯酸氨丁三醇联合纳布啡预处理,以探讨其对术后急性期痛觉过敏的影响。现报道如下:
1 资料与方法
1.1 一般资料
选择2020年9月-2021年9月本院择期全身麻醉下行VATS肺叶切除术的患者72例,采用随机数表法将患者分为对照组(C组)、纳布啡组(N组)和纳布啡联合酮咯酸氨丁三醇组(L 组),每组各24 例。研究期间,有2 例因改变手术方式自愿退出而被剔除,最终纳入数据完整的病例共计70 例。其中,C 组24例,N 组22 例,L 组24 例,3 组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
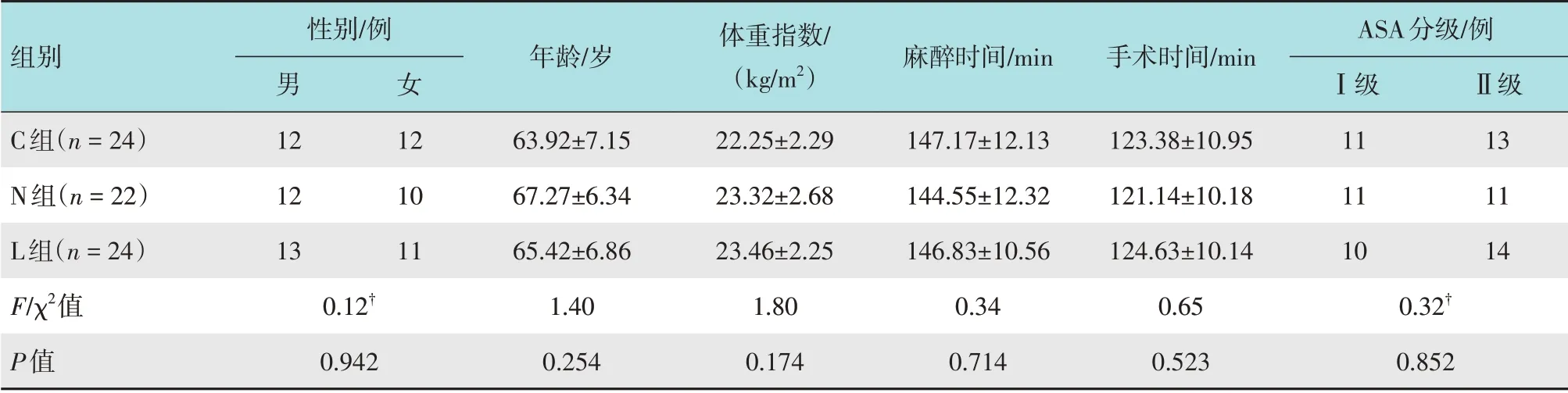
表1 3组患者一般资料比较Table 1 Comparison of general data among the three groups
纳入标准:签署知情同意书;确诊为Ⅰ期或Ⅱ期非小细胞肺癌[6];年龄≥18岁;体重指数18~30 kg/m2。排除标准:有阿片类药物滥用史;有慢性疼痛史;长期嗜酒;近期接受镇痛/抗抑郁/抗惊厥药治疗;对本研究中所用药物有禁忌证;患有精神系统疾病;妊娠期及哺乳期女性。剔除标准:胸腔镜中转开胸或未能顺利完成手术;术后无法配合评估及测试;研究过程中自愿退出或同时参与其他研究。本研究经河南大学第一附属医院伦理委员会审批通过。
1.2 麻醉方法
1.2.1 建立静脉通路入室后建立外周静脉通路,监测生命体征。L组静脉注射酮咯酸氨丁三醇(生产公司:山东新时代药业有限公司,批准文号:国药准字H20052631)30 mg,盐酸纳布啡注射液(生产公司:宜昌人福药业有限责任公司,批准文号:国药准字H20130127)0.20 mg/kg 静脉注射;N 组静脉注射盐酸纳布啡注射液0.20 mg/kg;C 组静脉注射等量生理盐水。
1.2.2 麻醉诱导静脉注射盐酸瑞芬太尼(生产公司:宜昌人福药业有限责任公司,批准文号:国药准字H20030198)1.0 μg/kg、依托咪酯注射液(生产公司:江苏恒瑞医药股份有限公司,批准文号:国药准字H32022379)0.20~0.40 mg/kg、罗库溴铵注射液(生产公司:广东星昊药业有限公司,批准文号:国药准字H20213778)0.60 mg/kg。
1.2.3 机械通气经口双腔气管插管后行机械通气,麻醉呼吸机参数设置:双肺通气潮气量6~8 mL/kg,呼吸频率10~12 次/min;单肺通气潮气量4~6 mL/kg,呼吸频率12~16 次/min;吸呼比1.0∶1.5,维持经皮动脉血氧饱和度不低于95%,呼气末二氧化碳分压维持在35~45 mmHg。
1.2.4 术中处理术中泵注盐酸瑞芬太尼0.2 μg/(kg·min),术中控制脑电双频指数(bispectral index,BIS)为40~60,并根据BIS调整七氟醚吸入浓度,根据手术情况酌情追加肌松剂,心率<50次/min时,静脉注射阿托品0.5 mg,血压较基础水平下降幅度超20%时,静脉注射麻黄碱5.0 mg。缝皮完毕,停用盐酸瑞芬太尼及七氟醚,静脉推注舒芬太尼0.1 μg/kg。
1.2.5 术后处理入麻醉恢复室后,常规静脉注射阿托品0.02 mg/kg 及新斯的明0.04 mg/kg 拮抗肌松残余,拔除气管导管。在麻醉恢复室内观察,当患者出现烦躁不安或自诉疼痛时,静脉注射舒芬太尼5 μg,同时启用镇痛泵行患者自控镇痛(patient control analgesia,PCA)。镇痛泵:100 mL 中含2.5 μg/kg 舒芬太尼、10 mg 托烷司琼,剩余为生理盐水,背景输注速率控制在1.5 mL/h,锁定时间为15 min,PCA 2 mL。术后,由一名护士对患者进行随访,当疼痛较强烈时[数字分级评分法(numerical rating scale,NRS) >4分],给予单次静脉推注舒芬太尼5 μg作为补救措施。
1.3 观察指标
1.3.1 机械痛阈值于术前、术后6 h、术后24 h和术后48 h 使用电子测痛仪(Von Frey)测定患者前臂内侧及切口周围机械痛阈值。测定部位为前臂内侧中点皮肤上下各3 cm 处和胸腔镜切口外缘上下各3 cm处。测定方法:测试的尖端头垂直施压于皮肤,并逐渐增加压力,直至患者感到疼痛时,移开仪器并记录此刻的数值,每个测定点测定3 次,每次间隔15 s,分别计算其平均数,即为前臂内侧或切口周围机械痛阈值。
1.3.2 疼痛情况采用NRS 评价患者术后48 h 疼痛情况。从0~10 分中选择1 个数字,分值越高,代表疼痛程度越严重,0分=无痛,10分=可以想象的最强程度的疼痛。
1.3.3 其他指标比较3组患者术后48 h内舒芬太尼累积消耗量及术后不良反应发生情况。
1.4 统计学方法
选用SPSS 24.0 软件分析数据。计量资料以均数±标准差(±s)表示,采用单因素方差分析(one-way ANOVA)进行比较,LSD 法进行组间两两比较;计数资料以例(%)表示,采用χ2检验,组间两两比较使用Nemenyi 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 3组患者前臂内侧机械痛阈值比较
3 组患者术后6、24 和48 h 前臂内侧机械痛阈值比较,差异有统计学意义(P<0.05)。N 组和L 组术后6、24 和48 h 的前臂内侧机械痛阈值均明显高于C组(P<0.05)。见表2。
表2 3组患者前臂内侧机械痛阈值比较 (g,±s)Table 2 Comparison of mechanical pain threshold of medial forearm among the three groups (g,±s)
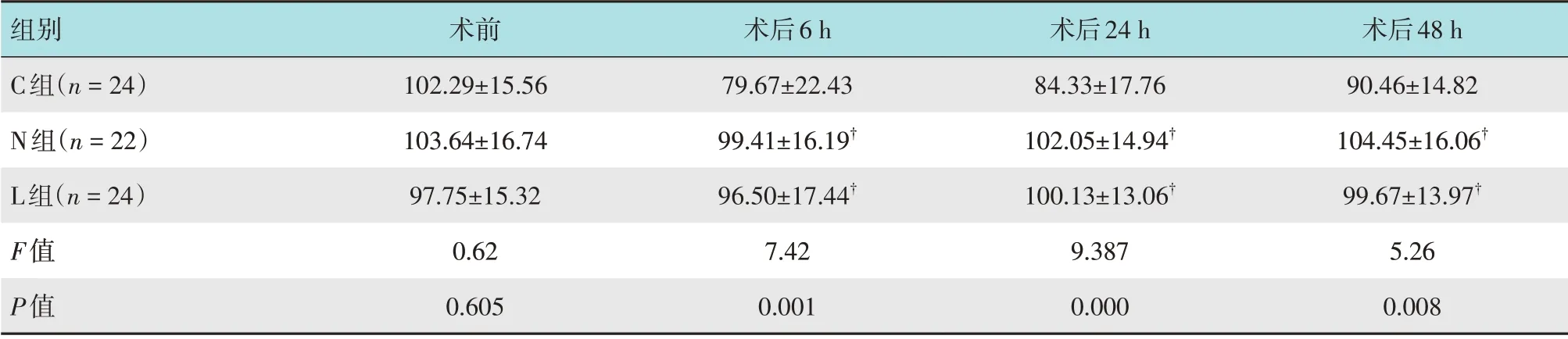
表2 3组患者前臂内侧机械痛阈值比较 (g,±s)Table 2 Comparison of mechanical pain threshold of medial forearm among the three groups (g,±s)
注:†与C组比较,差异有统计学意义(P<0.05)
组别C组(n=24)N组(n=22)L组(n=24)F值P值术后48 h 90.46±14.82 104.45±16.06†99.67±13.97†5.26 0.008术后6 h 79.67±22.43 99.41±16.19†96.50±17.44†7.42 0.001术前102.29±15.56 103.64±16.74 97.75±15.32 0.62 0.605术后24 h 84.33±17.76 102.05±14.94†100.13±13.06†9.387 0.000
2.2 3组患者切口周围机械痛阈值比较
3 组患者术后6、24 和48 h 切口周围机械痛阈值比较,差异有统计学意义(P<0.05)。N 组和L 组术后6、24 和48 h 切口周围机械痛阈值明显高于C 组(P<0.05)。L组术后6、24和48 h切口周围机械痛阈值明显较N组高(P<0.05)。见表3。
表3 3组患者切口周围机械痛阈值比较 (g,±s)Table 3 Comparison of mechanical pain threshold around incision among the three groups (g,±s)
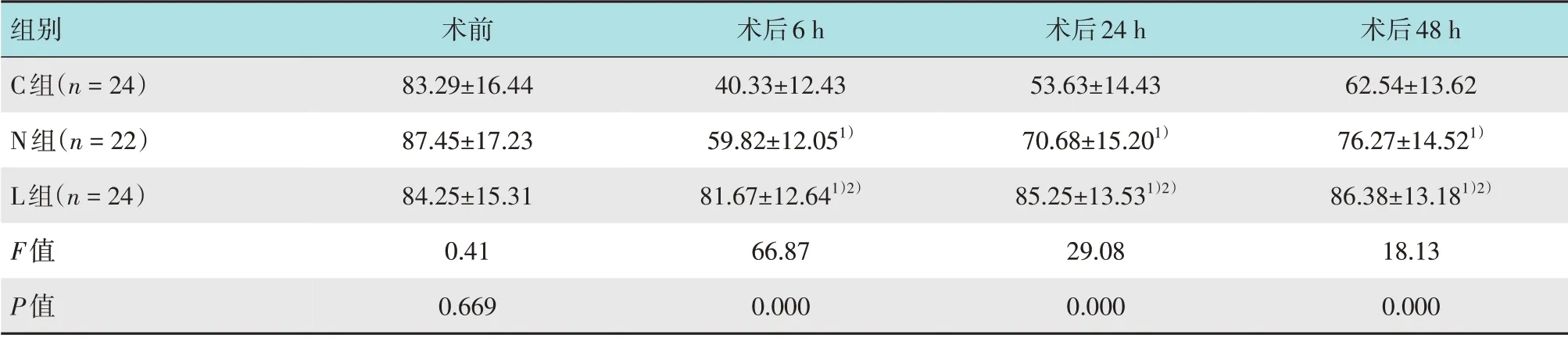
表3 3组患者切口周围机械痛阈值比较 (g,±s)Table 3 Comparison of mechanical pain threshold around incision among the three groups (g,±s)
注:1)与C组比较,差异有统计学意义(P<0.05);2)与N组比较,差异有统计学意义(P<0.05)
组别C组(n=24)N组(n=22)L组(n=24)F值P值术后48 h 62.54±13.62 76.27±14.521)86.38±13.181)2)18.13 0.000术后6 h 40.33±12.43 59.82±12.051)81.67±12.641)2)66.87 0.000术前83.29±16.44 87.45±17.23 84.25±15.31 0.41 0.669术后24 h 53.63±14.43 70.68±15.201)85.25±13.531)2)29.08 0.000
2.3 3组患者术后NRS及舒芬太尼累积消耗量比较
3 组患者术后30 min、6 h 和24 h 的NRS 及术后48 h内舒芬太尼累积消耗量比较,差异有统计学意义(P<0.05)。N 组和L 组术后30 min、6 h 和24 h 的NRS均明显低于C组,术后48 h内舒芬太尼累积消耗量明显少于C 组(P<0.05)。L 组术后30 min、6 h 和24 h的NRS明显较N组低,术后48 h内舒芬太尼累积消耗量明显较N组少(P<0.05)。见表4。
表4 3组患者术后NRS及舒芬太尼累积消耗量比较 (±s)Table 4 Comparison of postoperative NRS and sufentanil cumulative consumption among the three groups (±s)
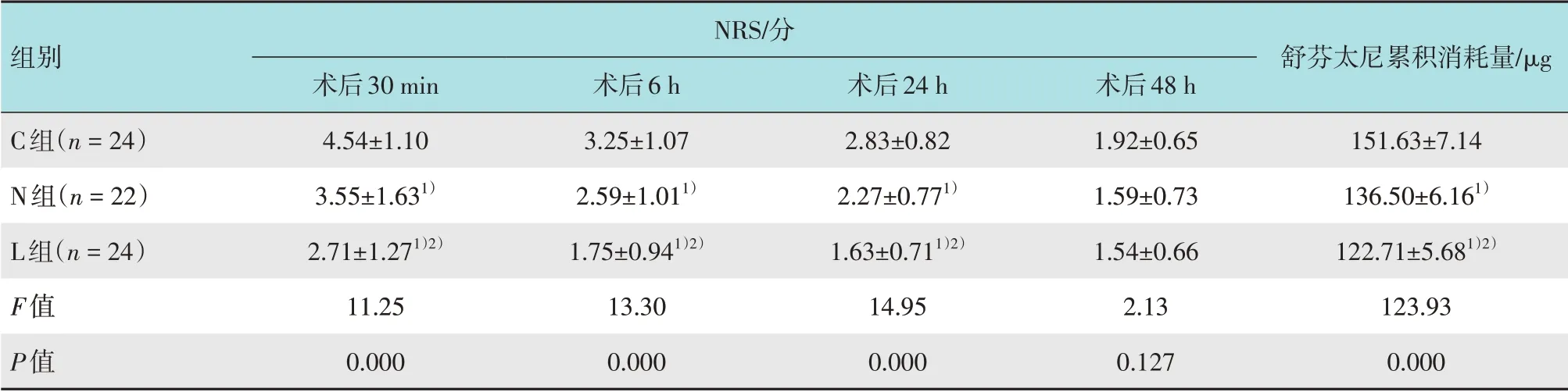
表4 3组患者术后NRS及舒芬太尼累积消耗量比较 (±s)Table 4 Comparison of postoperative NRS and sufentanil cumulative consumption among the three groups (±s)
注:1)与C组比较,差异有统计学意义(P<0.05);2)与N组比较,差异有统计学意义(P<0.05)
NRS/分组别舒芬太尼累积消耗量/μg C组(n=24)N组(n=22)L组(n=24)F值P值术后30 min 4.54±1.10 3.55±1.631)2.71±1.271)2)11.25 0.000术后6 h 3.25±1.07 2.59±1.011)1.75±0.941)2)13.30 0.000术后24 h 2.83±0.82 2.27±0.771)1.63±0.711)2)14.95 0.000术后48 h 1.92±0.65 1.59±0.73 1.54±0.66 2.13 0.127 151.63±7.14 136.50±6.161)122.71±5.681)2)123.93 0.000
2.4 3组患者术后不良反应发生率比较
3 组患者均未出现呼吸抑制和瘙痒。C 组术后恶心呕吐4 例(16.7%),N 组术后恶心呕吐3 例(13.6%),眩晕1 例(4.5%),L 组术后恶心呕吐3 例(12.5%),3 组患者术后恶性呕吐和眩晕等不良反应发生率比较,差异均无统计学意义(P>0.05)。
3 讨论
VATS 肺叶切除术后痛觉过敏多因手术损伤、阿片类药物造成外周敏化及中枢敏化导致[7]。原发性痛觉过敏仅限于创伤或手术切口区域,由外周伤害感受器致敏引起,继发性痛觉过敏则是中枢神经对疼痛的敏感,表现为弥漫性伤害性敏化[8]。随着超前镇痛理念的发展,在脊髓敏化前给药,其不但能有效镇痛,还能阻止外周及中枢敏化,改善痛觉过敏[9]。
前臂内侧属于远离手术区域的未损伤组织,该部位疼痛阈值的下降主要由中枢痛觉敏化引起。本研究显示:N 组和L 组术后6、24 和48 h 的前臂内侧机械痛阈值均明显高于C组,提示:纳布啡预处理在这种情况下发挥了较为有效地防治作用。OIH的中心机制很大程度上与μ-阿片受体和N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)的活性及相互作用有关,过量服用阿片类药物会导致谷氨酸运输蛋白下调,使谷氨酸可用于NMDAR,增加NMDAR 活性[10]。有研究[11]报道,使用小剂量吗啡受体拮抗剂,可以预防包括瑞芬太尼在内的阿片类镇痛引起的耐受性和痛觉过敏。由于纳布啡的混合药理学作用,笔者推测,它可能通过最初占据和部分拮抗μ-阿片受体并同时激动κ-阿片受体来预防OIH 及中枢敏化。
VATS 术后切口周围痛觉过敏与伤害性刺激痛觉过敏(nociception-induced hyperalgesia,NIH) 关系密切,手术创伤、胸腔引流管刺激和局部炎症反应等因素可直接激活伤害感受器,引起切口原发性痛觉过敏,并释放一系列神经递质/调质,与炎症因子作用于脊髓的次级感觉神经元,诱发脊髓前伤害性敏化,导致切口周围区域痛敏程度进一步加重[12]。本研究对患者切口周围机械痛阈值进行测定,结果发现:3组患者术后6、24和48 h切口周围机械痛阈值比较,差异有统计学意义(P<0.05),N 组和L 组术后切口周围机械痛阈值较C组高,且L组高于N组,术后早期疼痛评分及镇痛需求L组最低,且N组低于C组,提示:在预防患者术后切口周围痛觉过敏方面,纳布啡联合酮咯酸氨丁三醇优于单用纳布啡。分析其原因可能为:①酮咯酸氨丁三醇通过抑制COX 介导的花生四烯酸转化及前列腺素合成,能够有效抑制局部炎症反应,减轻周围痛觉感受的敏化;②COX-1 与COX-2 均存在于脊髓,两者在NIH 发展中有着重要作用,可引发涉及感觉和运动神经系统在内的“伤害性神经可塑性”改变[13];有研究[14]显示,COX-1活性与切口痛动物模型的术后急性疼痛和痛觉过敏有关,通过鞘内注射COX-1 抑制剂,能够提高切口痛大鼠的机械痛阈值,减轻术后疼痛;COX-2 主要存在于炎症部位,并可在炎症因子等诱导下激活,促进急性炎症期间对感觉刺激的致敏反应,从而加重组织炎性疼痛[15];酮咯酸氨丁三醇为非选择性的COX 抑制剂,其在抗伤害感受性方面具有两者兼顾的优势;③酮咯酸氨丁三醇与纳布啡的预防痛觉过敏机制不同,但联合两者预处理的方式可从多个靶点共同发挥作用,更为全面地预防VATS术后急性痛觉过敏。
本研究中,术后48 h 各组患者的NRS 比较,差异无统计学意义,似乎与该时点机械痛阈值的情况不一致,分析其原因为:①痛觉过敏更容易与咳嗽或运动引起的疼痛有关[16],而本研究所测试的NRS仅在静息情况下进行;②尽管痛觉过敏可能会加重术后疼痛,但电子测痛仪(Von Frey)纤维丝客观测量的疼痛阈值,与NRS 主观评估的疼痛强度之间的相关性较低[11]。
综上所述,酮咯酸氨丁三醇联合纳布啡预处理,可预防VATS术后发生的急性痛觉过敏,减轻术后疼痛,减少镇痛需求。

