离体猪食管模型同步临床病例在食管内镜黏膜下剥离术学习曲线中的作用探讨*
刘世育,李振涛,吴传楠,张海涵,高之峰,刘霞,王庄梅,陈光侠
[徐州市第一人民医院(徐州医科大学附属徐州市立医院) 1.消化内科;2.病理科,江苏 徐州 221100]
食管癌是我国最常见的消化道恶性肿瘤之一,发病率居恶性肿瘤第6 位,死亡率居第4 位[1]。随着高清电子内镜和窄带成像技术(narrow-band imaging,NBI)等内镜技术的发展及内镜医生早癌诊断意识的提高,早期食管癌检出率逐年增高[2-3]。内镜黏膜下剥离术 (endoscopic submucosal dissection,ESD)治疗早期食管癌可到达与外科手术相似的临床效果,且ESD 具有创伤小、费用低、并发症少及恢复快等优点,是目前治疗早期食管癌的标准及首选技术[4]。但ESD 操作难度大,开展初期出血和穿孔等并发症发生率较高,限制了其在临床中的应用,特别是对于ESD 例数相对较少的基层医院,掌握该技术难度更大。有研究[5-10]报道,动物模型可以促进ESD 学习曲线,活体、离体猪胃和结肠模型的有效性已得到证实。国外亦有文献[11-12]报道了活体及离体猪食管模型的有效性,但国内鲜有报道。为了持续、稳定地提高食管ESD 技术,笔者规律地利用离体猪食管模型进行练习,并同步临床早期食管癌患者实施ESD,练习效果较好。现报道如下:
1 资料与方法
1.1 一般资料
选取2017年1月-2019年12月本科室连续行ESD 治疗的早期食管癌患者25 例,平均年龄(60.1±14.0)岁,男17 例,女8 例,所有患者自愿选择ESD 治疗并于术前签署知情同意书。本研究经徐州市第一人民医院伦理委员会批准。患者一般资料见表1。
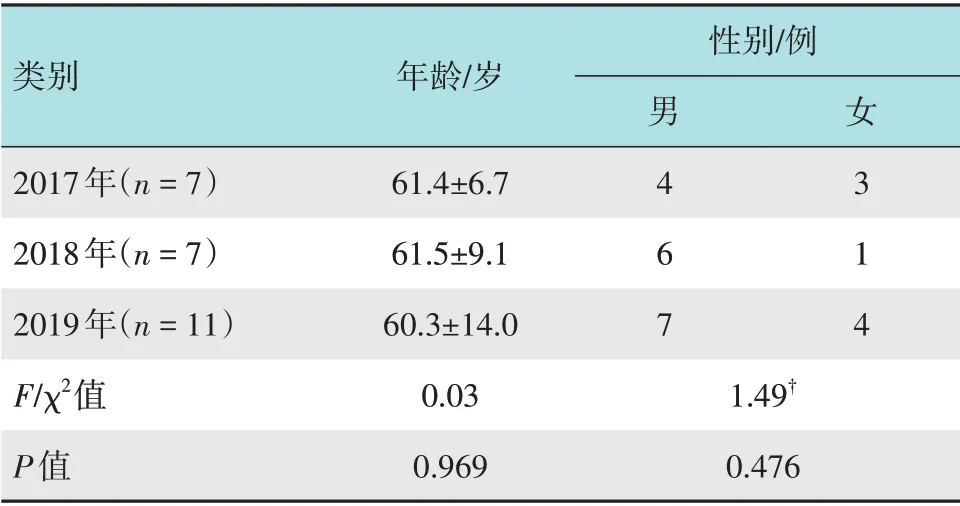
表1 25例患者一般资料比较Table 1 Comparison of general data in 25 patients
两位内镜医生参与本培训计划,一位39岁女性,一位35 岁男性,均可熟练操作胃肠镜,有国内及日本的内镜中心进修学习经历,女性及男性内镜医生分别有20及5例胃ESD操作经验。男性内镜医生在4例离体猪食管ESD操作后,开始临床早期食管癌患者操作。每例开始时,先由年轻男性内镜医生操作,当操作困难时,更换为经验相对丰富的女性内镜医生操作。
1.2 离体猪食管ESD
按需于市场采购重量1 至2 kg 带有长约20 cm 食管及长约10 cm十二指肠的离体猪胃。离体猪胃及食管预处理:在离体猪胃的胃底部切开一小孔,用自来水反复冲洗,充分洗净猪胃、食管表面、内部黏液、污物及血迹,必要时使用二甲硅油及碳酸氢钠清洗,清洗干净后将胃置于打孔盆中,食管置于开好槽的泡沫板上,入口处用牙签固定。见图1。
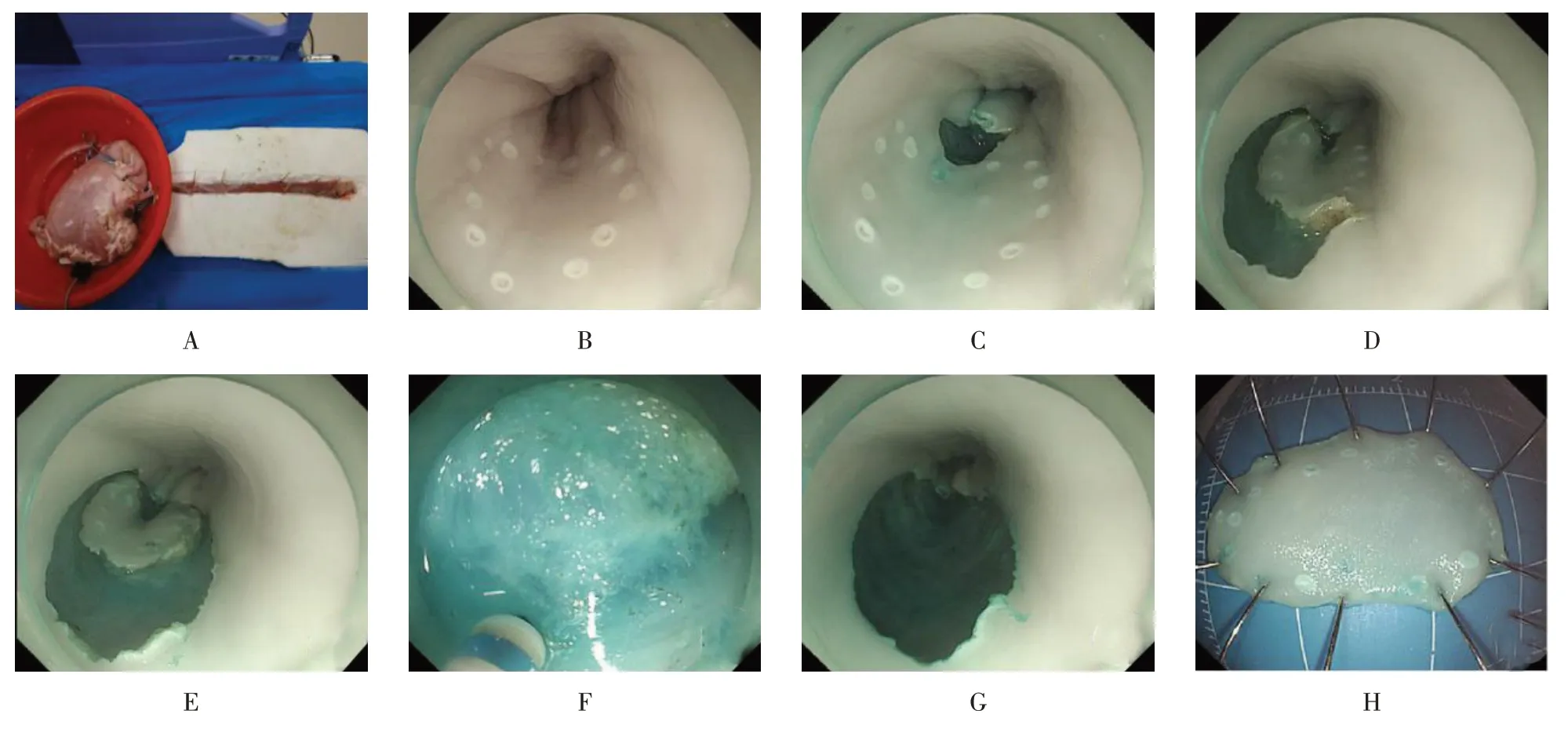
图1 离体猪食管ESD步骤Fig.1 ESD protocol of esophagus in isolated pig
1.3 器材
高清放大内镜(生产厂家:日本奥林巴斯,型号:GIF-H260Z)、治疗内镜(生产厂家:日本奥林巴斯,型号:GIF-Q260J)、Dual 刀(生产厂家:日本奥林巴斯,型号:KD-650L 及KD-650Q)、IT 刀(生产厂家:日本奥林巴斯,型号:KD-612L)、氩离子凝固器(生产厂家:德国爱尔博,型号:300S)及和谐夹(生产厂家:南京微创)等。
1.4 早期食管癌患者ESD
找到病灶后,距病灶边缘3~5 mm处进行电凝标记,用生理盐水与靛胭脂混合,于标记点外侧进行多点黏膜下注射,抬起病灶,沿标记点外侧“C”形切开病变周围黏膜后,再行黏膜下剥离,最后固定标本。见图2。
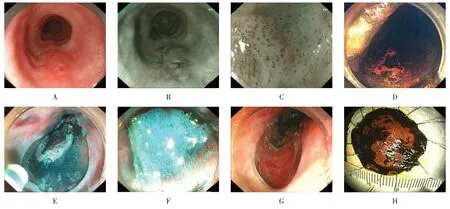
图2 临床患者ESD步骤Fig.2 ESD protocol of clinical patients
1.5 观察指标
食管ESD 部位、操作时间(标记病变至剥离结束)、切除标本面积(长/2×宽/2×3.14)、完整切除情况(包括完整大块切除、完整分块切除和不完整切除)、并发症(损伤肌层次数、出血和穿孔)和术后病理等。
1.6 相关定义
1.6.1 早期食管癌指局限于食管黏膜层的鳞状细胞癌,不论有无淋巴结转移。
1.6.2 整块切除病灶在内镜下被整块切除,并获得单块标本。
1.6.3 完全切除/R0 切除内镜下切除标本的侧切缘和基底切缘无肿瘤残留。
1.6.4 内镜下治愈切除①属于R0切除;②黏膜内癌,或黏膜下层浸润深度不超过200 μm(SM1)的黏膜下癌;③无脉管浸润;④组织学类型为高分化和中分化[2]。
1.7 统计学方法
选用SPSS 20.0 统计软件分析数据,正态分布的计量数据以均数±标准差(±s)表示,行单因素方差分析,非正态分布的计量资料用中位数(四分位数)[M(P25,P75)]表示,行非参数秩和检验;计数资料以例(%)表示,行χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 离体猪食管ESD
共完成36 例次离体猪食管ESD。其中,2017年15例次(食管下段10例次,中段5例次),2018年12例次(食管下段6例次,中段6例次),2019年9例次(食管下段4 例次,中段5 例次)。标本面积1.2~9.9 cm2,平均5.6 cm2;手术时间29~80 min,平均41.0 min;剥离熟练度3.4~67.8 min/cm2,平均10.5 min/cm2。到第8例时,剥离熟练度明显提升,达到平台期,约10.5 min/cm2,第1年(2017年)的剥离熟练度明显低于第2 和3年(2018年和2019年)(17.2、5.6和5.8 min/cm2,P<0.05),第2年与第3年比较,差异无统计学意义(P>0.05)。见图3。第1年(2017年)肌层损伤明显多于第2和3年(2018年和2019年)(中位数为2.0、0.0 和0.0 次/例,P<0.05),第2年与第3年比较,差异无统计学意义(P>0.05)。见表2。
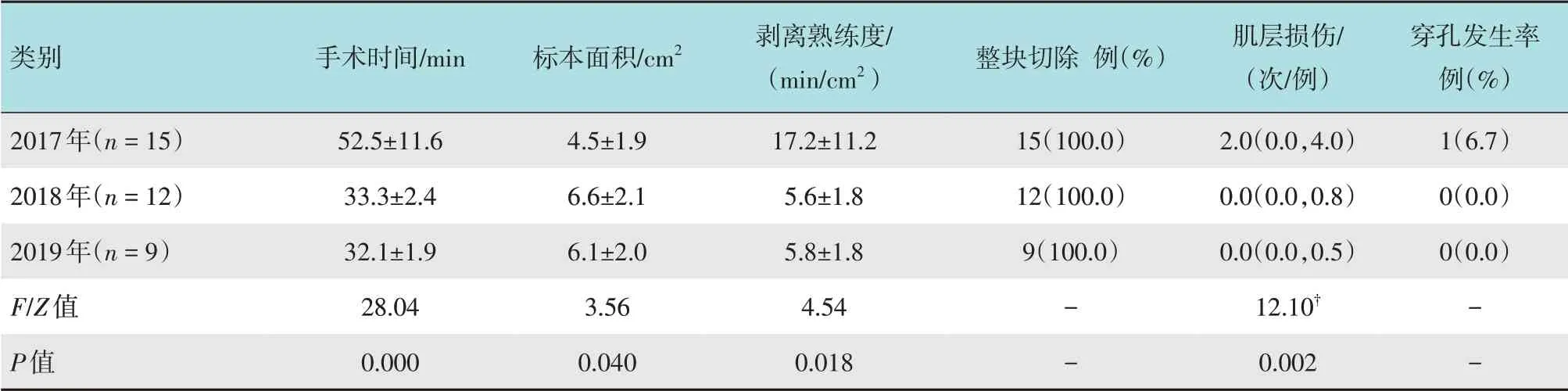
表2 离体猪食管ESD相关情况比较Table 2 Comparison of ESD related situation of isolated pig esophagus
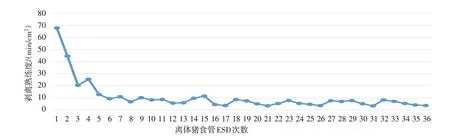
图3 离体猪食管ESD剥离熟练度趋势Fig.3 Trend of ESD dissection proficiency in isolated pig esophagus
2.2 早期食管癌患者ESD
共完成25 例患者早期食管癌ESD。2017年7 例,2018年7 例,2019年11 例,上、中和下段食管分别为5、8 和12 例。手术时间60~240 min,平均97.8 min,第1、2 和3年比较,差异无统计学意义(P>0.05)。25例患者中,有6例因操作困难而更换医生;剥离熟练度8.0~79.6 min/cm2,平均21.3 min/cm2;到第8例时,剥离熟练度明显提升,达到平台期,约21.3 min/cm2,第1年(2017年)的剥离熟练度明显低于第2 和3年(2018年和2019年)(39.3、16.6 和12.7 min/cm2,P<0.05),但第2年与第3年比较,差异无统计学意义(P>0.05)。见图4。第1年(2017年)的肌层损伤明显多于第2和3年(2018年和2019年)(中位数为1.0、0.0和0.0次/例,P<0.05),但第2年与第3年比较,差异无统计学意义(P>0.05)。整块切除率为100.0%,R0切除率为96.0%,治愈性切除率为92.0%(2018年1 例病理示低分化腺癌,黏膜下层浸润400 μm,追加放疗,2017年1 例水平切缘阳性,随访半年复查胃镜无残留),仅2017年有1 例较大ESD 发生了穿孔,转手术治疗,总的穿孔率为4.0%,无迟发性出血发生。见表3。
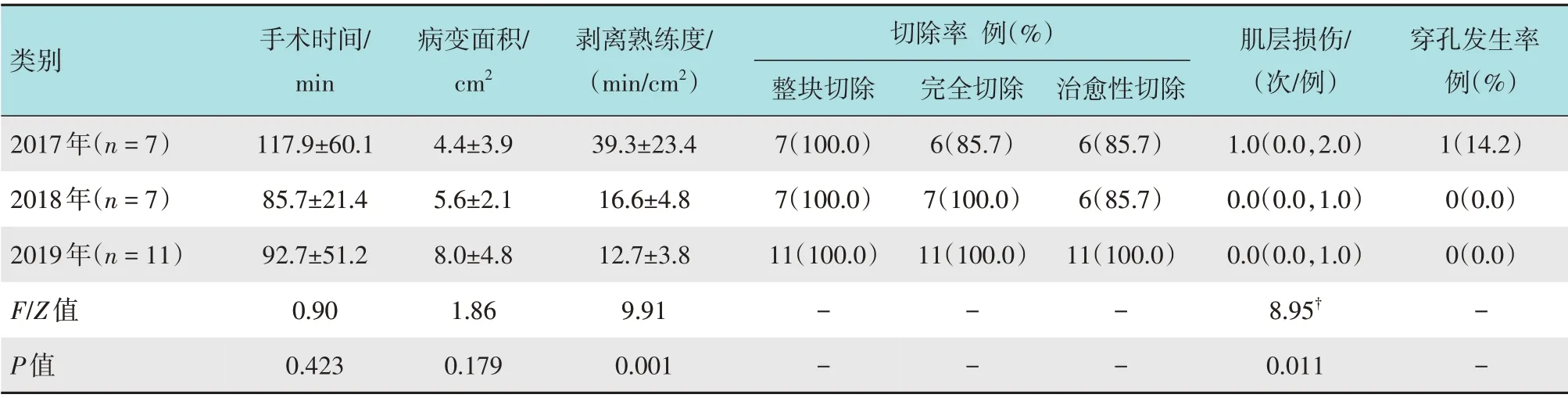
表3 早期食管癌患者ESD相关情况比较Table 3 Comparison of ESD related situation in early esophageal cancer patients
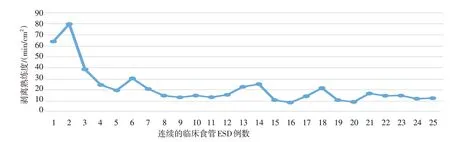
图4 食管ESD连续实例剥离熟练度趋势Fig.4 Trend of dissection proficiency of esophageal ESD continuous cases
3 讨论
由于食管壁薄和管腔窄而直的解剖学特点,对食管ESD技术要求较高。相对于胃ESD,食管ESD的操作复杂而精细,若发生纵隔炎及张力性气胸等并发症,可危及患者生命。因此,食管ESD操作难度大及并发症风险高,也是内镜医生学习及应用食管ESD的主要障碍。本研究显示,食管ESD的安全性(整块切除率和治愈性切除率)和有效性(剥离熟练度),随着例数的增加和时间的推移均明显提升,内镜医生若要基本独立并掌握食管ESD技术,在熟悉胃ESD的基础上,至少还需要16 例ESD 的积累(8 例离体猪食管+8 例临床患者)。对于初学者,每个月至少需2 例食管ESD,可能是防止技术生疏的一个合理载量,本研究的培训策略明显减少了临床患者操作例数,对于缺少足够食管ESD例数的基层医院,可能是一个不错的选择。
有研究[13]提示,至少完成30 例临床食管ESD 才能熟练掌握该技术,与本研究中的结果有差异,该研究中只有一名仅2 例胃ESD 相关操作经验的内镜医生,而本院的内镜医生均有一定的ESD操作经验,同时还进行了胃和结肠ESD的操作训练,并且是两位内镜医生相互密切合作;对于较大病变,长时间操作时可更换操作者,能获得更好的效果,让操作中的内镜医生有了一定的心理优势。因此,本研究缩短了学习周期,获得了较好的临床效果。
有研究[5-6,9]显示,在活体猪上行食管ESD 培训,可发挥非常有价值的作用,但由于活体猪的费用昂贵,需要特殊的设备,很少医院能够配备所需的设备及承担相关费用,使其应用于临床受到了极大的限制。因此,本研究提供了所有单位能够负担的离体猪食管ESD 培训模型,该模型所需要的材料简便易得,仅需约50 元人民币。然而,离体猪食管模型与临床实际病例主要有两个不同:一是离体模型没有血供,实际操作中的止血步骤在模型中缺失;二是没有实例中因蠕动、呼吸和心跳影响所致的食管活动。由于食管ESD操作精细,这两个区别对于初学者来说并不十分重要。
整块切除率和完全切除率是评估食管ESD治疗效果的主要因素。日本一项多中心回顾性研究[4]显示,ESD 治疗早期食管鳞癌的整块切除率可达96.7%,完全切除率达84.5%;国内的研究[14-15]报道,食管ESD整块切除率为90.2%~100.0%,完全切除率为78.0%~98.3%。本研究显示,临床病例整块切除率为100.0%,完全切除率96.0%,治愈性切除率为92.0%,达到了国内外先进水平。并发症率是ESD操作质量的预测因子之一。一项Meta 分析[16]显示,早期食管癌患者ESD 治疗的穿孔和出血发生率分别是5.0%和2.1%。本研究没有迟发性出血,仅有1例穿孔,发生在开展初期的较大病例中。离体猪食管及临床患者ESD 肌层损伤也逐渐减少,2017年、2018年和2019年的中位数分别为2.0、0.0 和0.0 次/例及1.0、0.0 和0.0次/例,说明:食管ESD操作初期比较难,但获得相应的经验和技能之后,学习曲线将缩短,而操作熟练度逐渐提升也证明了这一点。
笔者使用离体猪食管模型的食管ESD 培训策略,与日本及国内大的内镜中心结果相似,具有较高的安全性和有效性。初始的离体猪食管模型培训,加速了食管ESD学习曲线,随后持续的离体猪食管ESD练习及临床病例ESD 操作,是技术持续提高及维持的关键。能否进行规律的ESD操作,是大的内镜中心和基层医院的区别所在。因此,规律的离体猪食管ESD练习,可以帮助这项高难度技术维持熟练度。本研究显示,每个月至少2 例ESD 可能是一个合理的最小载量。除此之外,两个内镜医生合作可以获得更好的临床结果,尤其对于需要较长操作时间的病例。
综上所述,本培训策略可能对刚开展食管ESD的基层医院有一定的借鉴作用,但临床效果需要更大的多中心研究来验证。

