基于Python的混合溶液体系pH值计算的程序设计
崔皓 刘玺正 娄宏磊
(上海交通大学附属中学 上海 200439)
一、pH值在生产生活中的重要性
pH值是氢离子浓度的负对数,是一个描述体系中酸碱性的强弱程度的量。氢离子浓度对于化学反应速率、反应进行程度、反应生成物等都有较大的影响:酯类的水解在酸性条件下比在中性条件下更快;Pbo2在酸性条件下是最强的氧化剂之一,可以轻易把HCL氧化为CL2,而在碱性条件下CL2可以氧化Pb(Ⅱ)即为Pbo2;DNA扩增时,氢离子浓度过大甚至还会导致碱基错配[1]。
综上可知,氢离子浓度在很大程度上影响了化学反应,在进行反应之前就通过计算了解估计体系的pH可以为后续工作提供很大便利。
二、使用离子电荷守恒——分布分数计算pH值方法及优点
在计算溶液体系pH值时,列多个酸等式连立求解是常见的传统方法,但是这种方法计算量大,过程复杂,给相关学习者与工作者带来了不少麻烦。
比如,在使用传统方法计算0.1mol/l二元酸盐NaHY体系pH值时,有:

由电荷守恒和化学平衡列方程组:
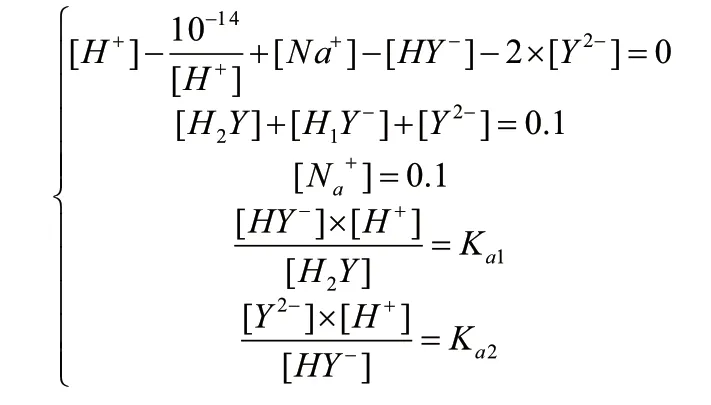
可见,该方法十分复杂,且当体系物质增多时,计算复杂度将进一步提升。
为了简化计算复杂度,本文使用计算机程序并采用列离子电荷守恒方程的方法,对于未知浓度的弱酸弱碱离子使用分布分数表达并将其带入方程,进行求解后得到氢离子浓度,进而通过计算机快速地计算并得到可靠精确的溶液pH值。
在本方法中,不使用最基础的“列多个酸碱平衡连立求解”的原因是计算机计算能力是足够强大的,完全可以满足一元分式方程的求解需要,但相较而言,多元方程的输入以及求解对于计算机则较难实现[2]。
使用的离子电荷守恒方程的形式如下:

其中:1×[H3Y-]-2×[H2Y2-]-3[HY3-]-4×[Y4-]-……项是可以使用分布分数表示的。
分布分数(distribution fraction)是平衡体系中,同一物质各种存在型体的平衡浓度与其总浓度之比。在同一酸性条件下,同一物质的单一形体所占据总分析浓度的比值是确定的,以下给出证明(一元酸):
对于酸HA,它仅有一级解离,以[HA]和[A-]两种形体存在,把HA的分析浓度设为c,δ0和δ1分别是A-和HA的分布分数,有:

这个算法也可以推广到多元酸,本程序中就采用了四元酸的分布分数公式。
三、确定混合溶液体系pH值所需要信息
首先看一个例子分析:
例:若将0.2mol HCL,0.1mol NH4CL,0.15mol Na2HPO4加入1L水中,计算体系的氢离子浓度。
解:设[H+]=x
由离子电荷守恒列出方程:

此方程中:
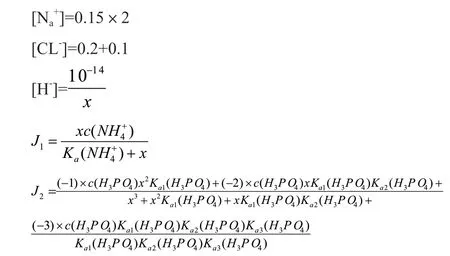
求解得:
X=3.42296×10-3,即[H+]=3.42296×10-3
体系pH=-lg(x)=2.466
通过上述计算,我们发现在计算体系pH值的时候,只需要知道体系中的固定不变的阳离子和阴离子电荷数(例子中是[Na+]和[CL-],通式中就是不可水解的阴/阳离子电荷),加入的弱酸弱碱的分析浓度、弱酸弱碱(弱碱的共轭酸)的各级解离常数以及弱酸弱碱各种形体带有的电荷量等即可通过解方程解出氢离子浓度。
综上,对程序设计过程所需要的确定体系状态的数据有了明确的思路。
四、计算机程序的设计与实现
本文中使用的Python版本为3.8.1,编译器为Python IDLE。
根据上述分析,实现混合溶液体系pH值的计算,主要需要解决以下几个问题:
第一,适用范围:不适用于会生成气体、沉淀的体系;
第二,有关各个弱酸弱碱信息的储存;
第三,有关各个弱酸弱碱信息的提取;
第四,离子电荷守恒方程的求解;
第五,体系pH值的输出。
1.计算所需各项常数准备
由上述分析不难发现,想要计算一个溶液体系pH值,我们需要知道以下常量:
(1)弱酸弱碱(弱碱的共轭酸)的各级解离常数。
(2)弱酸弱碱最酸形式所带电荷数(例如N+4H为“1”,H3PO4为“0”,为“-1”)。
考虑到输入、修改和提取数据的便利程度,使用Excel表格形式储存上述常量,其中,方便起见,弱酸弱碱的各级解离常数以其负对数的形式储存,若某物质没有某一级的解离常数,则设定为一个足够大的数99。具体形式如表1所示。

表1 参数表部分数据
2.实现所需各项常数的查找与提取
通过Python库中的xlrd模块可以方便地实现对于excel表格中数据的提取。
在程序中,首先需要输入计算所涉及的弱酸弱碱的种类数与其名称,接下来在程序中通过已经建立的循环结构,对Excel表格进行遍历,查找弱酸弱碱所对应的信息,再通过列表嵌套的方法使信息与各个所需弱酸弱碱一一对应并储存下来,最后需要输入不可水解的阴阳离子的电荷数,方便之后的计算。
3.离子电荷守恒方程的求解
(1)程序需要解的方程
经过化简,可得到与原离子电荷守恒方程等价的方程:

(2)程序解方程方法的选取
上述方程是一个较为复杂的分式方程,结合方程的实际意义考虑,可使用二分法进行求解。
由于在确定了溶液状态之后,溶液的pH值唯一确定,也即在一般情况下,该方程在区间[10-15,100]上有且仅有唯一实数解,结合与该方程对应的分式函数y=f(x)在定义域上连续的特点,使用二分法是高效可靠的方法。
所谓二分法,就是对于区间[p,q]上连续不断且满足f(p)·f(q)<0的函数y=f(x),通过不断地把函数y=f(x)的零点所在的区间一分为二,使区间的两个端点逐步逼近零点,进而得到零点近似值的方法。
(3)使用二分法解方程在Python环境中的实现与体系pH值的输出
划定一个合理x值的范围[p,q]。(初始默认值设定为[10-15,100]),井且计算。设函数f(x)=方程左式,并计算。因为函数y=f(x)在区间[p,q]上是随着x的增大而单调递增的,所以如果的计算结果小于0,则将设置为新的p值,并重新开始循环;如果的计算结果大于0,则将设置为新的q值,并重新开始循环,凭借该操作可使区间[p,q]的两个端点不断逼近函数y=f(x)的零点,进而得到零点的近似值。结束循环的标志在程序中表现为的绝对值小于10-15(该值可根据不同的精度要求调节具体大小),并输出此时x的值的负对数,也即溶液pH值的近似值。
五、计算混合溶液体系pH值示例
使用Python launcher或其他Python编译器运行程序(以Python launcher举例)。
根据提示输入物质的种类数、名称与相应的分析浓度、不可水解的阴阳离子的分析浓度,即可求解。
例如:某混合溶液含有0.10mol/l HCL、2.0×10-4mol/l NaHSO4和2.0×10-6mol/l HAc,计算此混合溶液的pH。(参考答案:1.00)
程序实现过程:本题当中有两种会水解的物质:硫酸氢根与醋酸根,浓度分别为0.0002mol/l与0.000002mol/l,不可水解的阳离子电荷数为0.0002mol/l(Na+),不可水解的阴离子电荷为0.01mol/l(CL-)。
根据程序提醒,输入相应信息,具体流程如下所示:

六、程序验证
表2列出同一体系溶液情况下,应用本程序计算的pH值和参考书中pH值实际值得对比,进一步验证该程序计算的正确性。

表2 计算值与实际值的对比
七、结论与思考
该程序完成了多种不会互相反应生成沉淀,气体的物质所构成水溶液体系的pH值计算,给予了其可靠的计算结果,显著节省了相关工作者与学习者的计算时间。在将来的改进中,将着重解决与沉淀气体有关体系的pH值计算的可行性,扩大程序的适用范围。
——以大安古河道试验区“古河妈妈”粳米为例

