西番莲细胞悬浮系建立与培养条件优化
邝瑞彬,杨 敏,周陈平,杨 护,黄炳雄,魏岳荣
(广东省农业科学院果树研究所/农业农村部南亚热带果树生物学与遗传资源利用重点实验室/广东省热带亚热带果树研究重点实验室,广州 510640)
0 引言
西番莲果实果汁酸甜,芳香可口,有很高的食用价值和药用价值,具有广阔的市场前景。西番莲在中国南部广泛种植,如广东、广西、福建、贵州、云南等西番莲主产区2019年种植面积约达3.33万hm2,产量近100万t[1-2]。近年来中国西番莲品种较单一,果实品质有待提升,且茎基腐病、木质化病毒病等病害多发,产量和果实品质受到影响,经济效益严重受损,限制了产业的发展[3-4]。传统的育种技术通常周期较长,且其遗传基础狭窄,难度大,需要花费大量的财力物力;运用现代分子育种技术实现西番莲性状的定向改良,培育和创制优质抗逆的西番莲新种质是产业发展的方向。
西番莲有关组培再生与遗传体系报道始于20世纪90年代末,前人报道的西番莲遗传转化研究,多数基于叶片为外植体的农杆菌转化体系,其转化率较低,再生体系频率低或周期长,不利于后续创制基因改良品种[5-7]。胚性细胞悬浮系生长速率快,稳定,分散性好,细胞形状及细胞团大小大致相同,在植物遗传育种改良、原生质体培养与杂交、次生代谢物培养等研究领域广泛利用,如苜蓿、香蕉、水稻、白鹤芋、柳枝稷等[8-11]。目前,中国西番莲的研究主要集中在其栽培技术及栽培生理、营养与加工品质、病虫害及其农业防治技术等方面,但是关于西番莲细胞工程,尤其是胚性细胞悬浮系的建立技术及等方面的研究尚未见报道[12-14]。本试验研究并优化西番莲愈伤组织及悬浮细胞培养条件,形成高效、稳定的西番莲悬浮细胞系,为其建立遗传转化平台和分子改良育种奠定重要基础,对百香果产业持续发展有重要的意义。
本研究以西番莲无菌苗为研究材料,研究西番莲愈伤组织的诱导及建立细胞悬浮系,并开展细胞悬浮系培养条件优化的研究,为进一步利用细胞工程和基因工程等生物育种研究提供良好的材料来源和技术方法。
1 材料和方法
1.1 西番莲无菌苗制备
试验材料为食用西番莲品种(‘台农1号’百香果),采摘当年生植株开花后约60天健康无损的百香果果实,用75%酒精进行表面消毒,在超净工作台用无菌切割刀将果实对半切开,用镊子将果籽夹出,剔出黑色种子,将种子置于萌发培养基MG中,MG培养基:MS,30 g/L蔗糖、7.5~7.8 g/L琼脂,pH 5.8。培养条件为26~28℃,暗培养至发芽后,进行光/暗培养(2000 Lux,12/8h),14天后备用。
1.2 愈伤组织的诱导和培养试验
在超净工作台上将上述西番莲幼苗取出,置于干净器皿上,分别切取幼苗的嫩叶、胚轴、嫩茎和幼根为外植体,约0.5 cm/段,分别置于装有愈伤诱导培养基(MC1)的培养皿中,28℃暗培养。每皿放置10段外植体,每个处理设置3个重复。MC1:2.0mg/L2,4-D,0.2g/L Glutamine,20 g/L蔗糖、15 g/L琼脂,MS培养基,pH 5.8。观察记录不同外植体的愈伤生长情况与状态等。
选取西番莲胚轴为外植体材料,诱导培养基中设置植物生长调节剂2,4-二氯苯氧乙酸(2,4-D),6-苄基腺嘌呤(6-BA)和萘乙酸(NAA)的不同浓度处理进行愈伤诱导(表2)。每个处理每皿接种10段外植体,每个处理设置3次重复,观察不同处理的愈伤组织的发生时间、颜色、状态和长势等,计算出愈率[15]。
待愈伤组织变大至1 cm左右,去除褐化部分组织,将切约0.5 cm大小的半透明较疏松愈伤组织,置于继代培养基(MC2)的三角瓶中继续培养,每隔3周继代一次,连续继代4~5代后,即可获得米色或淡黄色、疏松、生长良好的西番莲愈伤组织。MC2培养基:1.0 mg/L 2,4-D,0.2 g/L Glutamine,30 g/L蔗糖、15 g/L琼脂,MS,pH 5.8。
1.3 悬浮细胞培养及条件优化试验
1.3.1 西番莲悬浮细胞的培养 在超净工作台上,选取米色或淡黄色、颗粒疏松、生长旺盛的西番莲愈伤组织,置于悬浮系液体培养基(ML1)的三角瓶中,置于往恒温振荡器上28℃、80 r/min暗培养。ML1培养基:1.0 mg/L 2,4-D,0.2 g/L Glutamine,30 g/L蔗糖、MS,pH 5.8。1周后,用灭菌的20目不锈钢筛网过滤悬浮细胞,保留能通过20目筛网的悬浮细胞继续液体培养;培养2周后,同上述操作进行继代培养。之后,每隔2~3周进行继代培养,连续继代3~4代后利用倒置光学显微镜下细胞形态观察,获得比较稳定均质的西番莲悬浮细胞系,可作为后续培养条件优化试验的细胞材料。
1.3.2 西番莲细胞悬浮系培养条件优化 培养条件的单因素试验中以上述步骤建成的细胞悬浮系为研究材料,基础培养基为ML培养基:0.2 g/L Glutamine,0.05 mg/L kinetin,MS。设置不同 2,4-D水平(D0、D1、D2、D3、D4为0、1、2、3、4 mg/L)、蔗糖用量(S1、S2、S3、S4、S5、S6为20、30、40、50、60、70 g/L)、起始细胞用量(W1、W2、W3、W4、W5为2.0、4.0、6.0、8.0、10.0 mg/mL)、pH(5.2、5.5、5.8、6.1、6.4)。28℃、100 r/min暗培养2周,测定细胞鲜重,TTC法测定悬浮系细胞活性[16-17],计算每个处理设置3个重复,取其平均值,根据单因素水平试验,确定因素水平进行正交试验。培养2周,取样测定悬浮细胞活性,计算悬浮细胞活性增长率,确定最优培养基条件,并进行验证试验。

1.4 细胞生长曲线的测定
根据获得细胞培养基最优条件,进行悬浮细胞生长曲线的测定试验,继代后按照不同生长时间,每隔3天采样,取2 mL细胞培养液,真空抽滤,测定细胞鲜重和悬浮系细胞活性,每个时期设置3次重复,计算悬浮细胞鲜重和细胞活性增长率。取适量悬浮细胞滴到载玻片中央,用光学显微镜观察记录对数生长时期西番莲悬浮细胞的形态结构。
1.5 数据处理
实验数据处理采用Excel 2007软件,数据显著性分析采用SPSS 19.0软件;分析显著性水平(P<0.05),采用Duncan新复极差法。
2 结果与分析
2.1 不同外植体及激素水平对诱导西番莲愈伤组织的影响
将西番莲幼苗不同外植体接种于诱导培养基上,7~14天后诱导出不同类型的愈伤组织(表1)。其中胚轴处理的出愈率最高(86.7%),愈伤产生时间最早,第7天开始出现愈伤,幼根出愈率最低(40.0%),诱导愈伤最慢,2周后开始产生愈伤。不同外植体产生的愈伤颜色和状态也略有不同。其中胚轴产生的愈伤为半透明米白色,呈疏松颗粒状,生长良好;嫩叶愈伤则是透明白色的粉颗粒状,较疏松,但生长较慢;幼根愈伤组织则是黄褐色的较紧实块状物,生长较慢。嫩茎的出愈率仅次于胚轴,愈伤为米白色、块状、较疏松的,但是愈伤生长较缓慢。综上,幼苗胚轴是比较适用于诱导愈伤组织的外植体。

表1 不同外植体诱导愈伤组织的反应
选取幼苗胚轴为外植体,研究不同激素水平对西番莲愈伤组织的诱导的影响。结果如表2所示,2,4-D激素处理可诱导出透明或半透明米白色疏松的颗粒状的愈伤组织,其中2,4-D为2.0 mg/L的处理出愈率最高(83.3%),诱导时间最短,生长较快,不同时期的愈伤组织生长如图1所示,约30天后即可获得较为疏松的、状态良好的愈伤。使用6-BA和NAA的处理中,诱导时间较长,出愈率较低(36.7%~43.3%)愈伤为黄褐色,少量长根,生长较慢。
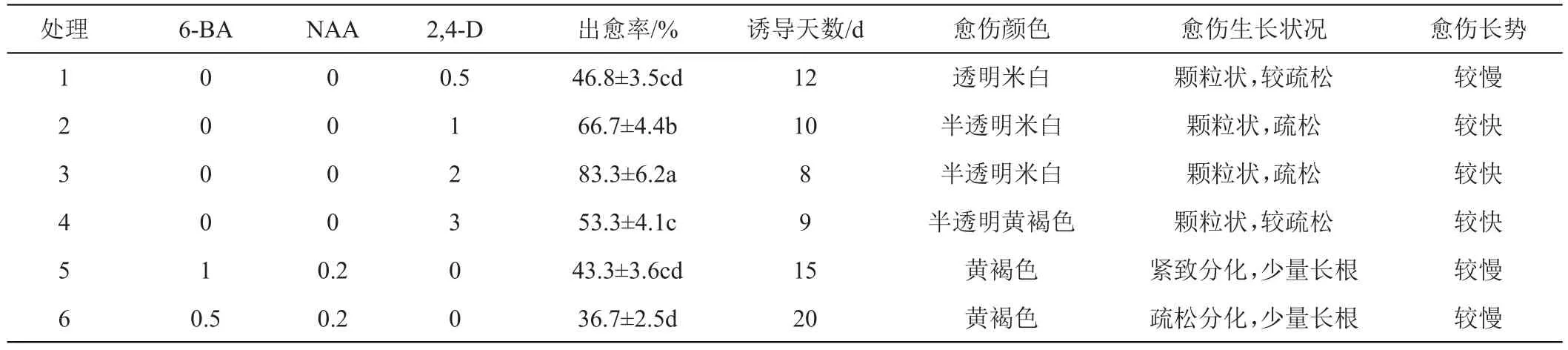
表2 不同激素水平诱导西番莲胚轴愈伤组织的反应

图1 西番莲胚轴愈伤组织诱导不同时期生长状况
综上所述,西番莲愈伤诱导的外植体最佳选择是幼苗胚轴,诱导培养基中激素采用2.0 mg/L 2,4-D比较适合,此条件下,约1个月后产生半透明米白色、疏松且生长状态良好的愈伤组织。
2.2 西番莲悬浮细胞培养条件的研究
2.2.1 单因素试验 优化培养条件的单因素试验中,在基础培养基中,设置不同2,4-D水平、起始细胞用量、蔗糖用量和培养基pH条件,培养2周后,测定并计算细胞鲜重和悬浮系细胞活性增长率,结果如图2~5所示。西番莲悬浮细胞培养条件在2,4-D浓度为0 mg/L时,细胞鲜重和活性增长极慢(图2),随着激素的增加呈上升趋势,在2,4-D浓度为2.0 mg/L两者达到最大值,随后增至3.0和4.0 mg/L时,细胞鲜重和活性增长率逐渐降低。起始细胞用量水平也影响着细胞鲜重和活性增长率(图3),两者随着起始细胞用量的增加呈上升趋势,在8.0 mg/mL时为活性最高,用量增至10.0 mg/mL后,尽管鲜重增长率仍处于上升态势,但活性增长率开始降低,细胞液由微黄色变为微褐色。培养基pH条件对细胞鲜重与活性影响不同,在pH为5.5时,细胞鲜重增长率最高,随着pH的提高,增长率逐步降低;在细胞活性增长率中,pH 5.5和6.1时,出现2个增长峰,在pH 5.8时,增长率略有下降。培养基的蔗糖用量同样影响细胞鲜重和活性的增长率,细胞鲜重和活性增长率在蔗糖用量为30 g/L时最高,随着用量增加而降低,活性增长率在蔗糖用量为60 g/L时出现一个小高峰,蔗糖用量增至70 g/L时鲜重和活性增长率降低,细胞由微黄色转至黄褐色。
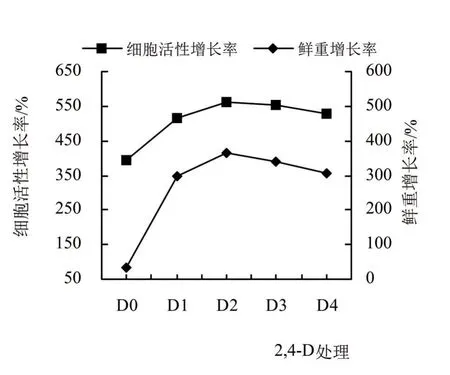
图2 不同2,4-D浓度对西番莲悬浮细胞生长及活性的影响
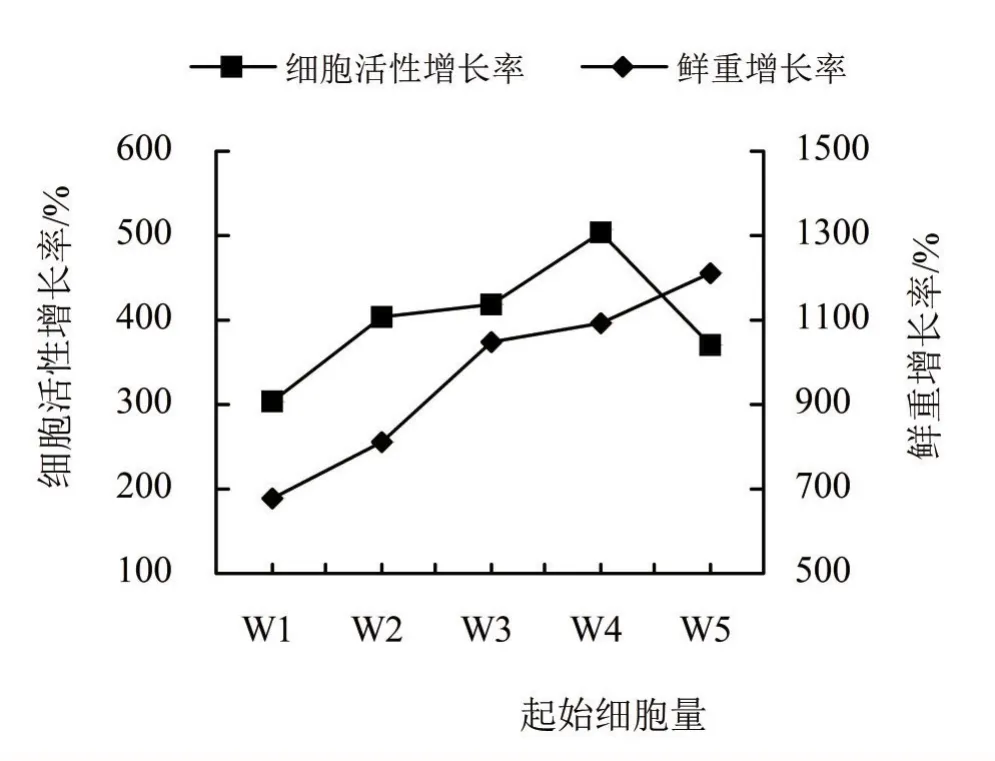
图3 不同细胞起始用量对西番莲悬浮细胞生长及活性的影响
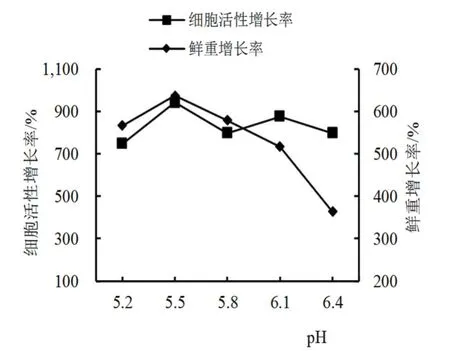
图4 培养基pH对西番莲悬浮细胞生长及活性的影响
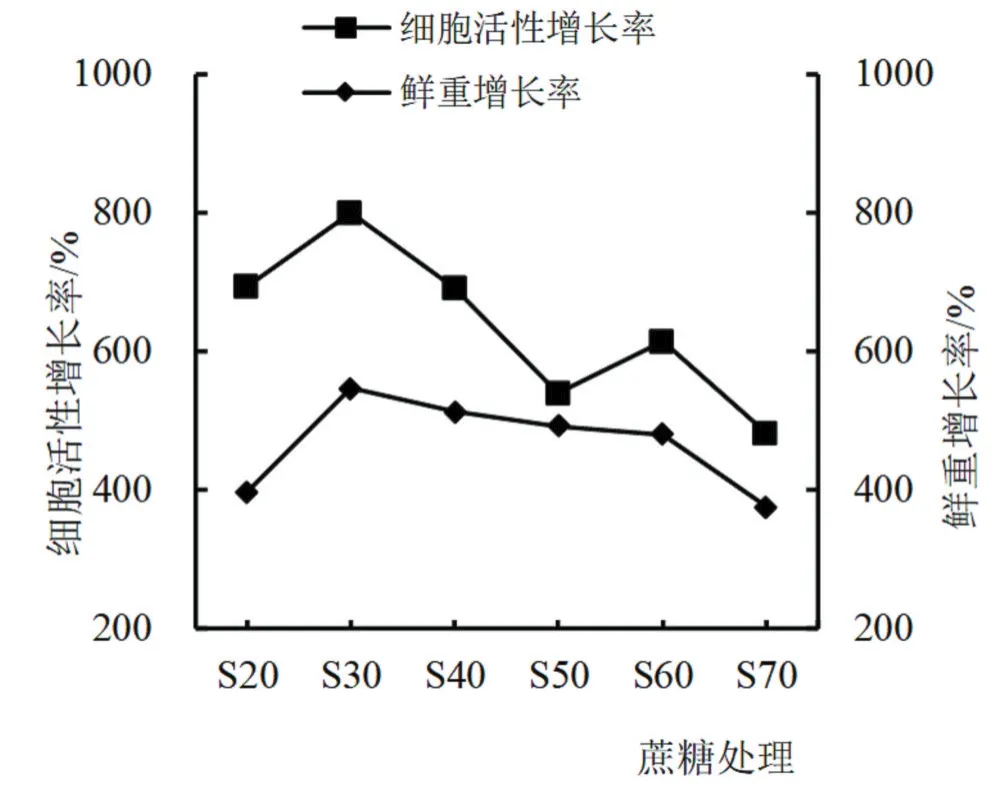
图5 蔗糖处理对西番莲悬浮细胞生长及活性的影响
2.2.2 正交试验 综合以上单因素试验结果,设置2,4-D水平、起始细胞用量、蔗糖用量和pH条件四个因素三个水平进行L9(34)正交试验(表3),以确定西番莲悬浮细胞培养最佳条件。正交试验结果如表4所示,影响西番莲悬浮系细胞活性大小的顺序是S>P>D>W,即蔗糖用量>pH>2,4-D水平>起始细胞用量,蔗糖用量是影响悬浮细胞活性的主要因素,起始细胞用量对细胞活性的影响为四者最小,最佳组合S1P3D2W2,即蔗糖浓度为30 g/L、pH6.1、2,4-D 2 mg/L和起始细胞用量为6.0 mg/mL。方差分析显示蔗糖浓度(S)对悬浮细胞活性的影响显著(P<0.05),其余因素未达显著水平。
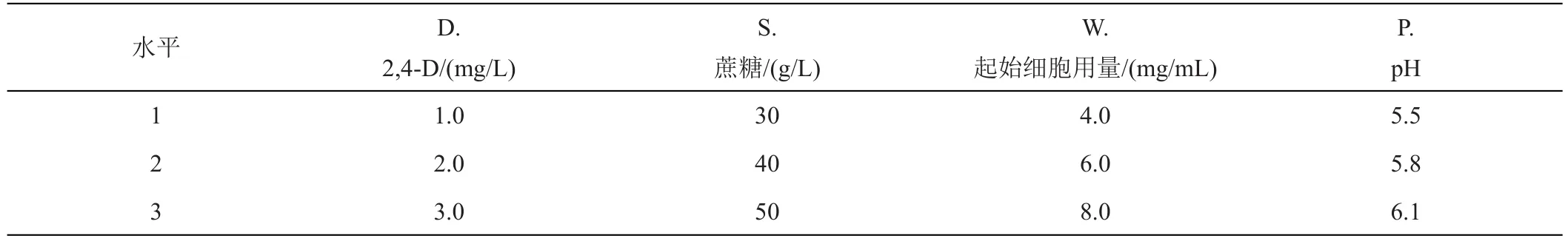
表3 L9(34)正交试验设计
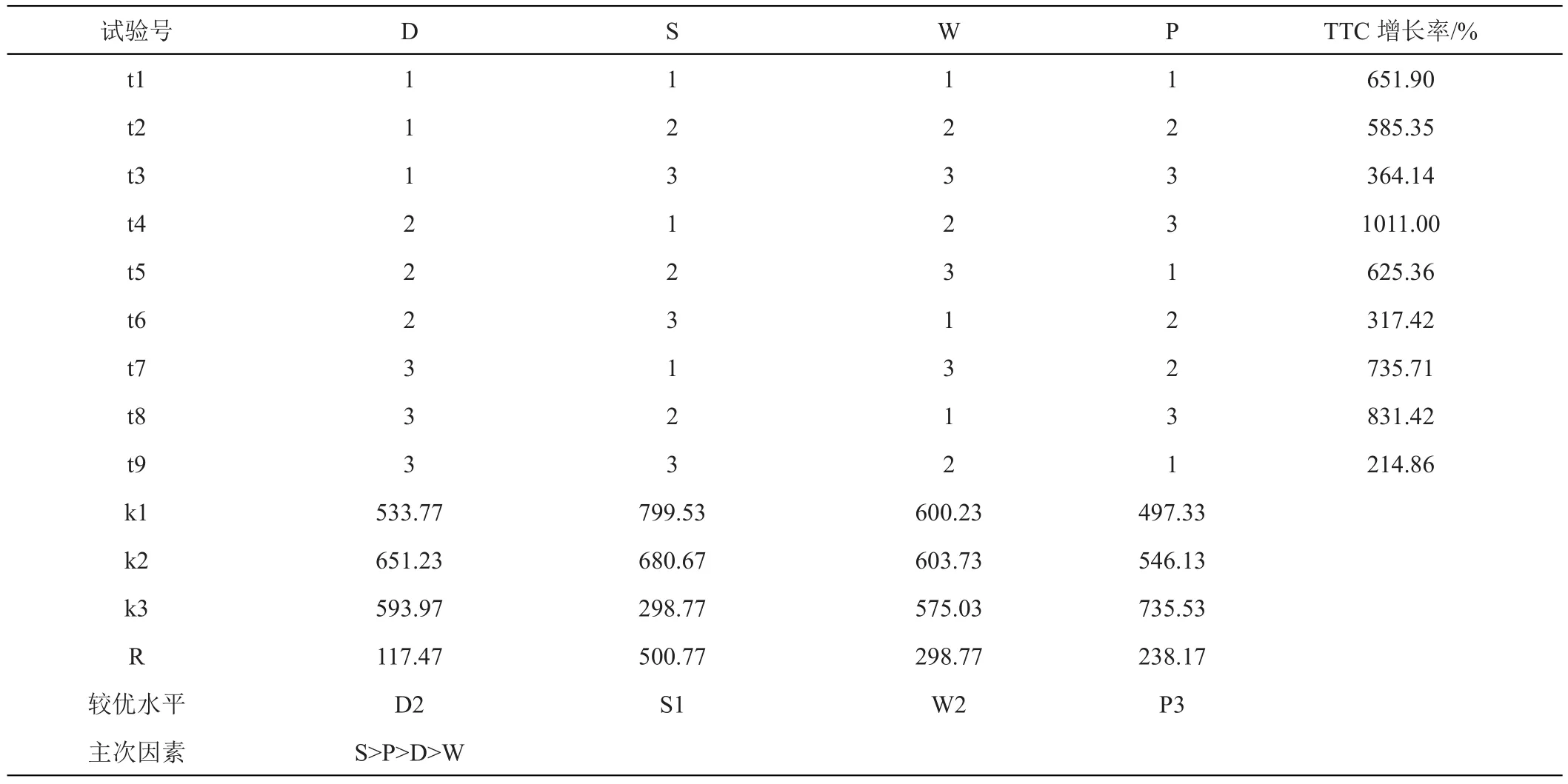
表4 不同因素组合对西番莲细胞悬浮培养的影响
根据最佳组合进行验证试验,培养条件为基础培养基和蔗糖浓度为30 g/L、pH 6.1、2,4-D 2.0 mg/L和起始细胞用量为6.0 mg/mL,培养2周后,细胞活性增长率为1030.9%,与正交试验结果相近。
2.3 西番莲细胞悬浮系生长曲线
以上述获得的最优培养条件配置细胞培养基对悬浮系进行培养,在不同时期观察测试悬浮细胞的生长情况,结果如图6所示。刚开始培养3天内,细胞处于恢复阶段,细胞鲜重和细胞活性变化不大,随着培养时期的延长,细胞鲜重和细胞活性增长率逐渐提高,慢慢进入对数生长期,在第6~12天增长较快速,其中悬浮细胞活性增长率最大值出现在第15天,随后缓慢降低;而鲜重增长率最大值在第24天,随后慢慢降低,营养物质消耗加快,培养基开始变混浊,至30天时细胞液呈现微褐色,在培养瓶壁上可见衰败细胞。本试验条件下,西番莲悬浮细胞继代最佳时期为12~18天,此时细胞活力最强且细胞鲜重较高。利用光学显微镜对对数生长期的细胞进行形态观察(图7),结果显示西番莲悬浮细胞较为均匀一致,细胞呈近圆形或短柱形,多为微细胞团和少量单细胞,细胞生长旺盛,细胞质浓厚。

图6 西番莲悬浮细胞生长曲线
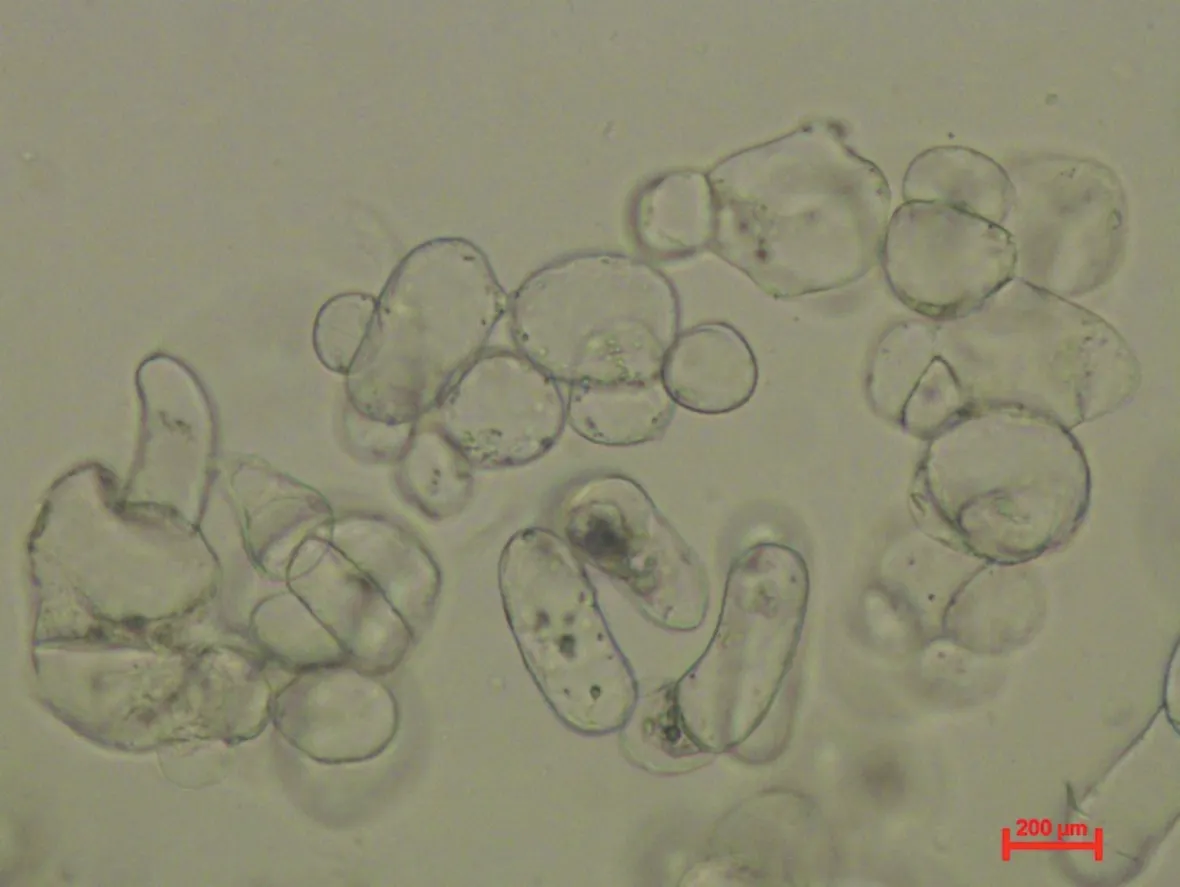
图7 西番莲悬浮细胞形态(对数生长期)
3 讨论与结论
通过基因工程技术进行植物遗传改良,可望克服传统育种的限制因素而达到果树品种改良和实现快繁的目的,是近年果树育种的发展趋势。研究愈伤组织的诱导和细胞培养的适宜条件,是建立理想的遗传改良受体——胚性细胞悬浮系的的前提。本试验研究并优化西番莲愈伤组织及细胞悬浮系培养条件,形成高效、稳定的西番莲细胞悬浮系,为西番莲细胞工程及遗传改良创制新种质提供重要的基础。
愈伤组织诱导效率受外植体种类、培养基组成及激素种类和水平、培养的条件等因素影响[18-20]。普遍采
用的外植体有胚轴、叶片、茎段、茎尖、根系、花器官等[17,21-22]。细胞分裂素和生长素是最常用的植物生长调节剂,生长素以2,4-二氯苯氧乙酸(2,4-D)使用最为广泛,细胞分裂素则6-苄氨基嘌呤(6-BA)为主,兼有苯基脲类衍生物(TDZ)[10-11,21-22]。培养基中的激素种类和浓度是影响细胞生长及状态的重要因子,胚性组织愈伤组织优于非胚性愈伤组织,胚性愈伤组织一般比较疏松、繁殖生长较快,继代稳定后可用于培养悬浮细胞系[17,22]。本研究试验结果表明,西番莲愈伤诱导的外植体最佳选择是幼苗胚轴,诱导培养基中激素添加2.0 mg/L 2,4-D,诱导培养一个月左右产生半透明米白色、疏松且生长状态良好的胚性愈伤组织,与前人在香蕉、白刺花等研究结果较为相似[23-24]。
稳定的胚性愈伤组织细胞可用于培养悬浮细胞,悬浮细胞的生长受起始细胞用量、培养基激素、碳水化合物供给和pH等因素的影响[25]。与愈伤组织诱导相似,培养基中2,4-D用量影响悬浮细胞的生长与活性。研究表明2,4-D能促进细胞生长,限制细胞进一步分化,使细胞呈较稳定脱分化状态[10,26]。在本试验中,2,4-D为2.0 mg/L时,悬浮细胞增殖最快,活性最高,此时细胞质丰富,形状较为规整,细胞核大;增至4 mg/L时,细胞增殖速度降低,呈现微褐色,可能产生酚类物质含量增多。起始细胞用量即接种量影响悬浮体系,因为植物细胞具有群聚性,在细胞初始密度与营养物比例合理,才能较好促进细胞分裂生长,培养效果才能达到理想状态[27-28]。本试验中,西番莲起始细胞用量在低于4.0 mg/mL时,活性和鲜重增长率较缓慢,在8.0 mg/mL时为细胞活性最高,用量增至10.0 mg/mL后,活性增长率开始降低,死细胞增多,细胞液由微黄色变为微褐色。于波等[10]在白鹤芋悬浮细胞在起始浓度0.3 g时较为适宜细胞的分裂和生长,过高和过低则起限制作用。蔗糖为悬浮细胞提供碳源营养,同时调节渗透压高低。当蔗糖浓度过低,不足以维持细胞的生长,细胞质不够丰富,体积较小,随着蔗糖浓度的升高,培养液中的渗透压过高也会影响悬浮细胞的生长[10,25]。在本试验中,培养液蔗糖浓度30 g/L时细胞鲜重和活性增长率为最高,随着浓度增加,至70 g/L时细胞活性最低,由微黄色转至黄褐色,与前人研究结果较为一致[10,29]。培养液pH同样会影响细胞生长与状态,本研究结果中pH为5.5~6.1时细胞鲜重和活性增长率比较高;邹瑞等[16]发现诺丽悬浮细胞培养液pH在4.5~5.0范围内生长最为旺盛;丛林晔等[30]认为pH值为6.0的培养基中水稻悬浮细胞密度增长最快。
在本试验中,细胞培养优化条件下,西番莲悬浮细胞生长曲线呈“S”形。在继代初期时,细胞生长延迟期出现在增殖培养的0~6天内;较快速生长的细胞对数增长期则出现在第6天后,细胞鲜重和细胞活性增长率较高;随着培养天数的增加,虽然细胞不断增值,细胞之间相互竞争逐渐减少的营养物质;第15天后细胞活性增长率逐渐降低,第18~24天细胞生长进入稳定期,在24~30天后生长停缓、部分细胞褐化及凋亡。本试验条件下,西番莲悬浮细胞继代最佳时期为12~18天,此时细胞活力较强且细胞鲜重较高,可以维持悬浮细胞系生长的稳定性。
本研究利用幼芽茎段诱导愈伤组织,建立了稳定的西番莲胚性细胞悬浮系。本研究结果认为西番莲愈伤诱导的外植体最佳选择是幼苗胚轴,诱导培养基中激素适宜采用2.0 mg/L 2,4-D,约1个月后产生半透明米白色、疏松且生长状态良好的愈伤组织。悬浮细胞培养条件为基础培养基和蔗糖浓度为30 g/L、pH 6.1、2,4-D 2.0 mg/L和起始细胞用量为6.0 mg/mL,此条件下建立的细胞悬浮系均匀一致,细胞密度大,细胞质浓厚,细胞生长旺盛,能在短期内提供大量悬浮细胞,为后续西番莲利用悬浮系建立高效细胞工程及遗传转化技术体系提供良好的材料和技术基础。

