影响广东米香白酒饮后代谢与舒适度的关键酒体风味成分研究
刘 雅,皇甫洁,何松贵,方毅斐,关美玲,何猛超,王德良,4*,吴振强
(1.新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐 830052;2.中国食品发酵工业研究院有限公司,北京 100015;3.广东省九江酒厂有限公司,广东 佛山 528203;4.科技部国家酒类品质与安全国际联合研究中心,北京 100015;5.华南理工大学 生物科学与工程学院,广东 广州 510641)
广东米香白酒具有“玉洁冰清,豉香独特,醇和甘滑,余味爽净”的特点[1],因其用小曲生产,先固态培菌糖化,然后加水进行半液态发酵,故在酿造中微生物不仅作为酿造的发酵源,还能产多种风味化合物。根据其化学属性的不同,可以将白酒中的微量成分分为醇类、醛类、酸类、酯类以及其他类化合物[2-4]。醇类物质增加白酒绵甜和香气,起到增香增甜及调和的作用,但是当白酒中的醇类物质过高时,不仅会影响白酒的风味,还会在酒后产生不良反应,影响身心健康[5];醛类物质为白酒提供了刺激味和辛辣味,经常灌胃含游离状态乙醛的酒,对人体有强烈的刺激性,也能促进中枢血管收缩,从而心跳加速,血压上升,使人头晕脑胀,因此乙醛形成“酒瘾”在人体内蓄积,损害人体中枢神经的原因之一[6-7];酒中酸味是由氢离子提供的,适量的酸可对酒起缓冲作用,并在贮存过程中能缓慢地形成香酯而酯类化合物在白酒中不仅起到呈香呈味的作用,还可以加速乙醇、乙醛在人体内的代谢,灌胃者不易昏醉和上头[8-9];酯类物质和酸构成的比例也是影响上头的重要因素之一[10]。
目前,许多研究报道了白酒中的微量成分对白酒饮后代谢与舒适度影响。邱修柄[11]运用气相色谱(gas chromatography,GC)检测到梅州地区米香型白酒上头主要受杂醇油、醛类、酯类及酸的影响,异丁醇的危害程度是乙醇的8倍,而异戊醇的危害程度是乙醇的19倍,确定了异丁醇和异戊醇是导致广东米香白酒上头的重要原因。余洁瑜等[12]也指出,乙醛能够刺激人体的中枢神经系统,促进脑细胞收缩甚至痉挛,其毒性大约是乙醇的10倍。谢佳等[13]通过模拟豉香型白酒特征组分的组成而制备配制酒,对其进行醉度评价,结果揭示了合适的异戊醇、酸、酯比例可有效降低醉度;异戊醇对醉度具有双向作用,这主要取决于异戊醇、酸、酯配比。
为了探讨影响广东米香白酒饮后代谢与舒适度的关键成分,通过动物行为学和酒精代谢生物标志物,对4款市售广东米香白酒饮后代谢与舒适度进行评价,结合酒体成分主成分分析(principal component analysis,PCA)分析影响广东米香白酒代谢与舒适度的关键成分。同时结合灌胃后小鼠自主行为变化以及酒精代谢程度的比较研究,确定影响广东米香白酒饮后代谢与舒适度的关键物质,以期为提高广东米香白酒饮后代谢与舒适度提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 实验样品和实验动物
四款广东米香白酒(酒样A(40%vol)、酒样B(40%vol)、酒样C(40%vol)、酒样D(40%vol)):市售。
50日龄的雄性C57/BL21小鼠(体质量平均为(20±2)g):斯贝福(北京)生物技术有限公司,实验前于清洁Ⅱ级环境进行一周适应性饲养。
1.1.2 化学试剂
异戊醇、乳酸:天津市福星化学试剂有限公司;异丁醇、己酸乙酯:北京百灵威科技有限公司;正丙醇、乳酸乙酯、丁酸乙酯:上海晶纯生化科技股份有限公司;活性戊醇:上海安普实验科技股份有限公司;2,3-丁二醇、乙醛、糠醛:比利时Acros公司;己酸:赛默飞世尔科技(中国)有限公司;乙酸:天津市致远化学试剂有限公司;乙酸乙酯:北京北化精细化学品有限责任公司。实验所用试剂均为色谱纯或分析纯。
1.2 仪器与设备
旷场实验动物行为学跟踪系统(ANY-Maze系统):美国Stoelting公司;Clarus-SQ气质联用(gaschromatography-mass spectrometer,GC-MS)仪:美国PerkinElmer公司;Clarus 580气相色谱(GC)仪(配备氢火焰离子化检测器(flame ionization detector,FID))、Scimtific Forna 900超低温冰箱:美国热电公司;DHG-9162电热恒温培养箱:上海一恒科技有限公司;J&W-GC型硅烷化玻璃微球色谱柱(30 m×0.53 mm×1.00 m):美国Agilent公司;Multiskan FC型酶标仪:美国Thermo公司;Milli-Q Gradien超纯水系统:美国Millipore公司SW-CJ-1F洁净工作台:苏州安泰空气技术有限公司。
1.3 实验方法
1.3.1 实验分组
根据广东米香白酒酒体内风味物质的含量选取200 mg/kg、500 mg/kg、800 mg/kg、1 000 mg/kg四个质量浓度进行风味成分酒精灌胃,实验共分为如下几组:①酒样灌胃实验组:分别灌胃4款广东米香白酒;②空白灌胃对照组:灌胃去离子水(安慰剂);③食用酒精灌胃对照组:灌胃40%vol食用酒精;④风味成分酒精灌胃实验组:灌胃体积分数40%vol食用酒精配制200 mg/kg、500 mg/kg、800 mg/kg、1 000 mg/kg风味成分溶液。
1.3.2 灌胃剂量
根据《2019年美国肝病学会临床指南:酒精相关性肝病的诊断和治疗》[14]对酒精性肝病的人体每日酒精摄入最大剂量建议,同时结合我国饮酒人群的日常饮酒量统计学数据,以人体每日摄入纯酒精量为60 g/kg体质量为参照,与小鼠的等效药理学剂量进行折算出每只小鼠每日纯酒精摄入剂量为7.8 g/kg体质量,根据所用酒样的酒精度(40%vol),计算出每只动物每天灌胃白酒和食用酒精剂量为0.3 mL/只。
1.3.3 旷场实验方法
根据1.3.1中的实验分组,每组小鼠对应一种实验酒样,将每组小鼠依次在灌酒前0 h、灌酒后2 h分别置于空地上的实验动物行为跟踪系统,实时记录并同时分析灌酒前0 h、灌酒后2 h小鼠自由运动120 s的行动轨迹作为行为参数。实验操作过程中保持安静,每只动物在实验结束后及时清理,以减少之前动物的气味,防止行为干扰。
1.3.4 主成分分析法
主成分分析(principal component analysis,PCA)是利用降维的思想,将多个相互关联的变量转化为几个不相关的综合指标,即找到几个主成分,使其尽可能多地保留原有变量的信息,且相互不相关,是一种通过线性转换为一组不相关的变量,简化原有多维问题的数学转换方法[15-18]。本实验采用SPSS 26.0软件对上述物质成分进行主成分分析,将醇类、醛类、酸类、酯类每一类的累计方差贡献率达到93%且特征根>1的成分定义为主成分。
1.3.5 酒体风味成分检测
风味成分测定采用气质联用法。GC条件:纯度>99.999%的高纯氦气(He)为载气,CF-Wax57CB毛细管色谱柱(25 m×0.25 mm×0.2 μm)的起始柱温35 ℃恒温后继续升温至230 ℃,然后不分流进样;进样口温度240 ℃;质谱条件:电子电离(electron ionization,EI)源,离子源温度230 ℃;采用选择离子监测(selected ion monitoring,SIM)扫描模式。以乙酸正戊酯(2%)和2-乙基丁酸(2%)作为内标进行半定量。
有机酸测定采用离子色谱法。色谱条件如下:Dionex IonPao AG11-HC分析柱(4 mm×250 mm);Dionex IonPao AG1I1-HC保护柱(4 mm×50 mm);淋洗液:超纯水;淋洗液流速1.1 mL/min;进样体积50 μL;色谱池温度35 ℃;柱温30 ℃;抑制器电流96 mA。
1.3.6 小鼠血清中乙醇和乙醛含量测定
小鼠灌胃后2h,摘除眼球采集血液标本0.5mL,3500r/min离心15 min,提取上清液作为血清,-80 ℃保存,用于测定乙醇和乙醛含量。
血清中乙醇和乙醛的含量根据中华人民共和国公共安全标准GA/T 842—2009《血液酒精含量的检验方法》中的气相色谱法进行测定[19],并稍有改进。
待测血清在进样前稀释10倍,将1 mL稀释后的样品置于顶空瓶中并密封。气相色谱条件:J&W-GC型硅烷化玻璃微球色谱柱(30 m×0.53 mm×1.00 m)。检测器温度250 ℃,进样口温度240 ℃,柱温起始温度40 ℃,以10 ℃/min升温至60 ℃,然后以20 ℃/min升温至120 ℃,以40 ℃/min升温至215 ℃,顶空温度55 ℃,加热时间40 min。载气:氮气(N2),流速1mL/min,火焰离子检测器(FID)。进样量:1 μL。
1.3.7 数据处理及分析
所有的数据均重复测定5次,实验结果采用Excel 2019、SPSS Statistics 26.0软件,使用方差分析(analysis of variance,ANOVA)方法进行统计,图由Origin Pro 2018绘制。
2 结果与分析
2.1 广东米香白酒中关键酒体成分主成分分析
为进一步判断酒样中起重要作用的关键酒体成分,通过色谱技术对酒样A、酒样B、酒样C、酒样D 等4款广东米香白酒的主要风味物质进行定量分析检测,结果见图1。由图1可知,广东米香白酒中主要的风味成分中醇类物质主要有异戊醇、异丁醇、正丙醇、活性戊醇以及2,3丁二醇;醛类物质主要有乙醛、乙缩醛和糠醛;有机酸类物质主要有乳酸、乙酸以及己酸;酯类物质主要有丁酸乙酯、乙酸乙酯、己酸乙酯以及乳酸乙酯。对风味物质成分进行主成分分析,结果见图2。由图2可知,异丁醇、异戊醇、甲醇、异戊醛、糠醛、乙醛、戊酸、正丁酸、甲酸乙酯、己酸乙酯等微量酒体成分在各自类别的主成分中有较大贡献度,推测这些成分与影响广东米香白酒饮后代谢有一定的关联,为后期探讨影响广东米香白酒饮后代谢的关键酒体成分提供理论依据。
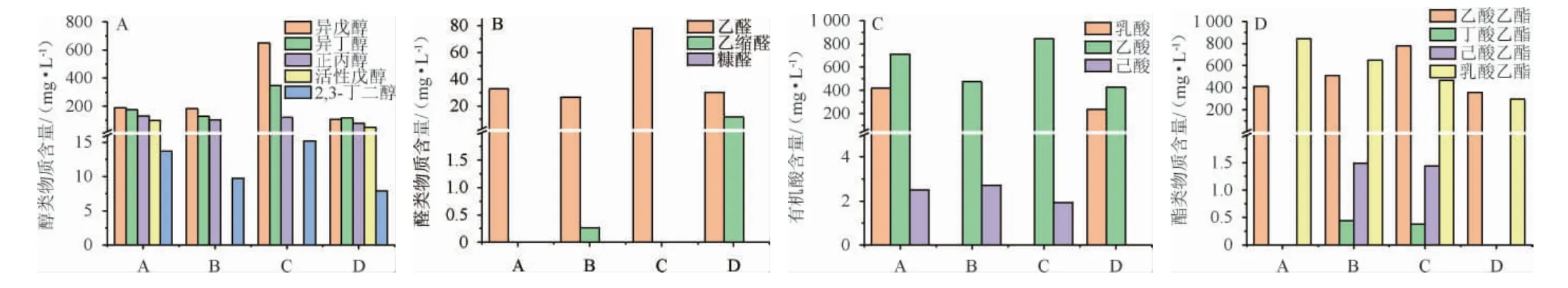
图1 四种广东米香白酒样品中风味物质GC-MS分析结果Fig.1 Results of flavor substances in four kinds of Guangdong rice-flavor Baijiu samples analyzed by GC-MS

图2 四种广东米香白酒样品风味物质主成分分析结果Fig.2 Principal component analysis results of flavor substances in four kinds of Guangdong rice-flavor Baijiu samples
2.2 小鼠旷场实验结果
旷场实验是动物精细行为中常用到的实验方法,因为小鼠不仅对开放空间有恐惧和趋避活动的倾向,还会对新的环境产生好奇心去探索,在很多场景下不仅可以模拟人的情绪、动作、活动等方面的特点,而且实验结果有很高的重复性[20-23],所以常用圆形或方形的箱子作旷场,小鼠可以自由活动,箱子的顶部装有摄像头,记录小鼠的活动,通过软件记录分析小鼠在旷场中的行动轨迹,行动距离、移动时间、停滞时间等参数。经前期实验发现,多个行为指标中,停滞时间比存在显著差异,测定其酒精代谢标志物后发现,停滞时间比差异显著组酒精代谢缓慢,从而影响饮后舒适度。故本试验选用灌胃后与灌胃前停滞时间比值表示,降低小鼠因个体差异造成的实验误差。
在食用酒精中添加不同浓度的不同醇类物质对小鼠灌胃后2 h的行为参数进行统计分析,结果见图3。由图3可知,醇类物质中,实验组酒样与食用酒精对照组相比,在灌胃后会引起小鼠行为参数下降,灌胃后小鼠行为的抑制程度比食用酒精和其他酒样明显增强,表现为适度抑制,其中异丁醇组有抑制作用显著(P<0.05),而正丙醇和异戊醇在物质浓度达到800 mg/kg时有显著抑制作用(P<0.05),当物质浓度达到1 000 mg/kg时,正丙醇和2,3-丁二醇停滞时间比小于食用酒精对照组,小鼠行为产生促进作用,小鼠表现为适量兴奋,但并无显著作用(P>0.05),推测醇类物质中异丁醇和异戊醇是影响饮后代谢的关键物质。

图3 小鼠灌胃醇类物质后在旷场中运动的停滞时间比Fig.3 Stagnation time ratio of motion in the open field of mice after intragastric administration of alcohols
在食用酒精中添加不同浓度的不同醛类物质对小鼠灌胃后2 h的行为参数进行统计分析,结果见图4。由图4可知,实验组酒样与食用酒精对照组相比,在灌胃后会引起小鼠行为参数下降,整体表现为行为抑制状态,且差异显著(P<0.05),其中乙醛组抑制作用有显著差异(P<0.05),推测醛类物质中乙醛是影响灌胃后代谢的关键物质。

图4 小鼠灌胃醛类物质后在旷场中运动的停滞时间比Fig.4 Stagnation time ratio of motion in the open field of mice after intragastric administration of aldehydes
食用酒精中添加不同浓度的不同有机酸类物质对小鼠灌胃后2 h的行为参数进行统计分析,结果见图5。

图5 小鼠灌胃后有机酸类物质在旷场中运动的停滞时间比Fig.5 Stagnation time ratio of motion in the open field of mice after intragastric administration of organic acid-like substances
由图5可知,实验组酒样与食用酒精对照组相比,各实验组在灌胃后会引起小鼠行为参数下降,整体表现为行为抑制状态,其中乳酸在达到500 mg/kg,己酸在达到800 mg/kg时抑制作用显著(P<0.05),推测有机酸中乳酸和己酸浓度的高低会影响白酒饮后的代谢。
在食用酒精中添加不同浓度的不同酯类物质对小鼠灌胃后2 h的行为参数进行统计分析,结果见图6。结果表明,实验组酒样与食用酒精对照组相比,在灌胃后会引起小鼠行为参数下降,整体表现为行为抑制状态,其中乳酸乙酯在200 mg/kg和500 mg/kg时抑制效果显著,但是己酸乙酯组和丁酸乙酯组在达到500 mg/kg时,灌胃后小鼠行为表现为适度兴奋,兴奋效果不显著(P>0.05)。
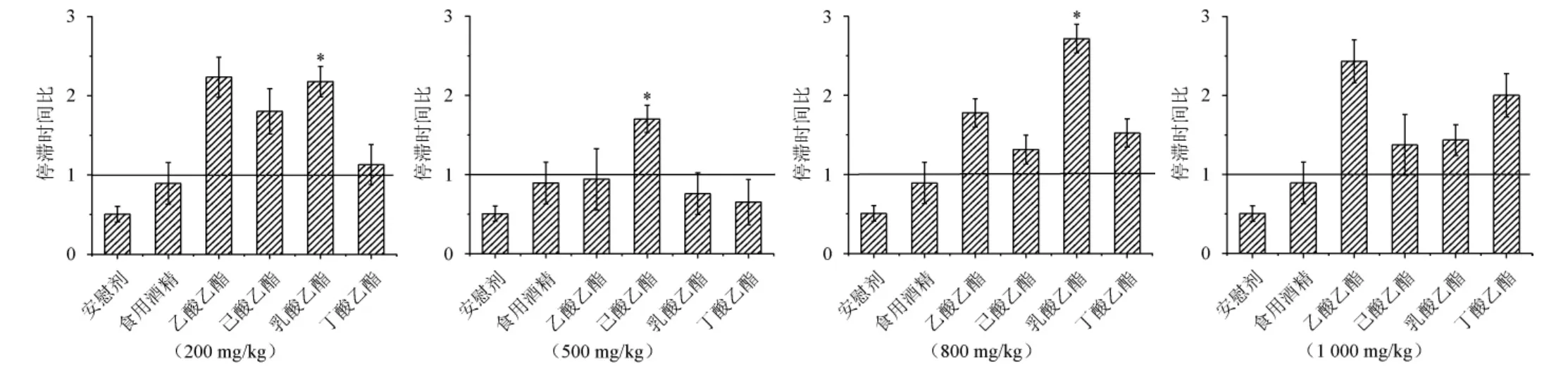
图6 小鼠灌胃酯类物质后在旷场中运动的停滞时间比Fig.6 Stagnation time ratio of motion in the open field of mice after intragastric administration of esters
2.3 小鼠灌胃后血清乙醇和乙醛积累水平分析
血液中与醉酒程度和饮后“上头”相关的主要生物标志物是乙醇和乙醛[25]。乙醇进入人体后随血液流经肝脏,首先被乙醇脱氢酶氧化为乙醛,该过程中会导致血液中乙醛的累积,乙醛可在体内积蓄,迫使末梢血管扩张,引起脸部血液的涌涨,并使中枢血管收缩,心跳加速,促使血压升高,使人头晕、涨痛,这是白酒饮后上头的重要原因之一[24-25]。当血液中乙醇浓度超过一定限度时,血流量增加而代谢作用却下降。这就造成乙醇在脑中不能及时代谢排出,必然会引起头痛、头晕。乙醛会使人心跳加速,血压升高,嗓子发干,头晕头痛[26]。
根据旷场实验结果,异戊醇组、异丁醇组和乙醛组、己酸组以及乙酸乙酯组灌胃后2 h行为参数差异较大,因此本实验中选用异戊醇组、异丁醇组和乙醛组、己酸组以及乙酸乙酯组对小鼠灌胃后2 h血清乙醇和乙醛含量测定,结果见图7。结果表明,与食用酒精对照组相比,低浓度异戊醇、乙醛、己酸组实验组,中低浓度中乙醛组、己酸组,高浓度的活性戊醇、乙醛、乳酸、乙酸组各实验组中小鼠血清中乙醛积累量高于对照组且乙醛组有显著差异(P<0.05),推测是该几组实验组小鼠肝脏中乙醛脱氢酶含量不足以将乙醛转化为乙酸从而导致乙醛在血清中积累。

图7 小鼠血清乙醇、乙醛含量测定结果Fig.7 Determination results of ethanol and acetaldehyde contents in serum of mice
2.4 成品酒灌胃后小鼠自主行为及血清中乙醇及乙醛积累水平分析
为验证上述实验结果,选用从市面所购买的异丁醇和异戊醇含量较高的两款广东米香白酒,按照1.3.3中描述的方法,测定小鼠灌胃后2 h在旷场中的行为参数,按照1.3.6测定小鼠血清中乙醇、乙醛含量,实验结果见图8。由图8a可知,与对照组相比,各实验组酒样在灌胃后会引起小鼠行为参数下降,灌胃后小鼠行为的抑制程度比食用酒精和其他酒样明显增强,表现为适度抑制且抑制作用显著(P<0.05)。由图8b可知,灌胃不同米酒后血清中乙醛的含量变化与2.3中结果一致。从2.1可知,B、D酒样中异丁醇、异戊醇含量较高。总体分析,异丁醇和异戊醇组灌胃后小鼠对酒精的代谢较低,结合酒后动物自主运动行为参数及行为参数比的分析结果,认为灌胃异丁醇和异戊醇组小鼠行为呈现抑制的状态。推测酒体成分中异丁醇和异戊醇是影响小鼠灌胃后酒精代谢与乙醛转化积累的主要原因[22]。

图8 小鼠灌胃成品酒后在旷场中运动的停滞时间比(a)及血清中乙醇和乙醛含量测定结果(b)Fig.8 Stagnation time ratio of locomotion of mice in the open field after gavage (a) and determination results of ethanol and acetaldehyde contents in serum (b)
3 结论
本研究在前期建立以精细行为和神经网络综合研究为基础的饮酒后行为与感受层面的饮后舒适度评价模型[24-26]的基础上,根据广东米香白酒酒体风味成分的主成分分析,再结合小鼠行为学实验,以及饮酒后血液乙醇和乙醛代谢及积累程度的分析,对酒样中在灌胃后舒适度起关键作用的酒体风味成分进行初步研究。结果表明,灌胃不同浓度不同风味成分后,在饮酒后行为变化及酒精代谢程度存在差异性,实验组酒样与食用酒精对照组相比,醇类物质在灌胃后会引起小鼠行为参数下降整体表现为行为抑制状态,其中异丁醇和异戊醇抑制作用显著(P<0.05),而血清中乙醛的积累量也高于食用酒精对照组,醛类物质中仅乙醛对小鼠行为抑制作用显著(P<0.05),且血清中乙醛积累量显著高于对照组(P<0.05),有机酸类物质和酯类物质虽对小鼠行为有抑制作用,但差异不显著(P>0.05)。本实验结果为广东米香白酒及其他白酒高提高饮后代谢以及产品品质提高提供研究支持。

