LncRNA PVT1 通过调节miR-214/STAT6 轴减轻哮喘模型小鼠气道炎性反应
黄 华,周 龙,姚 迪,许 诣
(1.湖北省恩施土家族苗族自治州中心医院 呼吸与危重症医学科, 湖北 恩施 445000;2.湖北文理学院附属医院 襄阳市中心医院 儿科, 湖北 襄阳 441021)
支气管哮喘(bronchial asthma)是一种涉及多种细胞和细胞因子的慢性炎性呼吸道疾病,临床症状包括胸闷、气短、喘息和干咳。哮喘的特征是气道炎性反应和重塑,导致气道高反应性和不可逆性气流阻塞[1]。慢性炎性损伤是哮喘的主要病理改变,也是哮喘发作的主要特征,因此抑制炎性反应是缓解哮喘症状的重要靶点[2]。已有研究发现,长非编码RNA PVT1(long non-coding RNA PVT1,lncRNA PVT1)与炎性疾病的发生发展密切相关。哮喘患者的原代气道平滑肌细胞中lncRNA PVT1的表达高于健康人,lncRNA PVT1的表达可能影响气道平滑肌细胞的增殖和炎性因子的释放[3]。这一发现表明,lncRNA PVT1在支气管哮喘中起关键作用,但需要进一步研究以阐明其下游分子及其相应机制。同样,先前的研究表明microRNAs(miRNAs)的异常表达也可以调节炎性因子的水平。例如,上调miR-214的表达可能降低信号转导子和转录激活子6(signal transducers and activators of transcription 6,STAT6)的水平,减轻溃疡性结肠炎的炎性反应[4]。因此,本研究拟通过构建哮喘小鼠模型,以探究抑制lncRNA PVT1表达对支气管哮喘的影响,以及对miR-214/STAT6轴的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级雄性Balb/c小鼠,体质量18~22 g[河北医科大学,许可证号:SYXK(冀)2020-002]。实验动物在房间通风良好、温度(24±2)℃、相对湿度为60%±10%和12∶12明暗周期的条件下饲养。动物自由采食饮水,经过一周适应性饲养后用于实验。本研究经本院伦理委员会批准。
1.1.2 细胞与试剂:人小气道上皮细胞系(human small airway epithelial cells,HSAECs)(中国科学院上海生物化学与细胞生物学研究所)。LncRNA PVT1抑制物及其阴性对照序列、miR-214模拟物及其阴性对照序列(广州锐博生物科技有限公司合成)。白介素-4(Interleukin-4,IL-4)测试盒、IL-5试剂盒、IL-13试剂盒和卵清蛋白特异性IgE(ovalbumin specific IgE,OVA-sIgE)试剂盒(南京建成生物工程研究所)。RNA提取试剂盒(北京天根生化科技有限公司)。荧光定量PCR试剂盒[宝日医生物技术(北京)有限公司]。Anti-STAT6抗体及Anti-STAT6(phospho Y641)抗体(Abcam公司)。双荧光素酶报告基因检测试剂盒(北京索莱宝生物有限公司)。Lipofectamine 3000试剂盒(Thermo Fisher Scientific公司)。引物由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 动物的分组及处理:将小鼠随机分成对照组、模型组(于第1、8、15天腹腔注射100 μg OVA+1 mg氢氧化铝致敏。最后次致敏后,用1% OVA雾化吸入,每天30 min,连续7 d[5])、lncRNA PVT1抑制组和lncRNA PVT1 NC组(在OVA雾化吸入前,每天尾静脉注射lncRNA PVT1抑制物或其阴性对照,持续7 d),每组12只。
1.2.2 支气管肺泡灌洗液(BALF)的分析:末次干扰24 h后,腹腔注射麻醉处死小鼠,然后暴露气管切开,注入PBS 3 mL后抽出2 mL支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),4 ℃下400×g离心10 min,上清液保存在-80 ℃中备用。使用血细胞计数仪计数BALF中炎性细胞总数、巨噬细胞数、中性粒细胞数和淋巴细胞数。采用ELISA试剂盒对BALF上清液中白介素-4(IL-4)、白介素-5(IL-5)、白介素-13(IL-13)浓度进行检测。
1.2.3 OVA特异性免疫球蛋白E(IgE)的测定:使用OVA特异性IgE试剂盒对各组小鼠血清中IgE含量进行检测,具体操作根据试剂盒说明书进行。
1.2.4 肺组织病理学检测:取各组小鼠的右肺组织常规制片染色后,于光学显微镜下观察炎性细胞浸润情况,并对肺组织的炎性细胞浸润情况进行评分。评分标准为;0分(无)为肺组织无明显炎性细胞浸润;1分(轻度)为轻度炎性细胞浸润;2分(中度)为中度炎性细胞浸润;3分(重度)为重度炎性细胞浸润[6]。
1.2.5 RT-qPCR检测肺组织中miR-214和STAT6 mRNA水平:采用Trizol试剂从左肺组织匀浆中提取总RNA。使用PrimeScript RT试剂盒进行反转录合成cDNA。使用Bio-Rad CFX96 Touch q-PCR系统进行RT-qPCR检测。反应混合物包括引物,Taq DNA聚合酶,PCR缓冲液,cDNA模板溶液和DEPC水。扩增过程为:95 ℃预变性60 s;95 ℃变性5 s,65 ℃退火30 s,72 ℃延伸120s,共40个循环。以U6或Gapdh为内参基因,用2-△△Ct法计算miR-214和STAT6 mRNA的相对表达量。本研究中使用的引物序列(表1)。
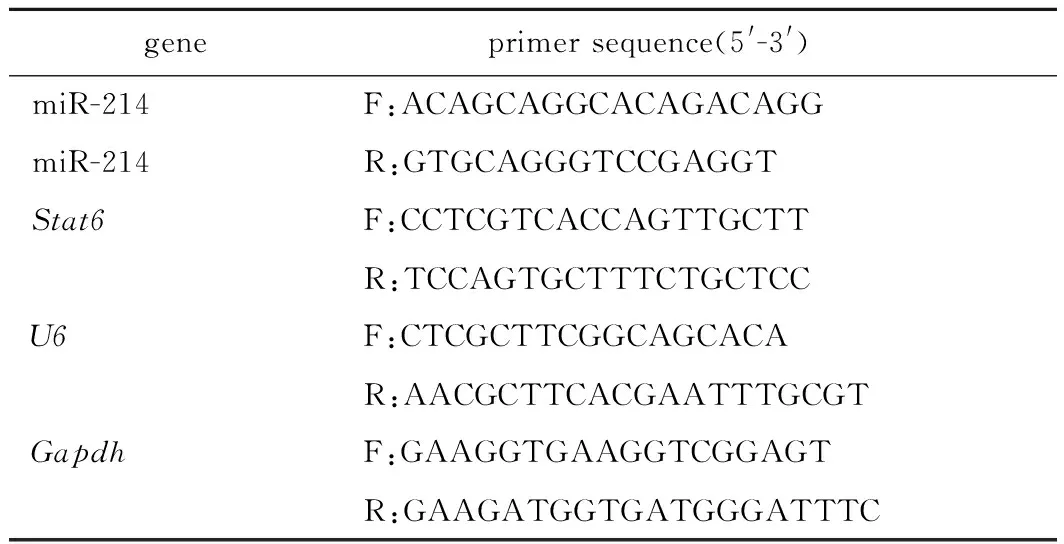
表1 RT-qPCR引物序列Table 1 Primers of RT-qPCR
1.2.6 Western blot检测肺组织中STAT6和p-STAT6蛋白表达:将肺组织用含蛋白酶和磷酸酶抑制剂的冰冷RIPA裂解缓冲液匀浆化,提取肺组织中总蛋白并检测含量。使用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离总蛋白,然后转移到聚偏二氟乙烯(PVDF)膜上。在含有5%牛血清白蛋白的缓冲液中封闭1.5 h,然后在4 ℃下与抗STAT6(1∶1 000)和p-STAT6(1∶500)的一抗过夜孵育。用辣根过氧化物酶标记的抗兔IgG二抗在室温下孵育1.5 h后洗膜。膜经增强型化学发光系统试剂处理后,用全自动化学发光图像分析系统显示特异性抗体的结合情况,并用Image J软件分析蛋白的相对表达水平。
1.2.7 双荧光素酶报告基因的检测:构建PVT1野生型和PVT1突变型的目标片段,并将其克隆到pGL3载体中,分别构建了pGL3-PVT1野生型(PVT1-wt)和pGL3-PVT1突变型(PVT1-mut)报告基因。将PVT1-wt或PVT1-mut与miR-214模拟物或其阴性对照共转染到HSAEC细胞中。转染48 h后,用双荧光素酶报告基因系统检测荧光素酶活性。
1.3 统计学分析
2 结果
2.1 小鼠BALF中炎性细胞分析
与对照组相比,模型组BALF中炎性细胞总数、巨噬细胞数、中性粒细胞数和淋巴细胞数显著增加(P<0.05);与模型组和lncRNA PVT1 NC组相比,lncRNA PVT1抑制组BALF中炎性细胞总数、巨噬细胞数、中性粒细胞数和淋巴细胞数显著回降(P<0.05)(表2)。
表2 小鼠BALF中炎性细胞分析比较Table 2 Comparison of inflammatory cells in BALF of cells/mL,n=12)
2.2 小鼠BALF中炎性因子水平变化
与对照组相比,模型组小鼠BALF中IL-4、IL-5、IL-13水平显著升高(P<0.05);与模型组和lncRNA PVT1 NC组相比,lncRNA PVT1抑制组小鼠BALF中IL-4、IL-5、IL-13水平显著降低(P<0.05)(表3)。

表3 小鼠BALF中IL-4、IL-5、IL-13水平的比较Table 3 Comparison of IL-4, IL-5 and IL-13 levels in BALF of mice
2.3 小鼠血清中IgE水平变化
与对照组相比,模型组小鼠血清中IgE水平显著升高(P<0.05);与模型组和lncRNA PVT1 NC组相比,lncRNA PVT1抑制组小鼠血清中IgE水平显著降低(P<0.05)(表4)。
表4 小鼠血清中IgE水平的比较
2.4 小鼠肺组织形态学变化
对照组小鼠肺组织结构清晰,气道周围或血管周围无明显炎性细胞浸润。模型组和lncRNA PVT1 NC组小鼠肺组织结构不规则,气道上皮不完整,气道黏膜水肿,黏膜下层和血管组织周围可见炎性细胞浸润。与对照组相比,模型组小鼠肺组织中炎性细胞浸润程度评分显著升高(P<0.05);与模型组和lncRNA PVT1 NC组相比,lncRNA PVT1抑制组小鼠肺组织中炎性细胞浸润程度评分显著降低(P<0.05)(图1,表5)。
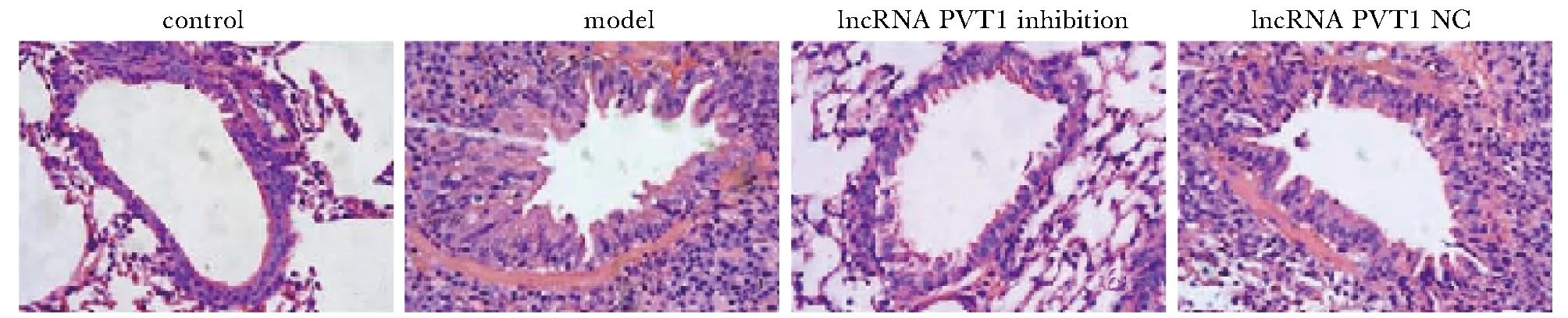
图1 小鼠肺组织形态学变化Fig 1 Morphological changes of mouse lung tissue(×200)
表5 小鼠肺组织炎性细胞浸润程度评分的比较
2.5 小鼠肺组织中miR-214水平变化
与对照组相比,模型组小鼠肺组织中miR-214水平显著降低(P<0.05);与模型组和lncRNA PVT1 NC组相比,lncRNA PVT1抑制组小鼠肺组织中miR-214水平显著升高(P<0.05)(表6)。
表6 小鼠肺组织中miR-214水平的比较
2.6 小鼠肺组织中STAT6的mRNA和蛋白表达水平变化
与对照组相比,模型组小鼠肺组织中STAT6 mRNA和蛋白磷酸化水平显著升高(P<0.05);与模型组和lncRNA PVT1 NC组相比,lncRNA PVT1抑制组小鼠肺组织中STAT6 mRNA和蛋白磷酸化水平显著降低(P<0.05)(图2,表7)。
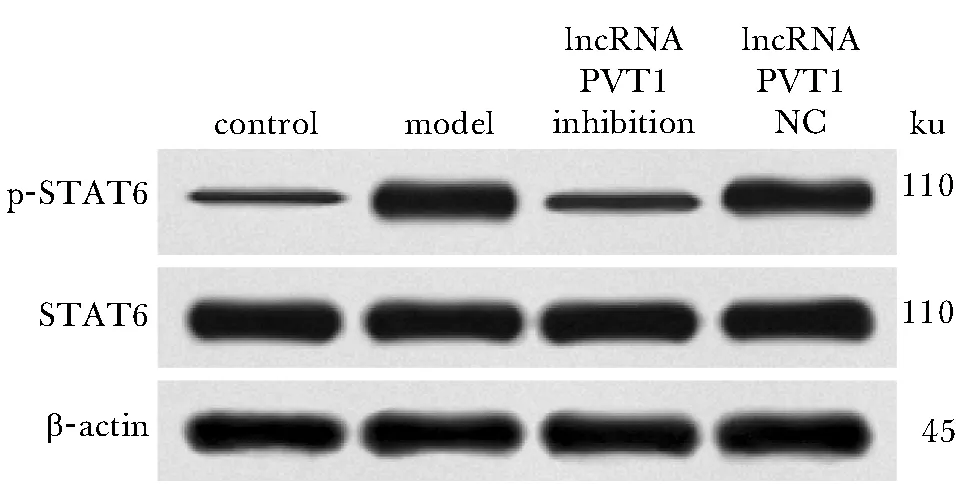
图2 小鼠肺组织STAT6与p-STAT6蛋白条带Fig 2 Protein bands of STAT6 and P-STAT6 in lung tissues of mice

表7 小鼠肺组织中STAT6的mRNA和蛋白表达 水平的比较
2.7 miR-214与lncRNA PVT1靶向关系的预测与验证
通过Starbase数据库的预测,发现miR-214与lncRNA PVT1 3′ UTR存在连续结合位点。miR-214模拟物的转染显著抑制了PVT1-wt载体的荧光素酶活性(P<0.05),但对PVT1-mut载体的荧光素酶活性没有显著影响(P<0.05)(图3,表8)。
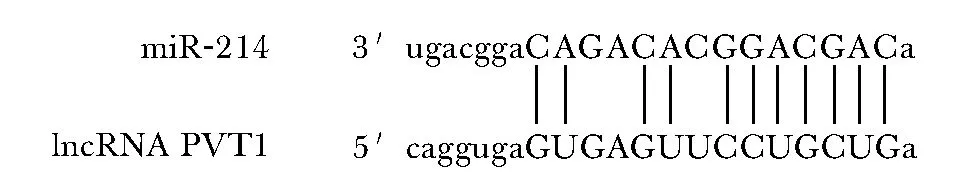
图3 生物信息学预测miR-214与lncRNA PVT1 3′ UTR结合位点Fig 3 Bioinformatics prediction of miR-214 and lncRNA PVT1 3′UTR binding site

表8 荧光素酶报告基因实验检测miR-214与lncRNA PVT1的靶向关系
3 讨论
支气管哮喘是一种慢性炎性气道疾病,主要表现为气道炎性、气道高反应性和气道重塑。以肥大细胞、中性粒细胞和嗜酸粒细胞浸润为主要特征的气道炎性反应是哮喘最关键的病理过程[7]。减轻气道炎性反应和减轻气道上皮损伤是哮喘治疗不可缺少的。从辅助性T细胞分泌的IL-4、IL-5和IL-13等细胞因子参与哮喘的发生发展,并可促进IgE的产生[8]。在本研究中,OVA诱导哮喘小鼠后发现,小鼠炎性反应明显,肺组织损伤严重,揭示小鼠哮喘模型构建成功。
LncRNAs是指长度超过200个核苷酸的非编码RNA,越来越多的研究表明,lncRNAs在调节呼吸道炎性反应和气道重塑中具有重要作用[9]。哮喘的发病机制涉及炎性因子的释放和气道细胞屏障的损伤,lncRNA也可能参与调节哮喘的发生和发展。作为免疫调节因子的lncRNA MALAT1可以调节气道树突状细胞的成熟以及促炎细胞因子的分泌,从而促进炎性免疫的特定气道微环境的形成,并加剧气道炎性反应[10]。有研究发现[11],lncRNA PVT1的过表达可以增加炎性细胞因子IL-1β,IL-6和TNF-α的分泌,并促进气道上皮细胞的凋亡。在本研究中,lncRNA PVT1抑制物干扰哮喘小鼠后发现,炎性因子及IgE水平降低,肺组织中气道炎性反应减轻,表明lncRNA PVT1调节哮喘的炎性反应。
据报道,miRNAs与哮喘的发病机制有关。miR-146b、miR-206和miR-720可能参与NF-κB和GSK3/AKT信号通路的激活,并作为预测儿童哮喘恶化的生物标志物[12]。根据之前的实验,lncRNAs可以与miRNAs相互作用来调控其表达和功能。LncRNA PVT1与miR-214存在连续结合位点[13]。因此,本研究推测PVT1可能通过调节miR-214的表达影响哮喘进展。已有研究表明,Stat6是miR-214的一个潜在的靶基因。作为在体内外诱导巨噬细胞组织蛋白酶活性的关键因子,STAT6在过敏性气道疾病动物模型的黏液生成和气道炎性反应的进展过程中具有重要意义[14]。研究结果发现,哮喘小鼠在lncRNA PVT1抑制物干扰后,miR-214水平升高,STAT6磷酸化降低。LncRNA PVT1可能通过调节miR-214/STAT6轴减轻哮喘小鼠的炎性反应。
综上所述,抑制lncRNA PVT1表达可减轻哮喘小鼠的气道炎性反应,其作用机制可能是通过miR-214/STAT6轴发挥作用。本研究有助于阐明哮喘的发病机制,为哮喘的治疗提供新的靶点,但其作用机制仍需进一步研究。

